脂多糖对气道上皮细胞分泌炎症因子的影响*
2015-03-12况九龙
舒 艳,蔡 颖,况九龙
(南昌大学第二附属医院呼吸内科,南昌330006)
气道上皮细胞具有活跃的分泌功能,在外界因素的干预作用下,可以释放多种炎症因子,包括趋化因子如单核细胞趋化蛋白-1(monocyte chemotactic protein-1MCP-1),生长因子如人粒巨噬细胞集落刺激因子(human granulocyte-macrophage colony stimulating factor,GM-CSF),转化生长因子(transforming growth factor,TGF),其他因子如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),细胞间黏附分子(human intercellu-lar adhesion molecule,ICAM),血管细胞黏附分子等[1-5]。脂多糖(lipopolysaccharides,LPS)作为革兰阴性细菌细胞壁成分在人类工作或生活中无处不在,是一种具有强烈免疫调节作用的物质,能够诱导抗原提呈细胞产生IL-12和IFN-γ,促进TH1型反应而抑制TH2型反应[6],LPS还可以诱导CD14和TLR4信号通路激活固有免疫系统,从而活化转录因子NF-kB诱发炎性反应[7]。LPS是否通过影响气道上皮细胞MCP-1、TGF-β、TNF-α、ICAM-1和ICAM-2的分泌,从而参与气道的炎性反应,目前国内外文献尚缺乏相关报道。本实验通过采用不同浓度LPS干预气道上皮细胞不同时间后检测A549细胞MCP-1、TGF-β、TNF-α、ICAM-1和ICAM-2的分泌量的变化,从而为阐述气道炎性反应机制提供更多的理论基础。
1 材料与方法
1.1 材料 高糖双抗DMEM培养基、胰蛋白酶、LPS、冻存液,均购于北京Solarbio科技有限公司;胎牛血清,浙江天航生物科技有限公司;ELISA试剂盒,上海森熊科技实业有限公司。细胞培养基[取含高糖双抗(抗青霉素及链霉素)的DMEM培养基90mL,并加入胎牛血清10mL配成100mL的培养基];胰酶(准确称取胰酶0.25g,并将其溶于100mL PBS溶液中);LPS(将购买的来源于大肠杆菌O55:B5菌株的脂多糖10mg用PBS稀释配置成浓度为1mg/mL并分装至EP管内放置于-20℃冰箱内保存,待使用时解冻并用血清配置成干预浓度)。
1.2 方法 分别采用煮沸、涮洗、泡酸等物理和化学方法消毒实验玻璃器械。在紫外灯消毒超净工作台内进行细胞换液、传代、细胞冻存、细胞复苏及LPS干预(使脂多糖的终浓度为0、0.1、1.0、10.0、20.0、30.0、50.0μg/mL和100μg/mL,干预时间分别为2、4、8、24、30h)。直接收集药物干预后的细胞上清液,备用于ELISA检测。
1.3 统计学处理 采用SPSS17.0统计软件分析,计量资料以±s表示,应用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 各个时相点不同浓度LPS干预A549细胞后各因子分泌量的均数变化趋势图 在LPS干预浓度为20.0μg/mL,干预时间为4h和8h时,ICAM-1的分泌量达到峰值,见图1;LPS干预浓度为50.0μg/mL,干预时间为4h时,MCP-1的分泌量达到峰值,见图2;在其他时间点及LPS干预浓度,各炎症因子分泌量变化趋势不明显,见图3~5。

图1 ICAM-1平均数变化趋势图
2.2 各个时相点不同浓度LPS干预A549细胞后各因子分泌量方差分析的结果 不同浓度LPS在各个时相点干预A549细胞后其差异均有统计学意义(P<0.05),LPS能够干预TGF-β、TNF-α、MCP-1、ICAM-1、ICAM-2的分泌,见表1。

图2 MCP-1平均数变化趋势图

图3 ICAM-2平均数变化趋势图

图4 TGF-β平均数变化趋势图

图5 TNF-α平均数变化趋势图
2.3 各个时相点各因子分泌量达到最大(小)时与空白对照组比较的直方图 在干预时间为30h时,ICAM-2分泌量最大时与空白对照组比较,差异无统计学意义(P>0.05);在其余各时相点,ICAM-2分泌量最大时与空白对照组比较,差异有统计学意义(P<0.01);在干预时间为30h时,TGF-β有一个分泌量最小时的LPS干预浓度,且其与空白对照组相比,差异有统计学意义(P<0.01);在其余各时相点,TGF-β分泌量最大时与空白对照组比较,差异有统计学意义(P<0.01);在各个时相点,TNF-α、MCP-1、ICAM-1均存在一个分泌量达到最大时的LPS干预浓度,与空白对照组相比,差异有统计学意义(P<0.01),见图6~10。
表1 各个时相点不同浓度LPS干预A549细胞后炎症因子变化的结果(±s)

表1 各个时相点不同浓度LPS干预A549细胞后炎症因子变化的结果(±s)
2h 4h 8h 24h 30h ICAM-1 0.085 0±0.006 0 0.096 0±0.027 4 0.092 0±项目0.029 9 0.085 0±0.004 4 0.084 0±0.003 1 F 1 081.122 15.393 52.409 451.308 94.776 P<0.01 <0.01 <0.01 <0.01 <0.01 ICAM-2 0.118 0±0.005 3 0.117 0±0.008 5 0.117 0±0.006 5 0.117 0±0.008 2 0.117 0±0.009 3 F 71.326 256.959 332.867 994.857 474.568 P<0.01 <0.01 <0.01 <0.01 <0.01 MCP-1 0.226 0±0.101 7 0.124 0±0.050 0 0.188 0±0.045 3 0.122 0±0.026 0 0.430 0±0.087 6
续表1 各个时相点不同浓度LPS干预A549细胞后炎症因子变化的结果(±s)

续表1 各个时相点不同浓度LPS干预A549细胞后炎症因子变化的结果(±s)
2h 4h 8h 24h 30h F 47 488.271 11 607.497 8 229.743 3 765.014 645.0项目70 P<0.01 <0.01 <0.01 <0.01 <0.01 TGF-β 0.098 0±0.007 4 0.101 0±0.055 2 0.082 0±0.002 3 0.081 0±0.006 1 0.086 0±0.004 3 F 897.693 42.166 59.714 116.237 238.924 P<0.01 <0.01 <0.01 <0.01 <0.01 TNF-α 0.095 0±0.012 0 0.095 0±0.006 5 0.093 0±0.008 8 0.093 0±0.005 6 0.098 0±0.006 9 F 167.594 67.844 1 273.894 255.865 773.153 P<0.01 <0.01 <0.01 <0.01 <0.01

图6 ICAM-1分泌量最大时与空白对照组比较的直方图

图7 ICAM-W分泌量最大时与空白对照组比较的直方图
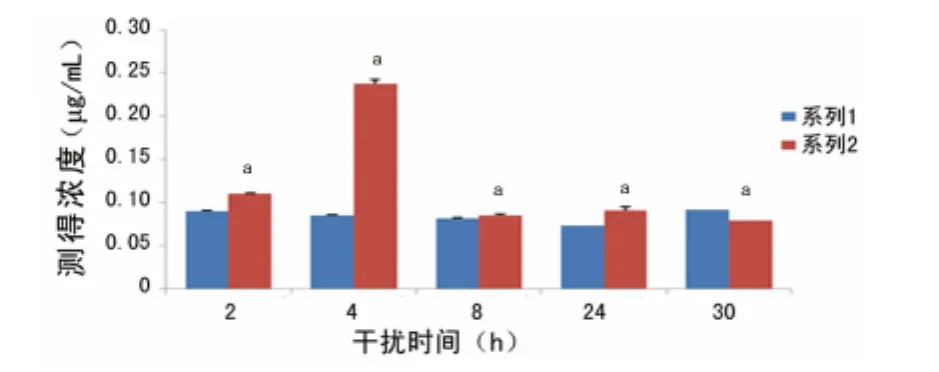
图8 TGF-β分泌量最大(小)时与空白对照组比较的直方图

图9 MCP-1分泌量最大时与空白对照组比较的直方图

图10 TNF-α分泌量最大时与空白对照组比较的直方图
3 讨论
本实验主要是研究不同时相点不同浓度LPS对气道上皮细胞分泌MCP-1、TGF-β、TNF-α、ICAM-1和ICAM-2的影响,分析炎症因子分泌量的变化,从而为探索气道炎症机制提供理论基础。
研究表明LPS可以通过TNF-α、IL-1β、诱生型一氧化氮合酶等影响巨噬细胞功能[8],而Muller-Decker等[9]在用LPS刺激小鼠舌源性上皮细胞系的实验中发现LPS并没有通过内源性炎症因子如TNF-α、TGF-β等影响上皮细胞功能,而本研究发现LPS可以干预气道上皮细胞对炎症因子MCP-1、TGF-β、TNF-α、ICAM-1和ICAM-2的分泌。对气道上皮细胞的研究中发现LPS能够干预气道上皮细胞分泌MCP-1,在LPS干预浓度为50.0μg/mL,干预时间为4h时,MCP-1的分泌量达到一个峰值,与上述结果相似;而且在各个时相点,都存在一个最佳的LPS干预浓度使MCP-1的分泌量达到最大,这就说明MCP-1可能在气道上皮细胞发生炎症的过程中起着重要作用。用LPS作为刺激因素建造的人体或是动物呼吸系统损伤模型都是以支气管肺泡内中性粒细胞灌注和炎症因子分泌增多为特征的,而且这个特征已经被用于检测新的抗炎药物[10];激活的巨噬细胞和上皮细胞能够产生炎症因子如TNF-α和IL-1β,这些炎症介质又可以诱导包括IL-6在内的其他炎症因子的释放[11];本研究也发现LPS能够干预气道上皮细胞TNF-α的分泌,且TNF-α的分泌量与LPS的干预浓度有关,在各个时相点,都存在一个最佳的LPS干预浓度,与上述结果基本一致。牟海波等[12]研究发现在树突状细胞的培养体系中加入TGF-β能够培养出更为幼稚的树突状细胞,且此种细胞对LPS的刺激呈现一种低反应性;近年来也有研究发现LPS可以通过LPS结合蛋白促进细胞释放炎症因子TGF-β和IFN-γ[13];本研究结果跟上述结果基本一致,本研究也发现LPS能够干预气道上皮细胞分泌TGF-β;万力等[14]研究发现一定浓度(0.005~0.100μg/mL)LPS干预并传代后成纤维细胞TGF-β分泌量增加的同时,IFN-γ分泌量降低,且呈量效依赖关系,随着LPS干预浓度的增加(0.5μg/mL),上述干预作用开始下降,当刺激浓度达到1.0μg/mL时,则呈相反作用,也就是说TGF-β分泌量下降而IFN-γ分泌量开始升高;本研究也发现TGF-β的分泌量跟LPS的干预浓度有关,而且跟LPS的干预时间也有关系,干预时间为24h内(包括24h)时,TGF-β的分泌量达到最大有一个最佳的LPS干预浓度,而在干预时间为30h时,TGF-β的分泌量反而出现下降趋势;而且还有人认为TGF-β缺乏的小鼠在生存的3周内就会发生全身炎性反应,而且这种炎性反应和小肠上皮细胞功能紊乱有关[15];目前,多数学者认为,肝脏的缺血再灌注损伤的核心仍然是炎性反应,主要由炎症细胞介导。ICAM-1通过与其配体LFA-1结合,启动细胞黏附和活化,使中性粒细胞牢固地黏附于血管壁;还有研究显示ICAM-1可以介导中性粒细胞通过内皮细胞全层,迁移至肝实质细胞,释放蛋白酶和反应性氧原子,造成肝细胞损伤[16];而在气道上皮细胞中对ICAM炎症因子家族的研究相对较少,而本研究对ICAM-1和ICAM-2同时做了研究,发现LPS能够干预气道上皮细胞分泌ICAM-1和ICAM-2,在LPS干预浓度为20.0μg/mL,干预时间为4、8h时,ICAM-1的分泌量可以达到峰值,而且在各个时相点,ICAM-1的分泌量均增加,且存在一个最佳的LPS干预浓度;而ICAM-2在除干预时间为30h以外的各时相点才和ICAM-1分泌量的变化表现一致。
本研究通过不同浓度的LPS在不同时相点干预A549细胞,并分析炎症因子TGF-β、TNF-α、MCP-1、ICAM-1和ICAM-2分泌量的变化,发现LPS可以对气道上皮细胞TGF-β,MCP-1,TNF-α,ICAM-1和ICAM-2的分泌量产生影响,而且上述炎症因子分泌量和LPS的干预浓度及干预时间有关,这就说明气道炎症性疾病的发生与各种损伤性刺激的强度和时间密切相关,而且他还提示在疾病发生的合适时机对疾病进行干预可能会起到更好的治疗作用。
[1] Peter RM,Robert JD,Jagdish LD.Airway epithelial cells,cytokines,and ollutants[J].Am J Respir Crit Care Med,1999,160(5):38-43.
[2] Hamel AL,Lin LL,Nayar GP.Nucleotide sequence of porcine circovirus associated with postweaning multisystemic wasting syndromein pigs[J].J Virol,1998,72:5262-5267.
[3] Moustakas A,Pardali K,Gaal A,et al.Mechanisms of TGF-beta signaling in regulation of cell growth and differentiation[J].Immunol Lett,2002,82(1/2):85-91.
[4] 李玉梅,卫红昌.ALI/ARDS抗炎治疗研究的策略与展望[J].中国病理生理杂志,2009,25(4):813-816,825.
[5] 曾春芳,吴亚梅.ICAM-1在慢性阻塞性肺疾病大鼠气道炎症中的作用[J].泸州医学院学报,2004,27(3):212-215.
[6] Liu AH.Something old,something new:indoor endotoxin,allergens and asthma[J].Paediatr Respir Rev,2004,5 Suppl A:S65-71.
[7] Barnes PJ.Transcription factors in airway diseases[J].Lab Invest,2006,86(9):867-872.
[8] Werling D,Hope JC,Howard CJ,et al.Differential production of cytokines reactive oxygen and nitrogen by bovine macrophages and dendritic cells stimulated with Tolllike receptor agonists[J].Immunol,2004,111:41-52.
[9] Muller-Decker K,Manegold G,Butz H,et al.Inhibition of cell proliferation by bacterial lipopolysaccharides in TLR4-positive epithelial cells:independence of nitric oxide and cytokine release[J].J Invest Dermatol,2005,124:553-561.
[10] Tralau-Stewart CJ,Williamson RA,Nials AT,et al.GSK 256066,an exceptionally high-affinity and selective inhibitor of phosphodiesterase 4suitable for administration by inhalation:in vitro,kinetic,and in vivo characterization[J].J Pharmacol Exp Ther,2011,337(1):145-154.
[11] Barnes PJ.Alveolar macrophages as orchestrators of COPD[J].COPD,2004,1(1):59-70.
[12] 牟海波,林茂芳,岑洪,等.转化生长因子β1抑制树突状细胞的成熟及下调TLR4的表达[J].中国病理生理杂志,2005,21(8):1476-1479.
[13] Yun KJ,Koh DJ,Kim SH,et al.Anti-Inflammatory effects of sinapic acid through the supp ression of inducible nitric oxide dynthase,cyclooxygase-2,and p roinflammatory cytokines rxpressions via nuclear factor kappaB inactivation[J].J Agric Food Chem,2008,56(21):10265-10272.
[14] 万力,李凤玉,闫永宏,等.脂多糖对正常人皮肤成纤维细胞增殖及转化生长因子-β1、γ-干扰素分泌的诱导作用[J].华北国防医药,2009,21(2):6-9.
[15] Ropeleski MJ,Tang J,Walsh-Reitz MM,et al.Interleukin-11-induced heat shock protein 25confers intestinal epithelial-specific cytoprotection from oxidant stress[J].Gastroenterology,2003,24:1358-1368.
[16] 张宝良,刘彤,朱理玮,等.实验性大鼠原位肝移植供肝热缺血损伤研究[J].天津医科大学学报,2006,12(1):8-10.
