RGCC基因在胃癌组织中的表达及其意义
2016-05-10尚超张佳星陈秀秀张家乐黄宝俊
尚超,张佳星,陈秀秀,张家乐,黄宝俊
(1中国医科大学附属第一医院,沈阳 110001;2中国医科大学基础医学院)
RGCC基因在胃癌组织中的表达及其意义
尚超1,2,张佳星1,陈秀秀1,张家乐1,黄宝俊1
(1中国医科大学附属第一医院,沈阳 110001;2中国医科大学基础医学院)
目的 探讨细胞周期调节基因(RGCC基因)在胃癌发生、发展中的作用。方法 选择胃癌患者65例,取其保存完整的胃癌组织及配对癌旁组织标本,采用实时定量PCR法检测RGCC mRNA相对表达量。采用单因素方差分析RGCC表达与胃癌患者临床病理参数的关系,以胃癌组织中RGCC mRNA相对表达量的平均值为界,将患者分为高表达组和低表达组,比较两组5年生存率。结果 胃癌组织RGCC mRNA相对表达量为2.505±0.502,癌旁组织为1.068±0.107,RGCC基因在胃癌组织中的表达明显高于癌旁组织(P<0.01)。Borrmann Ⅲ/Ⅳ型、弥漫型生长、分化程度低、浸润程度深、存在脉管癌栓、淋巴结分期晚的患者胃癌组织RGCC mRNA表达明显升高(P<0.05或<0.01),不同性别、年龄、癌灶大小及部位者胃癌组织RGCC mRNA表达均无统计学差异(P均>0.05)。高表达组5年生存率为31.0%,低表达组为64.2%,两组比较有统计学差异(P<0.01)。结论 RGCC基因在胃癌组织中表达升高,与肿瘤的恶性生物学行为和患者预后不良有关。
胃癌;细胞周期调节基因;恶性生物学行为;预后
胃癌是我国最常见的恶性肿瘤之一,发病率居各类肿瘤之首。近年来,虽然以手术为主结合放化疗的综合治疗水平不断提高,但中晚期患者术后5年生存率仅为30%左右[1,2]。深入研究胃癌发生和发展的分子机制,寻找效果更佳、特异性更好的治疗靶点是胃癌相关研究的重点。细胞周期调节基因(RGCC基因)为重要的补体应答基因,在细胞增殖分化、炎症反应、肿瘤发生和转移等过程中起关键作用,参与许多疾病的发生、发展[3~5]。本研究探讨RGCC基因在胃癌发生、发展中的作用。
1 资料与方法
1.1 临床资料 选择2008~2009年于中国医科大学附属第一医院进行手术的胃癌患者65例,男33例、女32例,年龄39~74岁、中位年龄60岁。患者临床资料完整,术前均未接受放疗和化疗。本研究均获得患者的知情同意。
1.2 胃癌组织RGCC mRNA表达检测 采用实时定量PCR法。取患者保存完整的胃癌组织及配对癌旁组织(距肿瘤3 cm以上)标本,TRIzol法提取总RNA,逆转录成cDNA。以GAPDH为内参基因,按照试剂盒说明书扩增RGCC基因。RGCC引物序列:上游引物:5′-TCAACCTTCTACCAGGCCACTC-3′,下游引物:5′-GCAAGCAGGTAAACAAAGTCAG-3′,引物长度102 bp;GAPDH引物序列:上游引物:5′-AGGTCGGTGTGAACGGATTTG-3′,下游引物:5′-GGGGTCGTTGATGGCAACA-3′,引物长度95 bp。反应体系:2×Premix Ex Taq 25 μL,F/R primer(10 μmmol/L)1 μL,50×ROX Reference Dye1 1 μL,模板4 μL,加水至50 μL。反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共40个循环。每个试验重复5次。采用7500荧光定量仪和7500 Software v2.0软件计算RGCC mRNA相对表达量,以2-ΔΔCT表示。
1.3 胃癌组织RGCC mRNA表达与患者临床病理参数的关系 收集患者的临床资料,包括年龄、性别、癌灶大小、癌灶部位、Borrmann分型、生长方式、分化程度、浸润深度、脉管癌栓及淋巴结分期情况,分析上述资料与RGCC mRNA表达的关系。
1.4 胃癌组织RGCC mRNA表达与患者预后的关系 以胃癌组织RGCC mRNA相对表达量的平均值为界,将患者分为高表达组和低表达组,计算并比较两组5年生存率。
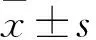
2 结果
2.1 胃癌与癌旁组织RGCC mRNA相对表达量比较 胃癌组织中RGCC mRNA相对表达量为2.505±0.502,癌旁组织为1.068±0.107,RGCC基因在胃癌组织中的表达明显高于癌旁组织(P<0.01)。
2.2 胃癌组织RGCC mRNA表达与患者临床病理参数的关系 Borrmann Ⅲ/Ⅳ型、弥漫型生长、分化程度低、浸润程度深、存在脉管癌栓、淋巴结分期晚的患者胃癌组织中RGCC mRNA的相对表达量明显升高(P<0.05或<0.01),患者的性别、年龄、癌灶大小及部位对胃癌组织中RGCC mRNA的相对表达量均无影响(P均>0.05)。见表1。
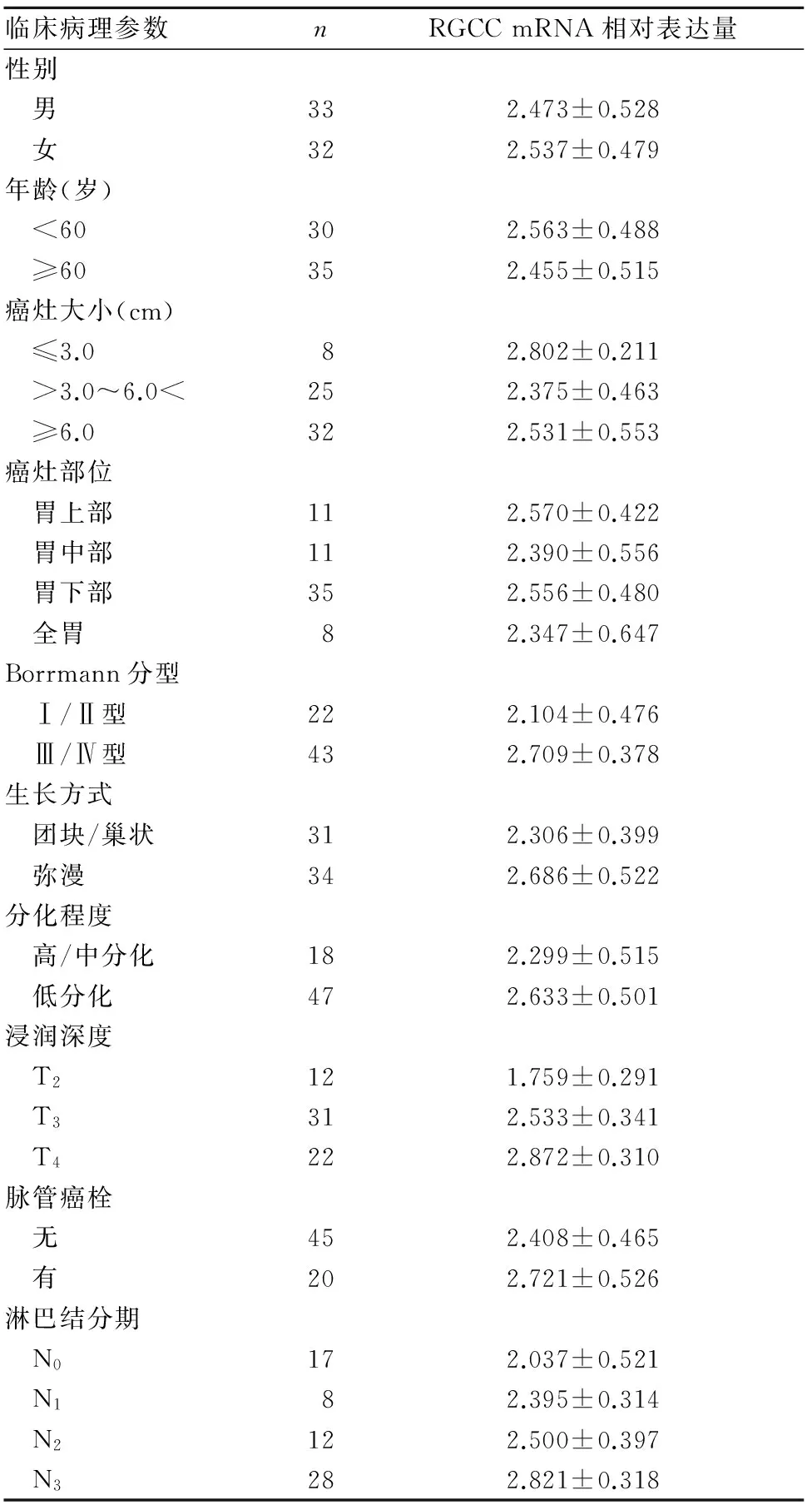
表1 胃癌组织RGCC mRNA表达与患者临床病理参数的关系
2.3 胃癌组织中RGCC mRNA表达与患者预后的关系 以胃癌组织中RGCC mRNA相对表达量的平均值2.505为界,高表达组39例,5年生存率为31.0%;低表达组26例,5年生存率为64.2%,低表达组生存率明显高于高表达组(P<0.01)。
3 讨论
RGCC基因是一种重要的补体应答基因,又名C13orf15、补体应答基因32(RGC32),定位于人染色体13q14.11[6]。RGCC基因在多种组织中广泛表达,具有调控细胞周期、促进细胞增殖分化及调节免疫反应等作用[7,8]。近期研究报道,RGCC基因在多种恶性肿瘤中呈高表达,包括结直肠癌、胰腺癌等,可能参与调节肿瘤细胞的增殖和侵袭等,从而发挥癌基因的作用[9,10]。
本研究结果显示,RGCC mRNA在胃癌组织中的表达明显高于癌旁组织;Borrmann Ⅲ/Ⅳ型、弥漫型生长、分化程度低、浸润程度深、存在脉管癌栓、淋巴结分期晚的患者胃癌组织中RGCC mRNA表达明显升高,不同性别、年龄、癌灶大小及部位者癌组织中RGCC mRNA表达无统计学差异,说明RGCC mRNA高表达与肿瘤的恶性生物学行为有关。夏祥伟等[11]应用免疫组化方法检测RGCC蛋白在胃癌组织中的表达,亦得出RGCC在胃癌组织中高表达的结论,且其表达与胃癌分化程度、TNM分期和淋巴结转移有关。付尚志等[12]在结肠癌研究中亦发现类似现象。本研究结果显示,RGCC低表达的患者生存率明显高于高表达者,说明RGCC能够作为胃癌患者预后不良的生物学标志物之一。
综上所述,RGCC基因在胃癌组织中表达升高,可促进胃癌的发生及发展,与肿瘤的恶性生物学行为和患者预后不良密切相关。RGCC基因可作为胃癌生物治疗的新靶点,但是其具体作用机制尚不清楚,仍需进一步深入研究。
[1] Inokuchi M, Otsuki S, Fujimori Y, et al. Clinical significance of MET in gastric cancer [J]. World J Gastrointest Oncol, 2015,7(11):317-327.
[2] 朱正刚.胃癌复发、转移诊治难点与对策[J].中国实用外科杂志,2015,35(10):1037-1039.
[3] Cui XB, Luan JN, Ye J, et al. RGC32 deficiency protects against high-fat diet-induced obesity and insulin resistance in mice[J]. J Endocrinol, 2015,224(2):127-137.
[4] Tegla CA, Cudrici CD, Azimzadeh P, et al. Dual role of response gene to complement-32 in multiple sclerosis [J]. Exp Mol Pathol, 2013,94(1):17-28.
[5] Feik E, Schweifer N, Baierl A, et al. Integrative analysis of prostate cancer aggressiveness[J]. Prostate, 2013,73(13):1413-1426.
[6] Vlaicu SI, Cudrici C, Ito T, et al. Role of response gene to complement 32 in diseases[J]. Arch Immunol Ther Exp (Warsz), 2008,56(2):115-122.
[7] Wang QJ, Song BF, Zhang YH, et al. Expression of RGC32 in human normal and preeclamptic placentas and its role in trophoblast cell invasion and migration[J]. Placenta, 2015,36(4):350-356.
[8] Vlaicu SI, Tegla CA, Cudrici CD, et al. Role of C5b-9 complement complex and response gene to complement-32 (RGC-32) in cancer[J]. Immunol Res, 2013,56(1):109-121.
[9] Lu Y, Hu XB. C5a stimulates the proliferation of breast cancer cells via Akt-dependent RGC-32 gene activation[J]. Oncol Rep, 2014,32(6):2817-2823.
[10] Vlaicu SI, Tegla CA, Cudrici CD, et al. Epigenetic modifications induced by RGC-32 in colon cancer[J]. Exp Mol Pathol, 2010,88(1):67-76.
[11] 夏祥伟,茅国新.RGC-32和ZEB1在胃癌组织中的表达[J].肿瘤基础与临床,2015,28(3):193-197.
[12] 付尚志,张佳节,李万平.直肠癌术前新辅助放化疗研究进展[J].临床军医杂志,2015,43(4):409-412.
国家自然科学基金资助项目(81272716);辽宁省社会发展攻关计划(2012225016)。
黄宝俊(E-mail: huang_bj@163.com)
10.3969/j.issn.1002-266X.2016.16.029
R735.2
B
1002-266X(2016)16-0077-03
2016-01-02)
