葛根素固体脂质纳米粒制备工艺研究①
2016-04-14胡孟洋翟美芳张灵芝李雪欣
刘 娟,郭 宇,胡孟洋,翟美芳,平 洋,张灵芝,李雪欣,于 莲
(1.佳木斯大学药学院,黑龙江 佳木斯 154007;2.山东大学临床医学专业2012级4班,山东 济南 250000)
葛根素固体脂质纳米粒制备工艺研究①
刘娟1,郭宇1,胡孟洋2,翟美芳1,平洋1,张灵芝1,李雪欣1,于莲1
(1.佳木斯大学药学院,黑龙江 佳木斯 154007;2.山东大学临床医学专业2012级4班,山东 济南 250000)
摘要:目的:研究葛根素固体脂质纳米粒的制备工艺。方法:采用乳化-超声法制备葛根素固体脂质纳米粒,以单因素影响考察制备葛根素固体脂质纳米粒的工艺因素,通过正交试验设计优化制备工艺,并对包封率进行考察。结果:采用正交试验筛选出的最佳工艺为制备温度为78℃,加热时间为10min,搅拌速度为900rpm,超声时间为10min。根据筛选出的最佳工艺制备3批葛根素固体脂质纳米粒溶液,包封率为96.43%,载药量为1.47%。结论:通过工艺的筛选制备得到葛根素固体脂质纳米粒澄明度较好,有蓝色乳光,包封率和载药量较高,本研究方法可作为制备葛根素固体脂质纳米粒的制备方法。
关键词:葛根素;固体脂质纳米粒;制备工艺;研究
葛根为豆科植物野葛Pueraruia lobata(Willd1) Ohwi或甘葛藤Pueraruia thomsonii Benth1的干燥根,葛根素作为葛根中的主要药效成分,其在临床上主要用于治疗脑梗死、高血压、糖尿病、冠心病、心绞痛等疾病,对心、肝、肾具有保护作用[1]。但是由于葛根素结构中具多苯环和多羟基的原因,其极性较大,水溶性较小,脂溶性也小,难以被胃肠道等生物膜吸收,口服生物利用度小于15%,限制了临床的应用。为了延长葛根素在体内血液循环的时间,提高葛根素的生物利用度,本文将用固体脂质纳米粒作为葛根素的药物载体。固体脂质纳米粒(SLN) 是以生理相容的高熔点脂质为骨架材料制成的纳米粒。骨架材料在室温下通常呈固态,因此既具备聚合物纳米粒的物理稳定性高药物泄漏少的优势,又兼具脂质体乳剂的毒性低能大规模生产的优点,是一种极有发展前景的新型给药系统的载体[2~4]。
1仪器与试药
Agilent 1100型高效液相色谱仪(美国安捷伦公司);FA2004N电子分析天平(上海恒平科学仪器有限公司);TGL-16M台式高速冷冻离心机(长沙平凡仪器仪表有限公司);冷冻干燥机(美国VirTis);DF-101S集热式恒温加热磁力搅拌器(河南省予华仪器有限公司);JY92-2D超声波细胞粉碎机(宁波新芝生物科技股份有限公司);WD-A药物稳定性检查仪(天津药典标准仪器厂);葛根素标准品(中国食品药品鉴定研究院);葛根素原料药(陕西惠诚生物科技有限公司);甲醇色谱纯(天津市科密欧化学试剂有限公司);甲醇(天津市科密欧化学试剂有限公司);无水乙醇(天津市科密欧化学试剂有限公司);甘露醇(北京化学试剂公司);单硬脂酸甘油酯(天津市科密欧化学试剂有限公司);泊洛沙姆(南京威尔化工有限公司);水为纯化水;其余试剂均为分析纯。
2方法
2.1葛根素固体脂质纳米粒的制备
称取葛根素10mg,加入甲醇定容至10mL,超声溶解,得葛根素甲醇溶液;称取单硬脂酸甘油酯150mg,加入少量无水乙醇将单硬脂酸甘油酯超声溶解,得单硬脂酸甘油酯溶液;称取泊洛沙姆125mg,加入蒸馏水溶解至25mL容量瓶,超声溶解,得0.5%泊洛沙姆溶液。上述三种溶液加热至78℃,将葛根素甲醇溶液与单硬脂酸甘油酯溶液混合得到油相,再将水相泊洛沙姆溶液缓慢滴加至油相中并搅拌,搅拌速度为900rpm,搅拌时间为10min,将初乳超声,超声功率60%,超声破碎10min,冰水浴固化,过0.45μm水系滤膜,即得。
2.2葛根素体外分析方法的建立2.2.1最大吸收波长的测定
称取葛根素对照品适量,用30%的乙醇溶解并稀释,配成20μg/mL 的溶液备用。以30%的乙醇为空白溶液,在200~400nm 的波长范围内进行光谱扫描,取空白固体脂质纳米粒溶液适量,加入30%的乙醇超声溶解并定容至10mL,同法对空白固体脂质纳米粒的30 %的乙醇溶液进行紫外扫描。
2.2.2色谱条件
色谱柱:C18(250mm×4.6mm,5μm);流动相:甲醇-水=40:60;流速:1.0 mL/min;柱温:室温;检测波长:250nm;进样量:10μL。
2.2.3专属性考察
分别取3 mL空白葛根素固体脂质纳米粒溶液、对照品溶液和葛根素固体脂质纳米粒溶液置于10mL的容量瓶中,用甲醇定容至刻度,过0.22μm滤膜,按上述色谱条件分别进样10μL。
2.2.4标准曲线的制备
精密称取葛根素标准品适量,用30%的乙醇配置成5个不同浓度的一系列标准溶液。按上述确定的色谱条件,分别取10μL进样,以峰面积(A)对葛根素的浓度(C)进行线性回归。
2.2.5精密度试验
分别取三种浓度的葛根素标准溶液各5份,一天内重复进样5次,计算日内精密度;将葛根素标准溶液放置4℃冰箱内,并每天进样1次,连续进样5d,计算日间精密度。
2.2.6回收率试验
精密吸取不同体积葛根素储备液于容量瓶中,配制成三种不同浓度的葛根素溶液,记录色谱图和峰面积,代入标准曲线计算葛根素浓度。以实际浓度与相应理论浓度之比,计算方法回收率。
2.2.7定量限和检测限
在前述色谱条件下,配制一系列已知低浓度葛根素标准品溶液,用0.22μm微孔滤膜过滤,进样10μL,并测定其信号。
2.3葛根素基本理化性质研究2.3.1溶解性质考察
将葛根素溶解在甲醇、无水乙醇、乙醚和30 %的乙醇溶剂中,观察各溶剂内葛根素的溶解情况。
2.3.2油水分配系数的测定
本实验用正辛醇法测定油水分配系数。精密量取适量的葛根素放入水中,超声溶解,采用以上色谱条件测定葛根素在水中的浓度,记C0。将用水饱和过的正辛醇及上述溶液装入三角瓶中,混匀。将此三角瓶放入37℃的恒温水浴中搅拌72 h,取出后静置。按以上色谱条件测定平衡后的水相中的药物浓度,记C。
(1)
P为油水分配系数;C0为水相中药物初始浓度;C为分配平衡后水相中药物浓度。
2.3.3葛根素光稳定性试验
精密称取葛根素原料药5 mg置于西林瓶中,另配制浓度为20 μg/mL的葛根素甲醇溶液,自然光下放置,分别于0、3、4、6、8 h取样测定,计算葛根素的百分含量。
2.3.4葛根素热稳定性试验
精密称取葛根素原料药5mg置于西林瓶中,放置在35℃的烘箱中,同时配制浓度为20μg/mL的葛根素甲醇溶液,放置在35℃的恒温水浴中。分别于5、10、30、60、80、120min取样测定,计算葛根素的百分含量。
2.4制备工艺的单因素考察
分别对搅拌速度、制备温度、搅拌时间、超声时间四个中的一个为变量来做单因素试验。以包封率为评价指标,依次进行下列四个单因素试验:搅拌速度(400、600、800rpm)、制备温度(70、72、75℃)、搅拌时间(5、10、15min)、超声时间(8、10、12min)。考察各因素的不同水平对葛根素固体脂质纳米粒的包封率的影响。
2.5正交试验优化工艺
选取影响较为显著的4个因素,进行L9(34)正交试验优化工艺。
2.6质量评价初步研究
2.6.1外观观察
室温条件下,肉眼观察葛根素固体脂质纳米粒溶液的外观。
2.6.2葛根素固体脂质纳米粒的冻干粉末
以6 %的甘露醇为冻干粉末保护剂,放入冷冻干燥机中,24h后取出立即压盖密封,即得葛根素固体脂质纳米粒冻干粉。
2.6.3稳定性考察
按最优处方制备3批葛根素固体脂质纳米粒溶液,葛根素固体脂质纳米粒溶液分别放置在4 ℃和室温下放置保存。于1、2、3个月观察外观,并分别取样测定其包封率。
2.6.4包封率及载药量的测定
取0.5mL葛根素固体脂质纳米粒溶液置于离心管上端,10000rpm,离心10min,滤液用甲醇定容至10mL,按“2.2.2“”项色谱条件下进样检测。另取葛根素固体脂质纳米粒溶液0.5mL置于10mL容量瓶中,用甲醇超声,并定容至刻度,离心,按“2.2.2”项色谱条件下进样检测,按下列公式计算包封率及载药量。
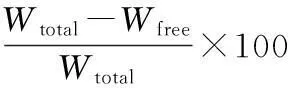
(2)

(3)
公式中Wtotal为药物的加入总量,Wfree为葛根素固体脂质纳米粒溶液中游离的药物量,Wlipid为纳米粒的总重量。
3实验结果
3.1葛根中葛根素的体外分析方法的建立
3.1.1最大吸收波长的测定
葛根素标准品溶液在250nm有最大吸收,见图1,相应浓度的空白葛根素固体脂质纳米粒溶液在此处无干扰,见图2,因此选择250nm用于检测葛根中葛根素含量的检测波长。

图1葛根素标准品的紫外扫描图谱
3.1.2专属性考察
空白葛根素固体脂质纳米粒溶液、对照品溶液和葛根素固体脂质纳米粒溶液,色谱见图3。B、C中葛根素的保留时间分别为8.754 min和8.908 min。

图2 空白固体脂质纳米粒的紫外扫描图谱
3.1.3标准曲线的制备
分别对不同浓度的葛根素标准溶液进样,绘制标准曲线见图4。得线性回归方程:A=26.263C+11.600(r=0.9996),结果表明葛根素在16~80μg/mL范围内线性关系良好。


图4 葛根素的标准曲线
3.1.4精密度试验
分别计算日内及日间精密度,见表1。葛根素标准品溶液的精密度均小于3%,符合方法学要求。

表1 精密度测定结果(n=5)
3.1.5回收率试验
回收率计算结果见表2。此分析方法回收率均小于3 %,符合方法学要求。

表2 回收率测定结果(n=3)
3.1.6定量限和检测限的测定
当信号值/基线噪声值=2~3对应的已知浓度,就是检测限。当信号值/基线噪声值=10对应的已知浓度,就是定量限,得到最低检测限浓度为5ng/mL,最低定量限浓度为10ng/mL。
3.2葛根素基本理化性质研究3.2.1溶解性测定
葛根素在甲醇、30 %的乙醇的溶解度依次减弱,在乙醚和无水乙醇中的溶解度大体一样,见表3。

表3 葛根素在不同溶液中的溶解性
注:+溶解较差,溶解较好,溶解最好。
3.2.2油水分配系数的测定
当计算出LogP大于零,药物为脂溶性药物,结果表明,葛根素为亲脂性药,见表4。

表4 葛根素的油水分配系数(n=3)
3.2.3葛根素光稳定试验
通过测定葛根素原料药及葛根素溶液的百分含量,结果显示葛根素对光基本稳定,见表5。

表5 葛根素光稳定试验
3.2.4葛根素热稳定性试验
通过测定葛根素原料药的百分含量,结果显示葛根素对热基本稳定。见表6。

表6 葛根素热稳定试验
3.3制备工艺的单因素考察
3.3.1搅拌速度对葛根素固体脂质纳米粒包封率的影响
其他因素保持不变,不同搅拌速度所得包封,见图5,从图5可以看出搅拌速度为800rpm时药物的包封率较其他两组高。

图5 搅拌速度对包封率的影响
3.3.2制备温度对葛根素固体脂质纳米粒包封率的影响
其他因素保持不变,不同制备温度所得包封,见图6,从图6中可以看出制备温度为75℃时药物的包封率较其他两组高。

图6 制备温度对包封率的影响
3.3.3加热时间对葛根素固体脂质纳米粒包封率的影响
其他因素保持不变,不同加热时间所得包封,见图7,从图7中可以看出加热时间为10min时药物的包封率较其他两组高。

图7 加热时间对包封率的影响
3.3.4超声时间对葛根素固体脂质纳米粒包封率的影响
其他因素保持不变,不同超声时间所得包封,见图8,从图8中可以看出超声时间为10min时药物的包封率较其他两组高。

图8超声时间对包封率的影响
3.4正交试验优化工艺
本实验在单因素考察的基础上,以包封率为考察指标,筛选出影响葛根素固体脂质纳米粒溶液包封率的四个因素:转数(A)、加热温度(B)、加热时间(C)、超声时间(D)。每个因素选取3个水平,因素水平见表7。以包封率为筛选指标,用正交试验表L9(34)对工艺进行优化。正交试验设计及见表8。

表7 正交试验的因素水平表

表8 L9(34)正交试验
由表中极差值R可以看出各因素影响的主次顺序为B>D>A>C,说明加热温度、超声时间、搅拌速度、加热时间对药物包封率的影响依次减弱。由此可知各因素的最优化组合为A3B3C2D3。最佳工艺为:转数900rpm,加热温度78℃,加热时间10min,超声时间10min。
3.5质量评价研究
3.5.1外观观察
室温下,观察葛根素固体脂质纳米粒溶液的外观比较澄清透明,并伴有蓝色乳光。
3.5.2葛根素固体脂质纳米粒溶液的冻干结果
以甘露醇为冻干粉末的葛根素固体脂质纳米粒,外形饱满,颗粒疏松,表面光滑。
3.5.3稳定性观察结果
葛根素稳定性,见表9。葛根素固体脂质纳米粒溶液在4℃保存下,微粒较稳定;在室温下保存,微粒变化较大。
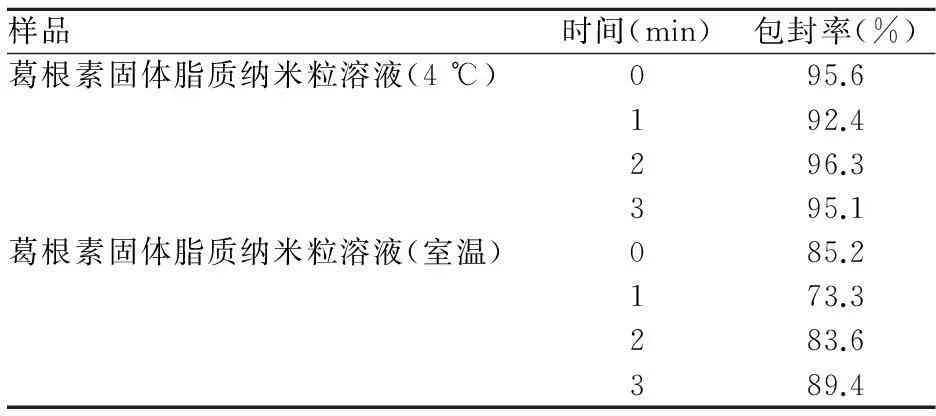
表9 葛根素固体脂质纳米粒溶液及冻干粉
3.5.4包封率及载药量测定
按"2.6.4"项下测定方法及计算公式得包封率及载药量,测得的平均包封率为96.43 %,载药量为1.47 ,见表10。

表10 葛根素固体脂质纳米粒溶液的包封率
4讨论
本实验建立了体外分析方法,确立了用高效液相色谱法进行葛根素固体脂质纳米粒的含量测定。采用乳化-超声分散法制备葛根素固体脂质纳米粒溶液,从经济学的角度考虑,乳化-超声分散法操作简单,可控性较强,质量影响因素相对较少[5,6]。 以包封率为评价指标,采用L9(34)正交试验设计方法表明,最终确定优化后的制备工艺为:制备的时候搅拌速度为900rpm,制备温度为78℃,搅拌时间为10min,超声时间为10min。将超声后的葛根素固体脂质纳米粒溶液过0.45μm滤膜,即可得有蓝色乳光的葛根素固体脂质纳米粒溶液。
参考文献:
[1]刘青,周金海.葛应用根的临床[J].中国临床医生,2003,31(2):55-56
[2]Muller H,Mader K,Gohla S.Solid lipid nanoparticles(SLN) for controlled drug delivery a review of the state of the art Eur [J] .Pharm Biopharm,2000,50(1):161-177
[3]Mehnert W,Madex K.Solid lipid nanoparticles:Production characterization and app lications [J].Adv Drug Deliv Rev ,2001,47(2/3):165-196
[4]陈玲,周建平.固体脂质纳米粒研究新进展[J]. 药学进展,2003,27(6):354-358
[5]韩雪冰,于莲,乔越,等. 白桦脂醇脂质体的制备及其制剂学研究[J].黑龙江医药科学,2015,38(2):1
[6]平洋,曹越盛,于莲. 黄芩苷固体脂质纳米粒的制备及表征研究[J].黑龙江医药科学,2013,36(5):13
Study on the preparation of puerarin solid lipid nanoparticles
LIUJuan1,GUOYu1,HUMeng-yang2,ZHAIMei-fang1,PINGYang1,ZHANGLing-zhi1,LIXue-xin1,YULian1
(1.College of Pharmacy, Jiamusi University, Jiamusi 154007, China; 2.Department of Clinical Medicine, Shandong University, Jinan 250000, China)
Abstract:Objective: To explore the preparation process of puerarin solid lipid nanoparticles. Methods:Puerarin solid lipid nanoparticles were prepared by using emulsion ultrasonic method. We investigated single factors in the preparation process. The optimum experimental process was filtrated by using orthogonal test.The drug loading of puerarin solid lipid nanoparticles were investigated in the research. Results: The optimum experimental process filtrated by using orthogonal test is that the preparation temperature is 78℃, the heating time is 10min, the stirring speed is 900rpm and the ultrasonic time is 10min. According to the optimum experimental process, the 3 batches of puerarin solid lipid nanoparticles liquor are prepared in the research. The encapsulation rate is 96.43%. The drug loading is 1.47%. Conclusions: Puerarin solid lipid nanoparticles prepared by the selection of technology has preferable clarity, blue opalescence and higher encapsulation rate and drug loading. This method can be used to prepare the puerarin solid lipid nanoparticles.
Key words:puerarin; solid lipid nanoparticles; preparation technology; researc
(收稿日期:2015-11-11)
中图分类号:R284
文献标识码:A
文章编号:1008-0104(2016)01-0001-05
作者简介:刘娟(1949~)女,黑龙江佳木斯人,教授,硕士研究生导师。通讯作者:郭宇(1988~)女,黑龙江佳木斯人,在读硕士研究生。E-mail:Guoyu1988@163.com。
基金项目:①国家自然科学基金项目,编号:81274101。
