间充质干细胞对肿瘤作用的双向性:促进或抑制
2016-04-14胡文龙,邬亚华,殷嫦嫦等
间充质干细胞对肿瘤作用的双向性:促进或抑制
胡文龙1,2邬亚华2殷嫦嫦2施剑明1殷明1
(南昌大学研究生院医学部,江西南昌33006)
〔关键词〕间充质干细胞;肿瘤;生长;转移
间充质干细胞(MSCs)是具有向肿瘤组织定向迁移能力的多能干祖细胞〔1〕,到达肿瘤组织的MSCs参与形成肿瘤的纤维血管组织,分化形成肿瘤相关成纤维细胞(TAFs)和血管周细胞〔2〕。研究表明MSCs促进肿瘤生长和转移,也有研究显示MSCs抑制肿瘤生长。出现这种矛盾的原因尚不清楚。有研究者将MSCs作为运载抗肿瘤制剂的特异性细胞载体〔3〕。但是基于目前的研究,还不能说MSCs是一个合格的载体工具,另外抗肿瘤制剂的肿瘤靶向产物是否能克服MSCs的内源性促瘤作用,在什么条件下MSCs促进或抑制肿瘤的生长和转移,这是运用MSCs作为载体治疗肿瘤所要解决的两大难题。本文主要综述体内MSCs对肿瘤的影响并试图分析文献报道中的矛盾。
1MSCs的组织来源及功能
采用相同的方法可从成人和胎儿的多种组织中分离得到MSCs〔4〕。骨髓和脂肪组织MSCs含量丰富〔5〕,成人肾脏、皮肤、甲状旁腺也可分离得到MSCs〔6〕。MSCs或类间充质干细胞也可以从胎儿组织分离,包括皮肤、脐带和胎盘〔7,8〕。各种不同组织来源的MSCs和骨髓MSCs具有许多相同的重要特性,包括细胞表面标志物的表达,塑料贴壁性,分化为间叶组织细胞的能力(脂肪、骨、肌肉、软骨)〔5〕。此外,MSCs具有肿瘤趋向性,利用该特征可将它们与其他间充质细胞区分开来,例如成纤维细胞等〔9〕。
MSCs具有促进伤口愈合和支持造血功能,一旦到达损伤部位时,MSCs就能分化成结缔组织成分,支持血管生成,分泌细胞因子和生长因子,促进愈合。研究者们对骨髓MSCs促进修复的作用进行广泛的研究,包括在缺血性心脏病、糖尿病和帕金森病〔10〕等疾病展开的研究。
MSCs对肿瘤细胞的作用可能与其促进伤口愈合的功能相似。肿瘤中的MSCs分化为成纤维细胞和周细胞,并且可能分化为内皮样细胞或血管基质细胞〔11〕。此外,MSCs能分泌基质蛋白和细胞因子促进肿瘤细胞增殖、迁移和支持血管生成,例如血管内皮生长因子(VEGF)和血小板源性生长因子(PDGF)〔12〕。
MSCs也有复杂的免疫调节功能,能通过抑制宿主的免疫反应和纤维化来抑制炎症反应。利用MSCs的免疫抑制特性可以降低同种异体骨髓移植的细胞毒性反应,进而治疗移植物抗宿主疾病〔13〕。
2MSCs促进肿瘤生长

表1 MSCs促进肿瘤生长
研究证实MSCs能促进肿瘤生长(见表1)。Karnoub 等〔14〕将人MSCs(hMSCs)与绿色荧光蛋白标记的人乳腺癌细胞(MCF/Ras、MDAMB-231、MDAMB-435、HMLER)按3∶1一起注入裸鼠体内,结果MSCs能促进MCF/Ras细胞系增长,对其他三种类型细胞生长无影响,但其能促进所有类型细胞系发生转移。骨髓来源的MSCs能促进体内骨肉瘤细胞的生长,体外实验中,ELISA检测发现MSCs能分泌CCL5,将CCL5抗体加入含MSCs条件培养基的骨肉瘤细胞系Sao-2细胞中,MSCs促进该细胞系的增殖作用消失,说明CCL5参与了MSCs对骨肉瘤的作用过程〔15〕。进一步研究发现MSCs与Saos-2均能分泌IL-6,并因此促进彼此增殖〔16〕。MSCs对前列腺癌也有显著的促生长作用,且MSCs进入前列腺癌微环境后,新生血管相关标志物(巨噬细胞炎性蛋白-2、血管内皮生长因子、转化生长因子-β、IL-6)增加。Hernanda 等〔17〕发现Huh7细胞与MSCs一起移植入裸鼠体内,形成的肝癌体积明显大于单独移植。人脐带MSCs能通过活化NF-κB通路明显促进胃癌细胞的增殖及迁移〔20〕。
脂肪组织含有丰富的多能MSCs,即脂肪干细胞(ASCs),与骨髓间MSCs功能相似,具有肿瘤趋向性。Muehlberg等〔21〕发现ASCs能促进鼠体内肿瘤模型的生长,ASCs和乳腺癌细胞株(MCF-1)一起移植导致了瘤体形成更快和体积更大。在大部分报道中,MSCs都是加入到一定数量的肿瘤细胞中,这就导致增加的细胞总数可能包括肿瘤细胞和MSCs,已有证据显示,在体内肿瘤细胞存在的情况下,MSCs能增殖,而单独移植的MSCs则不能增殖〔3〕。因此,实验观察到的肿瘤体积增加可能与是肿瘤细胞数量的增加或MSCs的增加,或两者均有。然而,肿瘤基质细胞所占这比例却未能确定,因此在下“MSCs促瘤生长”的结论时必须谨慎。
3MSCs抑制肿瘤生长
矛盾的是,也有许多研究证明MSCs抑制肿瘤生长(表2)。人类胎儿皮肤来源的MSCs能通过抑制增殖、细胞集落形成和致癌基因表达抑制体内外人肝癌细胞〔25〕。肝癌细胞与相同数量的MSCs共注射,延迟了肿瘤的发展并缩小了肿瘤的体积。同样来源的MSCs抑制MCF-7的体外增长〔26〕。研究人员发现用MSCs的条件培养基处理肿瘤细胞后导致了生存因子的下调,例如β-catenin、c-Myc和存活素。这种效应是由MSCs分泌的β-catenin信号通路的抑制剂(DKK-1)介导的〔26〕。
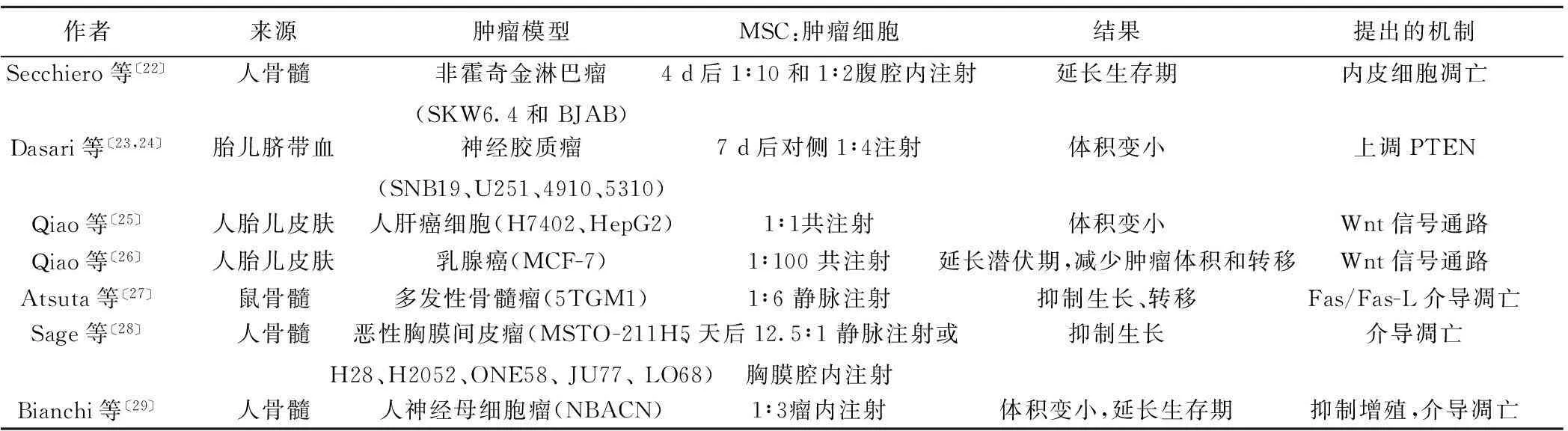
表2 MSCs抑制肿瘤生长
PTEN:同源性磷酸酶-张力蛋白
骨髓源性的MSCs抑制了裸鼠多发性骨髓瘤的生长,抑制了其股骨颈骨质的再吸收及肿瘤细胞向肺和肾脏的转移。同时,体外实验发现Fas/Fas-L介导的细胞凋亡在MSCs抑制多发性骨髓瘤的生长过程中发挥了重要作用〔27〕。Sage等〔28〕发现MSCs能表达肿瘤坏死因子相关凋亡诱导配体(TRAIL),进而介导恶性胸膜间皮瘤的凋亡。静脉注射的MSCs通过增加肿瘤细胞的凋亡延缓了间皮瘤的生长。MSCs能抑制NBACN细胞的增殖并促进其凋亡,使注射了MSCs的裸鼠的神经母细胞瘤模型生长受到了明显抑制,从而延长了该组裸鼠的生存期〔29〕。Jin等〔30〕研究表明MSCs对肿瘤的作用取决于肿瘤微环境,黑色素瘤细胞活化的浸润淋巴细胞(TIL)激发MSCs向TH1表型分化,活化的MSCs分泌IL-12和吲哚胺2,3加双氧酶(IDO)发挥抗肿瘤的免疫调节效应。
4MSCs对肿瘤生长的影响因素
MSCs对肿瘤细胞的作用是复杂多变的,对肿瘤生长表现出促进或抑制的双向性。MSCs能与肿瘤周围的细胞相互作用,如免疫细胞(巨噬细胞和T细胞)和内皮细胞。其他类型的细胞也在调节肿瘤进展中发挥作用。
不同来源的MSCs是产生矛盾结果的主要因素。脂肪组织〔31〕和胎儿皮肤〔26〕来源与骨髓〔17〕来源的MSCs对乳腺癌细胞起着完全相反的作用。Belmar-Lopez等〔32〕比较了五种不同来源(脂肪、骨髓、羊膜、子宫内膜上皮及间质)的MSCs对宫颈癌(HeLa)细胞的作用,结果它们在趋化性、促瘤增殖及迁移的能力均表现出不同程度的差异。
MSCs的异质性可能是文献中MSCs对肿瘤影响不一致的主要原因之一。文献中所用的MSCs大多数是根据干细胞的塑料贴壁性分离培养的,这类细胞表达相似的细胞表面标志物,但是,它们在关键的地方有着面标志物,现已有几个标志物被提出,如NG2〔33〕。Waterman等〔34〕对表型不同的两种MSCs(MSC1和MSC2)进行了研究,发现两者对卵巢癌分别产生了抑制和促进的作用。
体内肿瘤模型的差异很大,也可能导致研究的结果的不同。肿瘤免疫、缺氧、血管生成和细胞因子等因素在这些文章的模型中都有巨大差异。然而,对于MCF-7细胞,不同学者发现MSCs能促进和抑制肿瘤发展,表明肿瘤模型并不是唯一影响研究结果的因素。
移植入的MSCs的量可能是影响肿瘤生长的决定因素。文献分析结果显示:报告促生长作用的研究者倾向于使用较高的MSCs——肿瘤细胞比。然而,低百分比的MSCs,如Xu等〔15〕使用10%的MSCs,也能促进骨肉瘤的生长和转移。有报道〔21〕称,MSCs比例增高可以进一步促进肿瘤的生长,这表明在合适条件下,MSCs的促瘤生长作用可能存在细胞数量依赖性。
MSCs引入到肿瘤细胞微环境的时机也可能是一个重要影响因素。建好肿瘤模型后再把MSCs注入体内的文章多报告为抑瘤生长作用〔23,24〕。相比之下,报告促增长作用的文章基本都将MSCs与肿瘤细胞混合注射或同步注射。MSCs在肿瘤生长的早期促进了肿瘤的进程,例如血管生成,这是肿瘤发生所必需的。这与研究MSCs和脉管系统相互作用的文章结果一致。
最后,不同患者之间存在的个体差异可能也导致了治疗结果的争议。或许是由于遗传、后天获得或环境作用,使MSCs对肿瘤微环境产生了不同的作用。对癌症易感者的MSCs进行研究,如体细胞突变或环境暴露而获得易感性,可能有助于确定患者间是否存在个体差异。
综上所述,MSCs对肿瘤作用具有双向性,但产生这种矛盾结果还不能简单解释,MSCs对肿瘤作用受多种因素影响。MSCs促进肿瘤生长和转移的可能性使人们担忧其作为临床治疗工具的安全性,但到目前为止,有超过1 000名患者因各种适应症而使用MSCs治疗,却并没有1例MSCs相关肿瘤形成的报告。人为操控MSCs分泌具有抗肿瘤效应的细胞因子,或许意味着我们能通过控制细胞因子的表达来克服其可能存在的促瘤效应,选择合适的移植时机可以避免破坏MSCs的抑瘤作用,干扰MSCs的促瘤效应等治疗方案可为肿瘤的临床治疗提供新的思路。总之,只有对组织来源、捐赠者的个体差异、MSCs移植的时机或关键受体的表达等因素综合分析后才能更加准确地研究MSCs对肿瘤的作用,为MSCs的临床应用提供更好的理论支持。
5参考文献
1Kuhn NZ,Tuan RS.Regulation of stemness and stem cell niche of mesenchymal stem cells:implications in tumorigenesis and metastasis〔J〕.J Cell Physiol,2010;222(2):268-77.
2Hata N,Shinojima N,Gumin J,etal.PDGF-BB mediates the tropism of human mesenchymal stem cells for malignant gliomas〔J〕.Neurosurgery,2010;66(1):144-56.
3Studeny M,Marini FC,Champlin RE,etal.Bone marrow-derived mesenchymal stem cells as vehicles for interferon-beta delivery into tumors〔J〕.Cancer Res,2002;62(13):3603-8.
4Pittenger MF,Mackay AM,Beck SC,etal.Multilineage potential of adult human mesenchymal stem cells〔J〕.Science,1999;284(5411):143-7.
5Dominici M,Le Blanc K,Mueller I,etal.Minimal criteria for defining multipotent mesenchymal stromal cells〔J〕.Internat Socie Cell Thera Positi Stat Cytother,2006;8(4):315-7.
6Shih YR,Kuo TK,Yang AH,etal.Isolation and characterization of stem cells from the human parathyroid gland〔J〕.Cell Prolif,2009;42(4):461-70.
7Kim SM,Lim JY,Park SI,etal.Gene therapy using TRAIL-secreting human umbilical cord blood-derived mesenchymal stem cells against intracranial glioma〔J〕.Cancer Res,2008;68(23):9614-23.
8Gucciardo L,Lories R,Ochsenbein-Kölble N,etal.Fetal mesenchymal stem cells:isolation,properties and potential use in perinatology and regenerative medicine〔J〕.BJOG,2009;116(2):166-72.
9Spaeth E,Klopp A,Dembinski J,etal.Inflammation and tumor microenvironments:defining the migratory itinerary of mesenchymal stem cells〔J〕.Gene Ther,2008;15(10):730-8.
10Brooke G,Cook M,Blair C,etal.Therapeutic applications of mesenchymal stromal cells〔J〕.Semin Cell Dev Biol,2007;18(6):846-58.
11Short B,Brouard N,Occhiodoro-Scott T,etal.Mesenchymal stem cells〔J〕.Arch Med Res,2003;34(6):565-71.
12Beckermann BM,Kallifatidis G,Groth A,etal.VEGF expression by mesenchymal stem cells contributes to angiogenesis in pancreatic carcinoma〔J〕.Br J Cancer,2008;99(4):622-31.
13Wolff D,Steiner B,Hildebrandt G,etal.Pharmaceutical and cellular strategies in prophylaxis and treatment of graft-versus-host disease〔J〕.Curr Pharm Des,2009;15(17):1974-97.
14Karnoub AE,Dash AB,Vo AP,etal.Mesenchymal stem cells within tumour stroma promote breast cancer metastasis〔J〕.Nature,2007;449(7162):557-63.
15Xu W,Bian Z,Fan Q,etal.Human mesenchymal stem cells(hMSCs)target osteosarcoma and promote its growth and pulmonary metastasis〔J〕.Cancer Letters,2009;281(1):32-41.
16Bian ZY,Fan QM,Li G,etal.Human mesenchymal stem cells promote growth of osteosarcoma:Involvement of interleukin-6 in the interaction between human mesenchymal stem cells and Saos-2〔J〕.Cancer Sci,2010;101(12):2554-60.
17Hernanda PY,Pedroza-Gonzalez A,van der Laan LJ,etal.Tumor promotion through the mesenchymal stem cell compartment in human hepatocellular carcinoma〔J〕.Carcinogenesis,2013;34(10): 2330-40.
18Chaturvedi P,Gilkes DM,Wong CC,etal.Hypoxia-inducible factor-dependent breast cancer-mesenchymal stem cell bidirectional signaling promotes metastasis〔J〕.J Clini Invest,2013;123(1):189-205.
19Sung SY,Liao CH,Wu HP,etal.Loss of Let-7 microRNA upregulates IL-6 in bone marrow-derived mesenchymal stem cells triggering a reactive stromal response to prostate cancer〔J〕.PLoS One,2013;8(8):e71637.
20Yang T,Zhang X,Wang M,etal.Activation of mesenchymal stem cells by macrophages prompts human gastric cancer growth through NF-kB pathway〔J〕.PLoS One,2014;9(5):e97569.
21Muehlberg FL,Song YH,Krohn A,etal.Tissue-resident stem cells promote breast cancer growth and metastasis〔J〕.Carcinogenesis,2009;30(4):589-97.
22Secchiero P,Zorzet S,Tripodo C,etal.Human bone marrow mesenchymal stem cells display anti-cancer activity in SCID mice bearing disseminated non-Hodgkin's lymphoma xenografts〔J〕.PLoS one,2010;5(6):e11140.
23Dasari VR,Velpula KK,Kaur K,etal.Cord blood stem cell-mediated induction of apoptosis in glioma downregulates X-linked inhibitor of apoptosis protein(XIAP)〔J〕.PLoS One,2010;5(7):e11813.
24Dasari VR,Kaur K,Velpula KK,etal.Upregulation of PTEN in glioma cells by cord blood mesenchymal stem cells inhibits migration via downregulation of the PI3K/Akt pathway〔J〕.PLoS One,2010;5(4):e10350.
25Qiao L,Xu Z,Zhao T,etal.Suppression of tumorigenesis by human mesenchymal stem cells in a hepatoma mode〔J〕.Cell Res,2008;18(4):500-7.
26Qiao L,Xu ZL,Zhao TJ,etal.Dkk-1 secreted by mesenchymal stem cells inhibits growth of breast cancer cells via depression of Wnt signalling〔J〕.Cancer Lett,2008;269(1):67-77.
27Atsuta I,Liu S,Miura Y,etal.Mesenchymal stem cells inhibit multiple myeloma cells via the Fas/Fas ligand pathway〔J〕.Stem Cell Res Ther,2013;4(5):111.
28Sage EK,Kolluri KK,McNulty K,etal.Systemic but not topical TRAIL-expressing mesenchymal stem cells reduce tumour growth in malignant mesothelioma〔J〕.Thorax,2014;69(7):638-47.
29Bianchi G,Morandi F,Cilli M,etal.Close interactions between mesenchymal stem cells and neuroblastoma cell lines lead to tumor growth inhibition〔J〕.PLoS One,2012;7(10):e48654.
30Jin P,Civini S,Zhao Y,etal.Direct T cell-tumour interaction triggers TH1 phenotype activation through the modification of the mesenchymal stromal cells transcriptional programme〔J〕.Br J Cancer,2014;110(12):2955-64.
31Kucerova L,Skolekova S,Matuskova M,etal.Altered features and increased chemosensitivity of human breast cancer cells mediated by adipose tissue-derived mesenchymal stromal cells〔J〕.BMC Cancer,2013;13(1):535.
32Belmar-Lopez C,Mendoza G,Oberg D,etal.Tissue-derived mesenchymal stromal cells used as vehicles for anti-tumor therapy exert different in vivo effects on migration capacity and tumor growth〔J〕.BMC Med,2013;11(1):139.
33Molloy AP,Martin FT,Dwyer RM,etal.Mesenchymal stem cell secretion of chemokines during differentiation into osteoblasts,and their potential role in mediating interactions with breast cancer cells〔J〕.Int J Cancer,2009;124(2):326-32.
34Waterman RS,Henkle SL,Betancourt AM.Mesenchymal stem cell 1(MSC1)-based therapy attenuates tumor growth whereas MSC2-treatment promotes tumor growth and metastasis〔J〕.PLoS One,2012;7(9):e45590.
〔2015-07-29修回〕
(编辑袁左鸣)
〔中图分类号〕R730
〔文献标识码〕A
〔文章编号〕1005-9202(2016)05-1243-04;
doi:10.3969/j.issn.1005-9202.2016.05.102
通讯作者:殷明(1958-),男,教授,博士生导师,主要从事脊柱及骨肿瘤外科研究。
基金项目:国家自然科学基金资助项目(No.81160226)
1南昌大学第二附属医院骨科
2九江学院基础医学院
第一作者:胡文龙(1988-),男,硕士在读,主要从事骨肿瘤外科研究。
