红菜薹小孢子培养技术研究
2016-04-11吴艺飞丁茁荑戴雄泽周晓波汪端华
吴艺飞,丁茁荑,戴雄泽,周晓波,汪端华
(湖南省蔬菜研究所/湖南省蔬菜工程技术研究中心,长沙410125)
红菜薹小孢子培养技术研究
吴艺飞,丁茁荑*,戴雄泽,周晓波,汪端华
(湖南省蔬菜研究所/湖南省蔬菜工程技术研究中心,长沙410125)
摘 要:以5个红菜薹品种为试材,从花蕾的选择、影响小孢子出胚的关键因素、胚状体成苗及生根条件等方面对红菜薹小孢子培养技术进行了系统研究。结果表明:小孢子培养取样最佳时期为单核靠边期,瓣萼比在0. 626~0. 834之间;基因型不同对小孢子培养影响很大,以H13 -3出胚率最高,为2. 78个/皿;胚状体诱导的最适培养基为Keller-13添加6-BA 1. 0 mg/ L + KT1. 0 mg/ L + NAA0. 5 mg/ L,出胚率为2. 67个/皿,且70%以上为子叶形胚;转接胚状体最适宜的胚龄为15~25 d,成苗率在65%~83%;再生植株生根培养基添加NAA最适浓度为0. 4 mg/ L,侧根多而粗壮,移栽成活率高。
关键词:红菜薹;小孢子培养;胚状体;出胚率
人们早已认识到植物单倍体育种在遗传育种上的重大意义。利用小孢子培养选育出新品种并推广的作物有油菜、大白菜等。游离小孢子培养是将花药中分离出来的游离小孢子进行胚诱导培养,其诱导频率比花药培养要高。由它直接发育得来的再生植株是纯合体,能大大缩短亲本纯合的时间,加快育种进程,还可以得到部分由隐性基因所控制的遗传性状,为选育新品种开辟新途径[1,2]。因此对游离小孢子培养技术进行全面研究意义非常重大。
与芸薹属许多其他作物如甘蓝型油菜、大白菜等相比较而言,红菜薹(Brassiea campestris L. ssp Chinensis L var. Utilis Tsenet Lee.)小孢子培养研究起步比较晚,技术不很成熟。近几年随着各地对红菜薹育种的深入研究,小孢子培养技术取得了很大的进展,在育种上的应用前景越来越大[3]。为使小孢子培养方法能成功运用于红菜薹育种实践中,本研究对影响红菜薹小孢子培养的关键因素进行了分析,并对胚状体成苗及生根条件进行筛选,以为大规模开展红菜薹小孢子培养提供参考。
1 材料与方法
1. 1 材料
试验材料为前期试验中出胚率较高的H13 -1、H13 -2、H13 -3、H13 -4和H13 -5,所有种子均由湖南省蔬菜研究所菜薹课题组提供。本试验在湖南省蔬菜研究所完成。于2014年11月上旬播种于大棚苗床中,12月底定植于大棚内,加强肥水管理,2015年2月进入始花期。
1. 2 方法
(1)花蕾的选择及临时装片的制作。从初花期开始,晴天上午9:00前采集花蕾带回实验室备用。用游标卡尺测量花蕾的纵径长、横径长、花萼长、花瓣长并记录其形态特征。将花药放在载玻片上,加一滴醋酸洋红染色剂,用小刀轻压花药挤出花粉,盖上盖玻片,在显微镜下观察小孢子发育时期。每组观察5个花蕾。
(2)不同激素种类和浓度对小孢子胚状体诱导的影响。以H13 - 3为试材,小孢子培养基本培养基为keller-13(Keller + 13%蔗糖,下同)液体培养基,添加不同浓度的6-BA(0、1. 0、2. 0 mg/ L)、KT (0、1. 0、2. 0 mg/ L)和NAA 0. 5 mg/ L。采用两因素多水平试验设计,每处理接种10皿,3次重复。接种后20 d统计出胚情况。
(3)不同基因型对小孢子胚状体诱导的差异。以H13 -1、H13 -2、H13 -3、H13 -4和H13 -5等5个不同基因型为试材,以不加琼脂的Keller-13为基础培养基,添加1. 0 mg/ L 6-BA +0. 5 mg/ L 2,4-D + 0. 2 mg/ L NAA +0. 2 g/ L活性炭。每个品种接种10皿,设3次重复,接种20 d后统计出胚情况。
(4)不同胚龄胚状体对成苗的影响。将不同胚龄的胚状体(10、15、20、25、30 d)转接至MS + 0. 5 mg/ L 6-BA +0. 1 mg/ L NAA +0. 2 g/ L活性炭+ 30 g/ L蔗糖+10 g/ L琼脂的培养基中。每处理接种10个胚状体,重复3次,接种25~30 d后统计成苗情况。
(5)不同NAA浓度对幼苗生根的影响。以MS为基础培养基,将成苗后的幼苗转至添加不同浓度NAA(0、0. 2、0. 4、0. 6 mg/ L)的培养基中。每处理接种10株,3次重复,20~25 d后统计生根情况。
2 结果与分析
2. 1 红菜薹小孢子各发育阶段的细胞学特征比较
通过对红菜薹花粉粒发育时期的显微观察中,发现同一个花药中包含着几个不同发育时期的小孢子,各发育时期的小孢子所占的比例会随着花蕾的发育发生相应的变化。通过显微观察将占总比例最多的发育时期作为其对应的花药所处的发育时期,可将其分为4个时期:小孢子母细胞时期、二分体和四分体时期、小孢子时期(单核早中期、单核靠边期和双核期)和成熟花粉粒时期[4](图1)。

图1 小孢子发育时期细胞显微观察
2. 2 小孢子各发育时期与花蕾大小、瓣萼比的相关性
从表1可知,红菜薹小孢子发育时期与花蕾的外部形态特征密切相关。同一红菜薹品种小孢子发育不同时期的花蕾纵径、横径、花萼长度、花瓣长度以及瓣萼比都存在显著差异。随着小孢子的发育,花蕾纵径、横径、花萼长度、花瓣长度及瓣萼比均出现增长趋势,且增长的幅度越来越大;不同品种处于同一小孢子发育时期花蕾大小、花瓣、花萼长度以及瓣萼比也存在显著差异。不同品种的红菜薹处于单核靠边期时,花蕾的大小、花瓣和花萼的长度以及瓣萼比均存在差异。花蕾的纵径在2. 890~3. 394 mm之间,横径在1. 910~2. 180 mm之间,花萼长度在2. 764~3. 316 mm之间,花瓣长度在1. 926~2. 357 mm之间,瓣萼比在0. 657~0. 834之间。
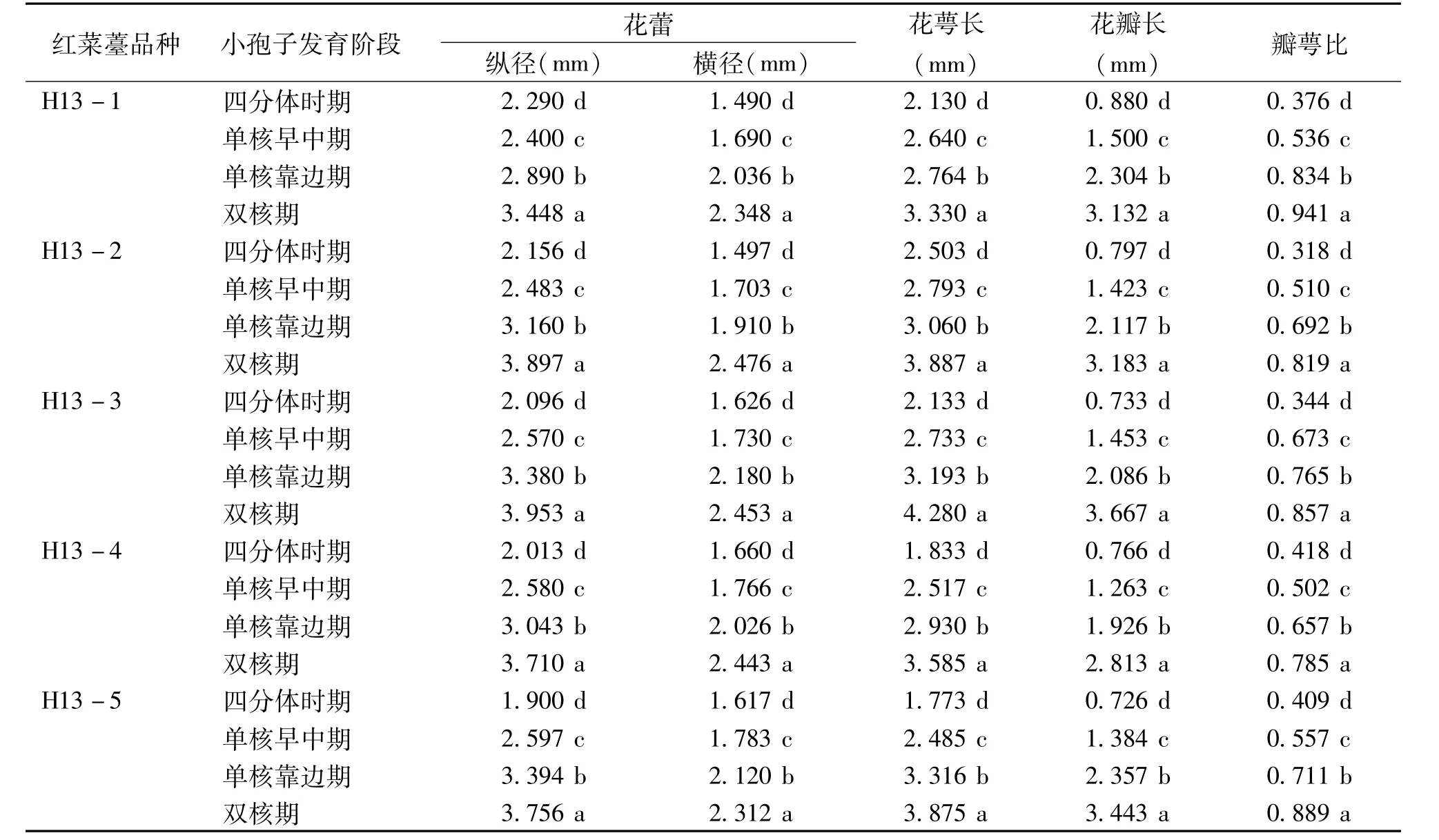
表1 不同红菜薹品种小孢子各发育时期花蕾的形态特征
2. 3 不同激素种类和浓度配比对小孢子胚状体诱导的影响
从表2可以看出,添加不同激素种类和浓度的高低对红菜薹小孢子胚诱导影响很大,各处理差异显著。在一定程度下,添加6-BA、KT和NAA均能提高小孢子胚状体诱导频率,3种激素的诱导效果为:6-BA > KT > NAA,同时添加3种激素比单独添加1种激素的诱导效果更佳。3种激素的最佳配比为:6-BA 1. 0 + KT 1. 0 + NAA 0. 5,此时小孢子胚状体出胚率最高,为2. 67个/皿,且70%以上为子叶形胚,占比最高,更易成苗。

表2 不同激素种类和浓度配比的小孢子胚状体诱导结果

(续表2)
2. 4 不同基因型对小孢子胚状体诱导的差异
由表3可知,基因型不同对红菜薹小孢子出胚影响极大,不同基因型间差异显著。在供试的5个品种中,以H13 -3出胚率最高,为2. 78个/皿,H13 -2次之,为2. 21个/皿,H13 - 4胚状体诱导频率最低,只有0. 41个/皿。
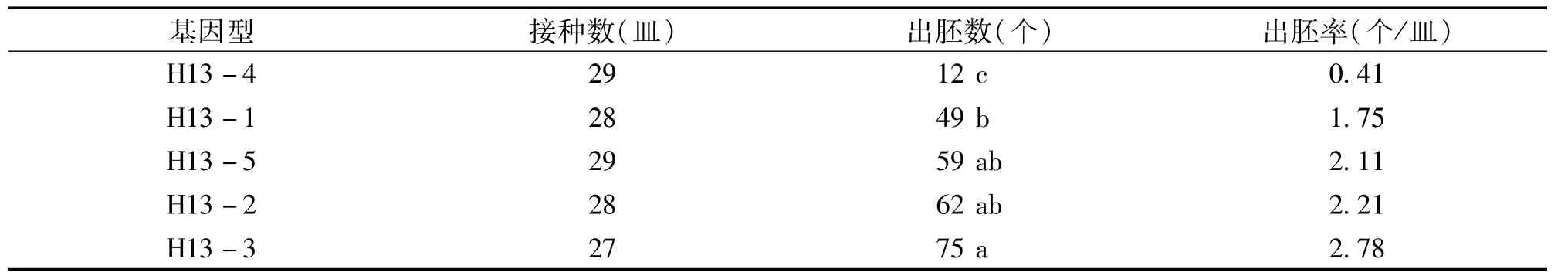
表3 不同基因型的小孢子胚状体诱导结果比较
2. 5 不同胚龄胚状体对成苗的影响
从表4可以看到,胚龄的长短直接影响胚状体的成苗。红菜薹小孢子培养胚状体最适宜的胚龄为15~25 d,成苗率在65%~83%,胚状体转接后很快转绿分化出苗。超过25 d或低于15 d,成苗率均呈下降趋势。胚龄过短,接种后胚状体生长缓慢,易黄化而死,成苗率低;胚龄过长,胚状体老化,分化效率下降,易褐化而死。

表4 不同胚龄胚状体的成苗结果
2. 6 NAA浓度对幼苗生根的影响
由表5可知,NAA浓度的高低与再生植株生根密切相关,各处理间生根效果差异显著。不添加NAA也能部分生根,但根系很细弱,侧根少;添加NAA后,根量大大增加,侧根多而粗壮,移栽易于成活。但添加NAA也不宜过量,如添加过多根量太多而壮,反而影响植株的生长,且根系变脆易断,不利于移栽成活。添加NAA最适浓度为0. 4 mg/ L,有3 ~4条较粗壮的侧根,移栽成活率可达90%以上。

表5 不同NAA添加浓度处理的幼苗生根效果比较
3 讨论与结论
3. 1 关于影响小孢子培养出胚率的因素
红菜薹小孢子发育时期与花蕾外观形态密切相关,同一品种小孢子不同发育时期的花蕾外观之间存在差异;不同品种的菜薹小孢子处于同一时期时花蕾外观形态特征也存在差异。通过试验找到一些关于取材的统一标准:花蕾表面无损伤,花萼包裹着花冠,花蕾未开裂,当花瓣为花药的1/2~4/5(比值最大不能超过1)时小孢子正处于单核靠边期,为接种的最佳时期。由于小孢子单核靠边期是有丝分裂的触点,当条件出现异常时,有丝分裂很容易被中止,发育进程被改变,小孢子将从配子体发育阶段转向孢子体发育阶段,分裂形成愈伤组织或胚状体,最终发育为单倍体植株。取单核靠边期的花蕾接种,此时小孢子刚好处于第1次有丝分裂阶段且细胞中营养物质储备最充足,有利于促进小孢子的启动和分化,提高小孢子胚和愈伤组织的产生。
基因型的差异是影响小孢子培养出胚率的关键因素,不同基因型出胚率差异很大,这一现象在很多植物小孢子培养过程中普遍存在,关于这一现象的作用机理还在研究当中。本试验供试的5个基因型红菜薹出胚率差异非常显著。笔者多年试验中发现,将出胚率低的品种与出胚率高的品种杂交后,F1出胚率会大大提高,这说明影响出胚的基因是由多对基因控制的,且这种基因是可遗传的。
适当添加部分激素对小孢子胚诱导可起到促进作用。本研究添加了6-BA、KT、NAA3种激素,均在一定程度上提高了胚状体诱导率,6-BA对胚状体诱导效果最佳,KT次之。最佳的胚诱导培养基为6-BA 1. 0 mg/ L + KT 1. 0 mg/ L + NAA 0. 5 mg/ L。这一结果与本研究前期试验结果一致[5],但与张秀武等[6]的研究结果不一致,其原因有待进一步研究。
3. 2 关于胚状体植株再生
胚状体直接成苗率一直较低,胚龄的长短对胚状体成苗影响很大,胚龄过长和过短均不利于成苗。胚龄过短,胚状体容易出现玻璃化或黄化,生长不良而死;胚龄过长,胚状体分化能力减弱,易褐化导致成苗率下降。本研究结果表明,将胚龄为15~25 d,转接至MS +0. 5 mg/ L 6-BA +0. 1 mg/ L NAA +0. 2 g/ L活性炭+ 30 g/ L蔗糖+ 10 g/ L琼脂的培养基中,胚状体成苗率可达65%~83%。
通过添加适量的NAA可以促进胚状体再生植株生根,提高移栽成活率。本研究通过添加0. 4 mg/ L NAA后,可使生根率达100%,发出的侧根多而粗壮,从而大大提高再生植株移栽成活率。
参考文献:
[1] 颜昌敬.植物组织培养手册[M].上海:上海科学技术出版社,1990.
[2] 曹鸣庆,刘 凡,李 岩.芸薹属蔬菜游离小孢子培养研究进展[J].园艺学年评,1996(2):63 -89.
[3] 王涛涛,李汉霞.红菜薹游离小孢子培养与植株再生[J].武汉植物学研究,2004,22(6):569 -571.
[4] 张菊平,巩振辉,刘珂珂,等.辣椒小孢子发育时期与花器形态的相关性[J].西北农林科技大学学报(自然科学版),2007(3):153 -158.
[5] 吴艺飞,丁茁荑,肖 杰,等.菜薹小孢子培养诱导胚状体的影响因素研究[J].湖南农业科学,2013(19):16 -19.
[6] 张秀武,李正丽,何 丹,等.红菜薹游离小孢子培养技术研究[J].长江蔬菜,2008(12b):11 -15.
Study on Microspore Culture Techniques in Purple Flowering Stalk(Brassica campestris)
WU Yifei,DING Zuoyi*,DAI Xiongze,ZHOU Xiaobo,WANG Duanhua
(Hunan Vegetable Research Institute/ Hunan Vegetable Research and Development Center,Changsha,Hunan 410125,China)
Abstract:With five purple flowering stalk varieties as test materials,the microspore culture techniques in purple flowering stalk were systematically studied from some aspects,such as choice of buds,key factors affecting on microspore embryogenesis,seedling formation of embryoid and rooting conditions,and so on. The results showed that the optimum sampling period of microspore culture was the late uninucleate stage and 0. 626~0. 834 sepal than. Genotype had great influence on microspore culture,and embryogenesis rate of H13 -3 was highest,2. 78/ dish. The optimum culture medium embryoid for induction was Keller-13 with 6-BA 1. 0 mg/ L + KT 1. 0 mg/ L + NAA 0. 5 mg/ L,and the embryogenesis ratewas 2. 67/ dish,and more than 70% was cotyledon embryo. The optimum embryonic age to transfer embryoid was 15~25 d,and the seedling rate could reach to 65%~83%. The regeneration optimal concentration of NAA added into rooting medium was 0. 4 mg/ L,which could gain more thick lateral root and higher transplanting survival rate.
Keywords:purple flowering stalk;microspore culture;embryoid;embryogenesis rate
基金项目:现代农业产业技术体系专项(CARS -25)。
作者简介:吴艺飞(1982 -),女,从事十字花科蔬菜遗传育种工作,Email:406522996@ qq. com。*通信作者:丁茁荑,研究员,从事十字花科蔬菜遗传育种工作,Email:dingzhuoyi@163. com。
收稿日期:2015 10 16
文章编号:1001-5280(2016)01-0073-05
DOI:10. 16848/ j. cnki. issn. 1001-5280. 2016. 01. 019
中图分类号:S634. 6
文献标识码:A
