石首麋鹿致病性大肠埃希菌的分离鉴定与药敏试验
2016-04-07郭定宗万春云杨世锦
郭定宗,邹 苗,万春云,张 韦,郭 锐,杨世锦
(1.华中农业大学,湖北武汉 430070;2.湖北省农业科学院,湖北武汉 430064)
石首麋鹿致病性大肠埃希菌的分离鉴定与药敏试验
郭定宗1,邹苗1,万春云1,张韦1,郭锐2,杨世锦1
(1.华中农业大学,湖北武汉 430070;2.湖北省农业科学院,湖北武汉 430064)
摘要:湖北石首麋鹿国家级自然保护区是我国三大麋鹿保护基地之一,自然放养状态的麋鹿易受到大肠埃希菌侵袭并导致死亡。为了弄清石首麋鹿保护区内麋鹿大肠埃希菌感染和流行现状,以及致病性和主要毒力因子,通过药敏试验、生化鉴定、16 S rDNA PCR、小鼠毒力试验等方法从病料中分离到15株致病性大肠埃希菌。药敏试验结果显示,分离到的15株大肠埃希菌对庆大霉素、卡那霉素、头孢唑啉的敏感度均达到了100%;其次是对氯霉素、新霉素以及链霉素敏感度均超过60%;耐药性方面,对克林霉素和磺胺嘧啶的耐药度分别为80%和60%。毒力因子PCR结果显示,主要毒力因子为ompA(100.00%)、traTa(80.00%)、iss(80.00%)、iucD(60.00%)、irp2(53.33%)、sta(33.33%)、cva/cvi(26.67%)、vat(20.00%)。
关键词:致病性大肠埃希菌; 麋鹿;分离鉴定;药敏试验;毒力因子
麋鹿是原产于我国的国家一级重点保护动物,现有3个自然保护区,湖北石首麋鹿保护区是最大的麋鹿自然保护区之一。保护区自1991年建立以来,区内环境改变明显,由于保护区内天鹅洲故道围堤的修建以及三峡大坝蓄水,使保护区段水位较低、沟渠缺水并且无法流动,导致静水水体污染加剧、富营养化,麋鹿喜水,增加了麋鹿遭受病原菌感染的风险[1-3]。
大肠埃希菌是最常见的可由污染水体传播的病原菌,水传播是其重要的传播方式[4]。袁硕峰[5]曾对石首麋鹿保护区送检的死亡雄性麋鹿进行了致病菌分离,经过16 S rDNA基因序列分析,认定分离到的3株大肠埃希菌均为麋鹿源致病性大肠埃希菌。此外,近年来多处发现鹿源性大肠埃希菌,大肠埃希菌已成为引起麋鹿发病和死亡的主要病原[6-7]。
为弄清石首麋鹿保护区内麋鹿大肠埃希菌感染和流行现状,以及致病性和主要毒力因子,本试验从麋鹿病料中分离大肠埃希菌,通过染色镜检、生化鉴定、16 S rDNA PCR、毒力因子PCR鉴定以及小鼠致病性试验等对其进行鉴定,其结果如下。
1材料与方法
1.1材料
1.1.1病料、试剂和实验动物病料采自湖北石首麋鹿自然保护区;SS琼脂等培养试剂,购自杭州微生物试剂有限公司;氧化酶试纸、O-F发酵管、肠杆菌科细菌生化编码鉴定管(第二代15e系统)、弧菌科生化编码鉴定管(GY-9V系统)及非发酵生化编码鉴定管,均购自杭州天和微生物试剂有限公司;药敏纸片的种类包括氨苄西林、头孢唑啉(先锋V)、庆大霉素、卡那霉素、链霉素、新霉素、红霉素、环丙沙星、诺氟沙星(氟哌酸)、恩诺沙星、PHENICOLS(氯霉素)、克林霉素(氯洁霉素)、氟苯尼考,均购自杭州微生物试剂有限公司;PCR中TaqDNA Reaction buffer、TaqDNA 聚合酶、dNTPS、DNA Marker (DL 2 000),购自武汉天根生物有限公司。昆明小鼠50只,雌雄各半,3周龄,体重20 g~22 g,购自湖北省疾病控制中心实验动物中心。
1.1.2引物所有引物均由擎科(武汉)生物技术有限公司合成。毒力基因扩增引物的序列、基因的片段大小及退火温度见表1。
16 S rDNA扩增通用引物:上游引物:5′-AGAGTTTGATCCTGGCTCAG-3′ ,下游引物:5′-TACGGTTACCTTGTTACGACTT-3′。毒力因子的测定引物见表1。
1.2方法
1.2.1细菌分离与纯化无菌采集死亡麋鹿病料及新鲜粪便,并划线接种于胰蛋白胨大豆蛋白胨(TSA)培养基与伊红-美蓝(EMB)培养基,置于37 ℃恒温箱内,18 h后挑取典型菌落接种到MH肉汤培养基中,于37 ℃摇床以220 r/min的转速振荡培养8 h,重复上述步骤,确保分离到纯化菌株,等体积与300 g/L甘油混合均匀,置-70 ℃保存备用。
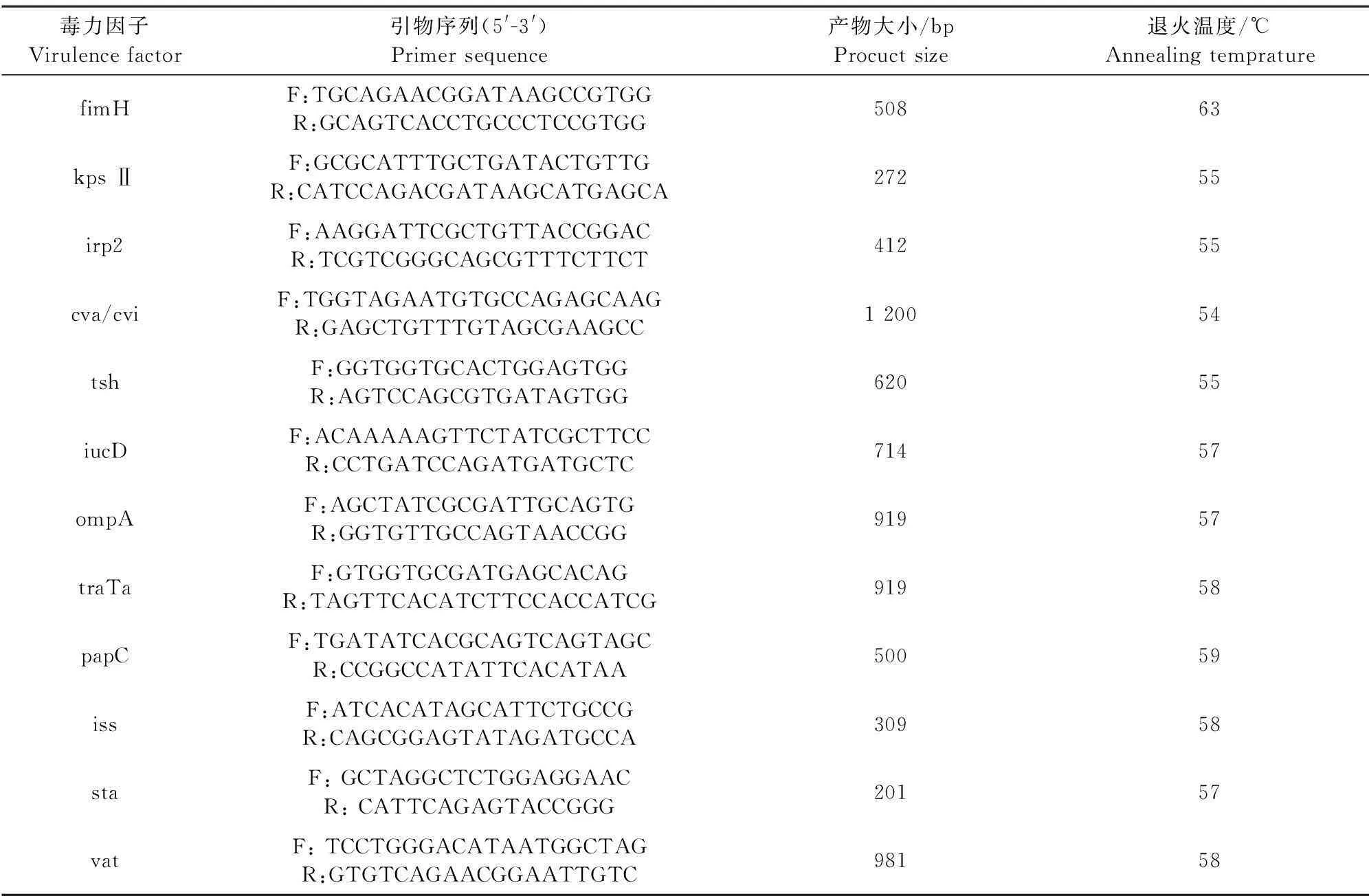
表1 致病性大肠埃希菌毒力因子扩增引物
挑取纯化培养的单菌落,革兰和瑞特染色,于高倍油镜下观察单个细菌形态及着色情况,对细菌进行初步分类,确定生化鉴定管的选择使用。
1.2.2分离菌株的生理生化试验按照细菌纯培养物的革兰染色、氧化酶试验、O-F试验是否为阳性,选择相应生化鉴定系统接种细菌,于37 ℃培养48 h,观察判定生化反应结果,并检索对应的生化鉴定编码手册及参照《伯杰氏细菌鉴定手册第8版》标准,判定细菌种类。
1.2.3分离菌株的16 S rDNA PCR鉴定对生化鉴定编码检索中,出现重码,即同一个编码出现2个~3个鉴定结果的情况,本次调查采取16 S rDNA方法鉴定细菌种属。 反应在50 μL 体系中进行:10×PCR缓冲液5.0 μL;dNTP 1.0 μL;上下游引物各1.0 μL;模板DNA 2.0 μL;TaqDNA 聚合酶1.0 μL;ddH2O 39 μL。反应条件为:95 ℃ 3 min ;94℃ 45 s,50 ℃ 45 s,72 ℃ 1.5 min,30个循环; 72℃ 10 min。按Omega胶回收试剂盒的说明书进行胶回收。按TaKaRa公司pMD18-T载体说明书,将纯化的PCR产物连接到载体上。按常规方法转化E.coliDpα感受态细胞,经筛选培养后送菌液至武汉擎科生物技术有限公司进行序列测定。根据测序结果在GenBank上利用Blast进行序列的同源性分析。
1.2.4分离菌株对小鼠致病性试验供试验的小鼠,试验前禁食、禁水24 h。试验小鼠用注射器腹腔注射活菌菌液0.2 mL/只(约含细菌2×109CFU),每组2只小鼠,对照组注射无菌生理盐水,剂量和方法同试验组。攻毒后,将不同组别的小鼠分笼饲养,并每天观察小鼠的临床表现,包括小鼠的精神状态、食欲等临床表现,连续观察72 h,并对各组小鼠的发病和死亡情况进行了统计。
1.2.5分离菌株的药敏试验将待检菌液接种于普通营养肉汤中,37 ℃培养6 h,用无菌棉拭子沾取菌液,在普通琼脂平板上沿一个方向均匀涂抹,然后将平皿转动60°,共涂布3次。加盖后放置5 min,用无菌镊子将药敏片平放在平板上,并轻压使其紧贴在平板表面。药敏试纸见每个平板贴纸片5张,贴好纸片的平板于37 ℃培养18 h~24 h,观察结果。
1.2.6分离细菌PCR模板的制备将15株大肠埃希菌分离株分别在LB液体培养基中37 ℃培养24 h,取1.5 mL菌液于无菌的EP管,12 000 r/min离心2 min,沉淀加300 μL去离子水,涡旋混匀。然后煮沸变性10 min,立即放入冰浴中,12 000 r/min离心数秒后取上清作为DNA模板。
1.2.7毒力基因的PCR检测25 μL PCR体系包含:10×TaqDNA Reaction buffer 2.5 μL、2.5 U/μL的高保真TaqDNA聚合酶0.8 μL,10 mmol/L dNTPS 0.5 μL,10种毒力基因上、下游引物(10 μmol/L)分别各1 μL,模板DNA4 μL,ddH2O加至总体系25 μL。分别以优化后的条件对致病菌株进行PCR扩增。扩增反应程序:94℃ 3 min;94 ℃ 30 s,72 ℃ 3 min,25次循环;72 ℃ 10 min。PCR产物在10 g/L琼脂糖凝胶用80 V电压电泳40 min,紫外灯下观察电泳结果。
2结果
2.1死亡麋鹿剖检观察
死亡麋鹿多伴有天然孔出血症状,通过对死亡
麋鹿脏器等病料的观察,发现血管断端流出红褐色凝固不良的血液,且多伴有皮下出血;肺部常有出血灶,且有明显的炎性渗出物,胸腔内积血;肠道大量出血,腹腔有大量血性腹水(图1)。
2.2细菌形态观察
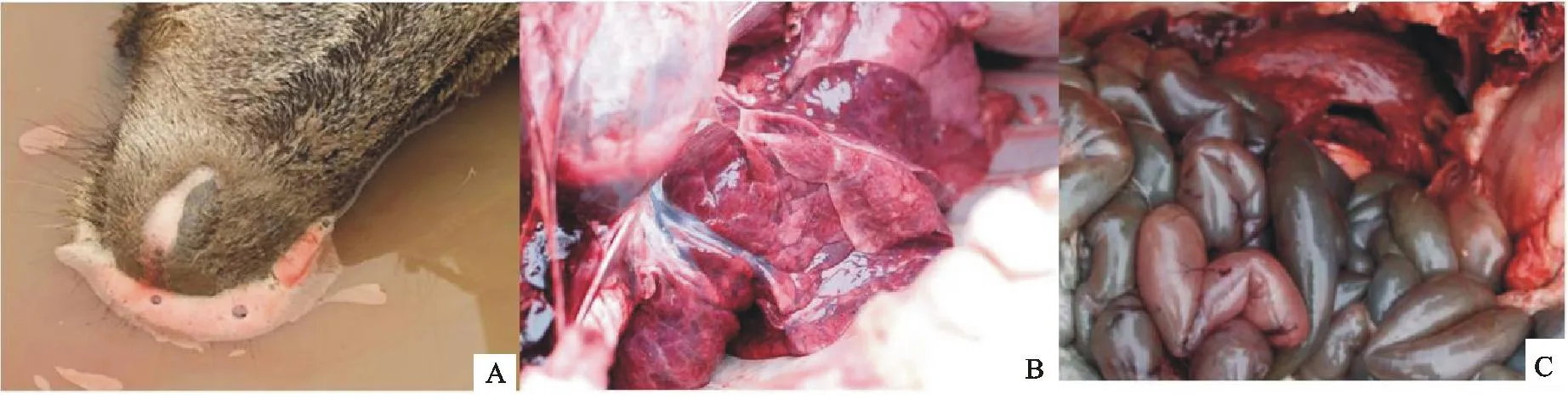
分别挑取不同琼脂平板上单个菌落进行革兰染色,镜检可见有粗短、两端钝圆的小杆菌,长1 μm ~3 μm,宽约0.4 μm ~0.7 μm,多单个散在,个别成双排列,无芽胞,革兰阴性。分离出的大肠埃希菌在伊红-美兰琼脂上呈现紫黑色金属光泽的圆形菌落,在麦康凯琼脂上生长出边缘整齐、稍隆起、表面光滑湿润、直径1 mm~3 mm、粉红色的圆形菌落,在TSA琼脂上形成圆形凸起,光滑、湿润、半透明,近似灰白色的菌落,以上观察结果(图2)符合大肠埃希菌的形态特征。 A.死后鼻腔出现大量血色泡沫;B、C.分别为死后肺胀和肠道病变
A.Large number of bloody foams occurred in the nose after death;B,C.Pathological lesions in lung and intestine respectively
图1死亡麋鹿的基本特征
Fig.1The main characteristics of dead deer
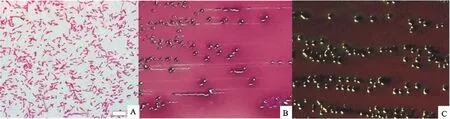
A、B、C分别是镜下形态、麦康凯和伊红-美兰琼脂上生长形态
A means the morphology under the microscope,B and C mean the mrophologies on the medium of MacConkey agar and eosin-methylene blue medium
图2大肠埃希菌的典型特征
Fig.2The typical characteristics ofE.coli
2.3细菌生化鉴定结果
参照《肠杆菌科生化鉴定编码手册》及《伯杰氏细菌鉴定手册第8版》对从死亡麋鹿病料及粪便中分离到的细菌通过微量生化鉴定管进行细菌的生理生化特性鉴定。结果表明,分离到15株(E01-E15)符合大肠埃希菌的典型生化特征(表2)。
2.4细菌16 S rDNA鉴定结果
对病料分离得到的两株(E09、E12)出现生化鉴定重码(一个编码对应两种以上细菌)进行16 S rDNA补充鉴定。通过测定其16 S rDNA序列,经与GenBank中数据做Blast比对,与E.coliSE11 DNA的同源性最为接近,达99%,结合生化反应结果,判定2株待检菌为大肠埃希菌。
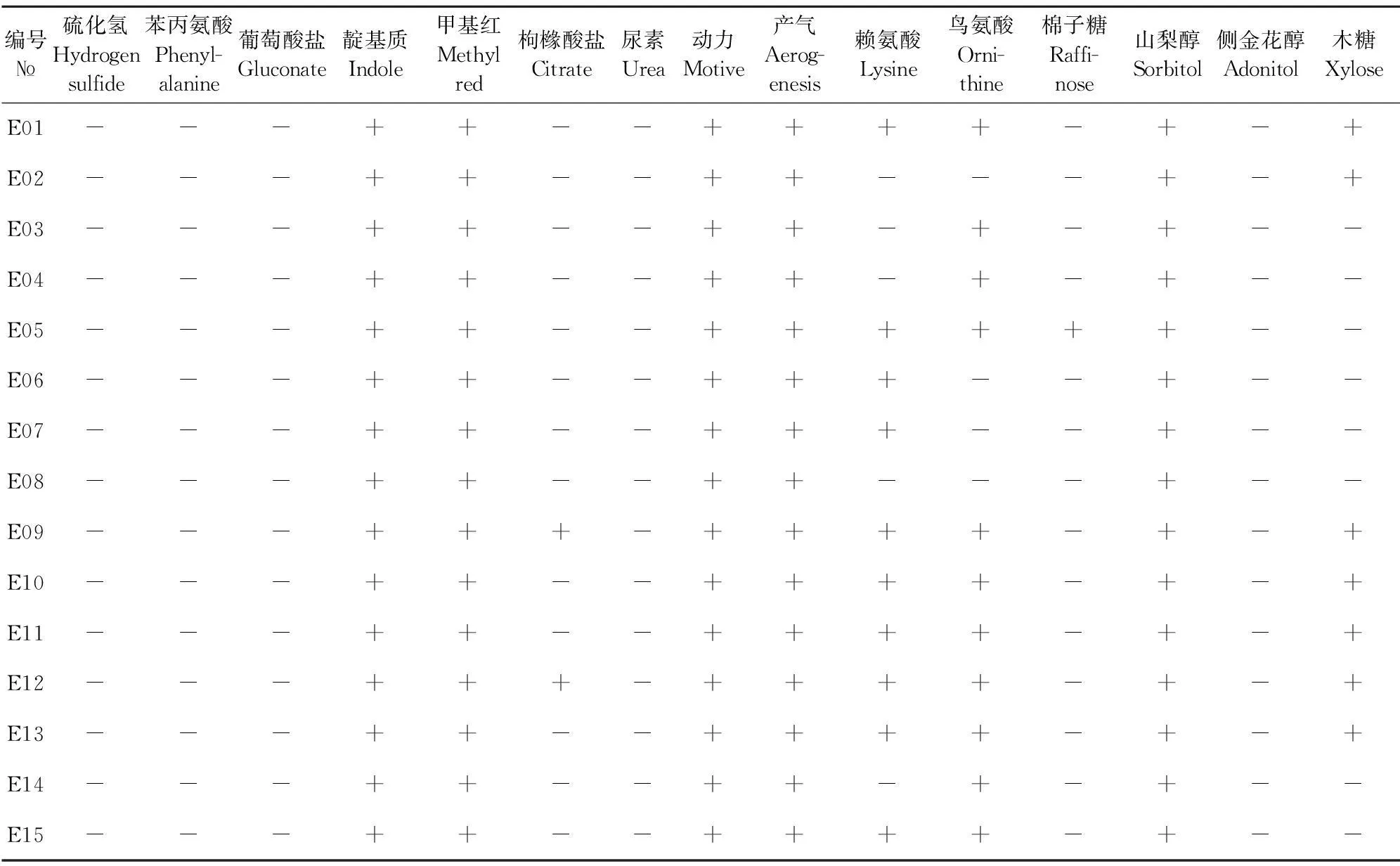
表2 大肠埃希菌生化鉴定结果
2.5小鼠致病力试验
小鼠在接种0.2 mL(约含细菌2×109CFU)的纯培养菌液后,先后表现出不同程度的精神萎靡,食欲降低,同时伴随有抽搐、颤抖等神经症状。注射生理盐水的对照组小鼠,精神状态与饮水进食均表现正常。感染组小鼠在感染后的8 h~72 h陆续出现发病和死亡。对死亡小鼠进行剖检后肉眼观察到的病理变化有:皮下出血,肝脏暗红色,脾脏肿大,暗黑色,易碎,部分小鼠胃内充满白色黏稠液体,小肠有明显的肠腔积液及粘连,整体颜色发暗,部分有脓状物。采集心血接种培养基进行细菌回归检测,鉴定结果一致,阳性率为100%。小鼠致病试验表明15株大肠埃希菌能引起小鼠出现明显的临床症状和实质器官的病理变化,从小鼠实质器官中能分离到大肠埃希菌,结合生化鉴定判定该15株大肠埃希菌为致病性大肠埃希菌。
2.6大肠埃希菌毒力基因检测结果
目标基因的PCR扩增结果显示,15株大肠埃希菌分别在919、460、309、201、981、412、1 200、714 bp的位置出现了目的条带(图3)。这些片段对应与ompA、traTa、iss、sta、vat、irp2、cva、iucD基因扩增片段大小一致。15株致病性大肠埃希菌中,ompA毒力基因检出率为(15/15,100.00%),traTa毒力基因检出率为(12/15,80.0%),iss毒力基因检出率为(12/15,80.00%),sta毒力基因检出率为(5/15,33.33%),vat毒力基因检出率为(3/15,20.00%),irp2毒力基因检出率为(8/15,53.33%),cva/cvi毒力基因检出率为(4/15,26.67%),iucD毒力基因检出率为(9/15,60.00%)。在本试验中,总共检测了12种毒力基因,但只检出了ompA、traTa、iss、sta、vat、irp2、cva/cvi、iucD等8种,tsh、fimH、Kps II、papC等4种毒力基因未检出,即这4种毒力基因的检出率均为0(0/15)。
2.7药敏试验结果
药敏试验结果(表3)显示,分离的15株大肠埃希菌对庆大霉素、卡那霉素、头孢唑啉的敏感度均达到了100%;其次是对氯霉素、新霉素以及链霉素,敏感度均超过60%;对环丙沙星和诺氟沙星、恩诺沙星、磺胺嘧啶、氟苯尼考、氨苄西林等药物表现出一定敏感性,但敏感度低于50%的药物有对环丙沙星和诺氟沙星、恩诺沙星、磺胺嘧啶、氟苯尼考、氨苄西林等药物。中敏度最高的为氟苯尼考及红霉素,分别为80.00%及53.33%。以耐药性来看,15株大肠埃希菌对克林霉素和磺胺嘧啶的耐药性最高,分别达到了80.00%和60.00%。

A~L.ompA,traTa,iss,sta,vat,irp2,cva,iucD,vat,irp2,cva/cvi,iucD
M.DNA标准;1~n.样品
M.DNA Marker;1-n.Samples
图3大肠埃希菌毒力基因PCR产物凝胶电泳结果
Fig.3The electrophoresis result of PCR products of virulence genes ofE.coli
3讨论
本调查在对死亡麋鹿病料进行细菌分离时,除了分离到的15株致病性大肠埃希菌外,还分离到了沙门菌4株、奇异变形杆菌3株、金黄色葡萄球菌3株、铜绿假单胞菌2株、臭鼻克雷伯菌1株。由于没有进行相应的小鼠毒性试验,无法判定其致病力,但至少说明了复合感染这种可能性的存在。此外,通过水体培养细菌计数,可对保护区内各水源点(2处池塘水域、2处故道水域、1处封闭水沟)的调查,发现故道水域的细菌总数明显少于池塘与沟渠。这在一定程度上反映了封闭的水域较开放水域更容易导致细菌的孳生。张树苗等[3]指出,自然水域中大肠埃希菌及嗜水气单胞菌等环境常在菌,在天气条件突变、水质变差等导致麋鹿免疫力下降时,会成为导致麋鹿迅速大量死亡的致病菌。因此,对于保护区内的水塘,应当做到杜绝其他任何家养动物的粪便排入,对于封闭水沟应当做到及时填埋或与故道贯通形成水渠,降低麋鹿通过饮水途径遭受条件致病菌威胁的可能性。
细菌分离培养阶段,在培养基的选择上,初期使用的麦康凯琼脂平板,发现其上生长的典型桃红色菌落与下一阶段的生化鉴定结果不一致,出现了假阳性情况,后改用伊红-美蓝培养基,这一情况得到极大改善。16 S rDNA是鉴定细菌种属最有效的方式[8-9],该检测法通过PCR扩增、测序、比对等几个步骤来鉴定细菌种属,便于大批量操作,在当前已经越来越受欢迎,试验采用16 S rDNA检测法对生化鉴定出现重码(一个编码对应两种以上细菌)的细菌进行了补充鉴定。
对于小鼠毒力试验,由于只是记录了小鼠的临床症状、病理变化及死亡时间,而没有测定每株大肠埃希菌的半数致死量,因此无法对不同株大肠埃希菌的毒力差异进行研究。不过鉴于大肠埃希菌的致病性与毒力因子关系密切,毒力因子的种类决定了所致疾病的种类及严重程度。此外,本研究通过玻片凝集试验对15株致病性大肠埃希菌的O抗原进行了检测,其中2株为O20,1株为O154,为常见致病性大肠埃希菌血清型,其余12株未能确定血清型,定型株比例(3/15)显著低于梅妹等对东北地区鹿源大肠埃希菌血清型调查的O抗原定型株比例,这可能与本调查的样本数较少有关,但也可能反映了鹿源大肠埃希菌O抗原新血清型的出现[6]。
外膜蛋白、铁转运系统、黏附素、毒素等多种毒力因子与大肠埃希菌的侵袭力和致病性息息相关,是其主要的致病因子[10-14]。试验对这些毒力因子进行了PCR扩增检测。ompA作为质粒编码的外膜蛋白,其在致病过程中起着重要作用、cvi、traTa、iss作为血清类毒力因子,其检出的比例较高,APEC能够产生空泡毒素(Vat),该毒素对蛋白水解酶及热稳定性方面与幽门螺杆菌的空泡形成毒素(VacA)相似,能够使成熟的蛋白运送至细胞表面。iss基因在禽致病性大肠埃希菌中所占比例在80%以上,但与人源致病性大肠埃希菌的相关性较低[15],而在鹿源大肠埃希菌中检测到还属首次。sta基因作为耐热性肠毒素,是毒力因子检测的标志性基因,本次33.33%的检出率也说明了其在麋鹿致病机理中起着重要作用。作为气杆菌素家族的iucD基因,有研究通过构建基因缺失突变株发现,icuD基因编码的IucD蛋白与禽大肠埃希菌的致病性有密切关系。本次对麋鹿致病性大肠埃希菌毒力基因的研究,为进一步探讨麋鹿大肠埃希菌病的致病机理奠定了基础。
从药敏试验可以看出,分离的15株麋鹿源致病性大肠埃希菌对庆大霉素、卡那霉素、头孢唑啉有着极高的敏感度,其次是对氯霉素、新霉素以及链霉素的敏感度也很高,在一定程度上说明了野生动物源的大肠埃希菌具有较低的耐药性。但是麋鹿源大肠埃希菌耐药性的产生依然受到两方面因素的影响,首先保护区曾经在一段时期内出现过养鸡、养鱼等情况,在上述生产过程中都不可避免地使用过抗菌药物,导致动物粪便菌丛产生抗药性,继而通过麋鹿的采食和饮水等途径进行传播;另一方面,长江水域浓度严重超标的抗菌药物也长期影响着麋鹿源致病菌的抗药性。从用药的性价比来看,同样具有较好效果的卡那霉素比头孢唑啉的价格要更为低廉,可以作为麋鹿的临床用药参考。但是对于目前石首麋鹿自然保护区而言,由于麋鹿常年采食青草,不需要人为补饲,所以对于麋鹿大肠埃希菌病的有效预防和治疗还具有相当的难度,需要开展进一步的研究。
参考文献:
[1]何振,杨道德,马建章,等.湖北石首麋鹿的冬季生境选择[J].四川动物,2007(4):764-768.
[2]杨道德,马建章,何振,等.湖北石首麋鹿国家级自然保护区麋鹿种群动态[J].动物学报,2007,53(6):947-952.
[3]张树苗,梁兵宽,张林源,等.我国圈养麋鹿种群发展面临的挑战及保护管理对策[J]. 林业调查规划,2011(2):128-132.
[4]吴文福,巫月生,赖月辉,等.猪大肠杆菌病的流行特点[J].广东畜牧兽医,2001,26(1):13-15.
[5]袁硕峰.麋鹿致病性大肠杆菌的分离鉴定[J].现代农业科技,2010(13):346-347.
[6]梅妹,范君文,邓旭明,等.长春地区鹿源性大肠杆菌的分离鉴定和耐药性分析[J].中国农学通报,2008,24(8):11-15.
[7 ]陶福军.西丰县某养鹿场梅花鹿溶血性大肠杆菌病的诊疗[J].山东畜牧兽医,2011,32(3):64-65.
[8]Pathipati P,Menon T,Kumar N,et al.Usefulness of 16S rDNA sequencing for the diagnosis of infective endocarditis caused byCorynebacteriumdiphtheriae[J].J Med Microbiol,2012, 61(Pt 8): 1159-1161.
[9]Suzuki R B,Almeida C M.Speranca M A.Absence ofHelicobacterpylorihigh tetracycline resistant 16S rDNA AGA926-928TTC genotype in gastric biopsy specimens from dyspeptic patients of a city in the interior of Sao Paulo, Brazil[J].BMC Gastroenterol, 2012, 12: 49.
[10]Foley S L,Horne S M,Giddings C W,et al.Iss from a virulent avianEscherichiacoli[J].Avian Dis, 2000, 44(1): 185-191.
[11]Gao Q,Jia X,Wang X,et al.The avian pathogenicEscherichiacoliO2 strain E058 carrying the defined aerobactin-defective iucD or iucDiutA mutation is less virulent in the chicken[J].Infect Genet Evol,2015,30: 267-277.
[12]Wu H H,Yang Y Y,Hsieh W S,et al.OmpA is the critical component forEscherichiacoliinvasion-induced astrocyte activation[J].J Neuropathol Exp Neurol,2009,68(6): 677-690.
[13]崔艳艳,高洪,严玉霖,等.大肠埃希菌外膜蛋白F与细菌耐药性研究进展[J].动物医学进展,2013,34(6):164-166.
[14]魏宽翠,夏玉龙,马兴树.禽致病性大肠埃希菌黏附素研究进展动物医学进展[J].动物医学进展,2012,33(3):105-109.
[15]樊琛,刘桂芹,王亚君,等.ss蛋白在鸡源大肠杆菌不同毒力菌株中的检测[J].畜牧与兽医,2010,42(2):71-74.
Isolation,Identification and Drug Sensitivity Test of PathogenicEscherichiacolifromElaphurusdavidianusin Shishou
GUO Ding-zong1,ZOU Miao1,WAN Chun-yun1,ZHANG Wei1,GUO Rui2, YANG Shi-jin1
(1.HuazhongAgriculturalUniversity,Wuhan,Hubei,430070,China;2.HubeiAcademyofAgriculturalScience,Wuhan,Hubei,430064,China)
Abstract:National Nature Reserve of Elaphurus davidianus in Shishou is one of the three protection bases in our country,and Elaphurus davidianus in the natural pasture are susceptible to E.coli,which may lead to death.In order to ascertain the current status of E.coli infection and epidemic and find out its pathogenicity and major virulence factors in Elaphurus davidianus in Shishou,we isolated 15 strains of pathogenic E.coli from the samples by the drug sensitivity tests,the biochemical identifications,16 S rDNA PCR and the virulence experiments in mice.The rusult of the drug sensitivity tests showed that 15 strains of E.coli were most susceptible to gentamicin,kanamycin and cefazolin and the sensitivity rate were 100%;and they were all susceptible to chloramphenicol,neomycin and streptomycin,and the sensitivity rate were more than 60%;they had a strong drug resistance to clindamycin and sulfadiazine,and the resistant rates were 80% and 60% respectively. The virulence detection results showed that the main virulence factors were ompA(100%),traTa(80%),ISS(80%),iucD(60%),irp2(53.33%),sta(33.33%),cva/cvi(26.67%) and VAT(20%).
Key words:pathogenic Escherichia coli;Elaphurus davidianus;isolation and identification;drug sensitivity test;virulence factor
文章编号:1007-5038(2016)03-0052-07
中图分类号:S852.612;S858.9
文献标识码:A
作者简介:郭定宗(1963-),男,湖北人,教授,硕士,主要从事动物营养代谢病学研究。
基金项目:鄂环办(2011)282项目;长江航道整治生态补偿项目
收稿日期:2015-06-10
