黄芩水煎液中黄芩苷的HPLC测定及其抗内毒素作用
2016-04-07王明明
杨 舒,张 倩,冯 波,王明明,穆 祥
(北京农学院兽医学(中医药)北京市重点实验室,北京 102206)
黄芩水煎液中黄芩苷的HPLC测定及其抗内毒素作用
杨舒,张倩,冯波,王明明,穆祥*
(北京农学院兽医学(中医药)北京市重点实验室,北京 102206)
摘要:通过HPLC法分析黄芩水煎液中黄芩苷含量,采用显色基质法鲎试验进行相关单体成分的抗内毒素定量测定。结果表明,黄芩水煎液中含量最多的单体成分为黄芩苷,显色基质法鲎试验结果表明,不同浓度(50、25、12.5、6.25、3.125 μg/mL)的黄芩苷溶液对内毒素的破坏率分别为45.08%、54.39%、57.45%、61.78% 和82.80%,其破坏率呈浓度依赖性,可知黄芩水煎液中含量最多的成分黄芩苷具有灭活内毒素的作用。
关键词:黄芩水煎液;黄芩苷;高效液相色谱;抗内毒素
近年来,长期大量地使用抗生素诱生了很多的广谱耐药菌,残留在动物性食品中的抗生素也日益增多,且抗生素在杀灭细菌的同时,往往会诱发内毒素的释放,从而引起内毒素血症,加重病情,导致革兰阴性菌感染所致的病死率居高不下[1]。细菌内毒素(endotoxin,ET)是革兰阴性细菌细胞壁最外层的脂多糖(lipopolysaccharide,LPS)成分[2],内毒素进入机体后可引起机体的发热反应[3]以及血小板的黏附、聚集,触发凝血系统,导致弥漫性血管内凝血(DIC)[4],还可引起全身性炎症反应综合征(systemic inflammatory responses yndrome,SIRS)或脓毒症(sepsis )[5],并导致心肌损害、肺损伤、肝衰竭、肾衰竭、胃肠道损伤等多器官功能障碍(MODS)[6]等。因此,寻找能拮抗和破坏内毒素的有效药物已成为当前国内外研究的热点之一。中医将内毒素致病归为热毒范畴,与温病病因、病机辩证原则相吻合。中草药被用来治疗各种感染性疾病的历史悠久,在多年的临床上表明,清热解毒中药用于治疗“热毒”、“邪毒”有很好的疗效。
黄芩为唇形科植物黄芩(ScutellariabaicalensisGeorgi)的干燥根,是我国具有代表性的清热解毒中药。其主产区有河北、辽宁、陕西、山东、内蒙古、黑龙江等,具有清热燥湿、泻火解毒、止血、安胎等功效[7]。黄芩中含有多种黄酮类衍生物,其主要成分有黄芩苷(baicalin )、黄芩素(scuteuarin)、汉黄芩苷(wogonoside)、汉黄芩素(wogonin)等[8-9]。而黄芩苷作为黄芩的主要化学成分,具有抗菌、抗肿瘤、抗炎、抗病毒等广泛的药理作用[10-15]。本实验室前期研究证明,黄芩水煎液具有良好的灭活内毒素的能力。因此,本试验建立了高效液相色谱测定黄芩苷的方法,对黄芩水煎液中的黄芩苷含量进行了测定,并利用显色基质法鲎试验对黄芩苷体外破坏内毒素的作用进行研究,为进一步阐明黄芩苷清热解毒的作用机制奠定了基础。
1材料与方法
1.1材料
Waters2695高效液相色谱系统、Waters2998光电二极管阵列检测器、Empower 工作站,美国沃特世公司产品;Venusil MP C18(2)色谱柱(5 μm,150 mm×4.6 mm),博纳艾杰尔公司产品;Milipore水纯化系统,美国密理博公司产品;R1002B型旋转蒸发仪,上海申顺生物科技有限公司产品;CK-32A型全自动陶瓷保健壶,捷达家用电器厂产品;QL-901型漩涡混合器,海门市其林贝尔仪器制造有限公司产品;黄芩苷对照品,中国食品药品检定研究院产品;黄芩,北京同仁堂产品;甲醇、乙腈均为色谱纯,塞默飞世尔科技有限公司产品;显色基质鲎试剂盒,Tris-缓冲液,厦门市鲎试剂实验厂有限公司产品。
1.2方法
1.2.1黄芩水煎液中黄芩苷含量的测定
1.2.1.1色谱条件流动相A为6 g/L的磷酸溶液,流动相B为乙腈,梯度洗脱程序如下:0~30 min,80%~73%A,20%~27%B;流速1 mL/min;进样量20 μL,柱温25℃。
1.2.1.2对照品溶液制备精密称取黄芩苷对照品10 mg,置于10 mL 容量瓶中,用甲醇溶解并定容,制成1 mg/mL的对照品溶液。
1.2.1.3供试品溶液制备准确称取黄芩50 g放入药罐中,加入10倍体积水浸泡30 min。打开开关,调到快火,开始熬药。待水沸腾后,将其调到慢火,维持沸腾30 min,冷却至室温,将药液倒入大烧杯中。第2次加入8倍体积水,重复第1次过程。然后合并滤液,16层纱布粗滤,再用布氏漏斗真空抽滤,转入另一干净大烧杯中(保鲜膜封口)。将过滤后的药液倒入旋转蒸发仪(每次不超过体积的1/3),水浴温度50℃,转速60,将其浓缩至0.1 g生药/mL,摇匀,0.45 μm 微孔滤膜滤过,取滤液,即得供试品溶液。
1.2.1.4标准曲线的绘制精密吸取黄芩苷对照品溶液5、10、20、30、40、50 μL,注入色谱仪,记录峰面积,以黄芩苷对照品进样量的对数值为横坐标,峰面积的对数值为纵坐标,计算回归方程,并绘制标准曲线。
1.2.1.5精密度试验精密吸取同一份对照品溶液,连续进样6 次,每次进样20 μL,测定峰面积,并计算其RSD。
1.2.1.6稳定性试验取同一份供试品溶液,分别于配制后0、4、8、12、16、20、24 h进样20 μL,测定峰面积,并计算其RSD。
1.2.1.7重复性试验取同一批供试品样品,按“1.2.1.3”中的方法制备6 份供试品溶液,分别进样20 μL,测定峰面积,并计算其RSD。
1.2.1.8加样回收率试验精密量取已知含量的同一批样品6 份,按“1.2.1.3”方法制备6 份供试品溶液,每份5 mL,分别精密加入5 mL黄芩苷对照品溶液,各取20 μL注入色谱仪,测定峰面积,计算加样回收率。
1.2.1.9样品含量的测定取3批黄芩样品,按“1.2.1.3”制备样品供试液,按“1.2.1.1”色谱条件进行测定,以外标两点法计算黄芩苷含量。
1.2.2显色基质法鲎试验对黄芩苷破坏内毒素的定量测定
1.2.2.1黄芩苷溶液制备精密称取黄芩苷对照品5 mg,置于100 mL容量瓶中,加内毒素检查用水(BET水)(提前预热到30℃)和Tris-缓冲液溶解并定容至100 mL,制成浓度为50 μg/mL的供试品原液,涡旋5 min左右,使其充分溶解混匀。然后依次稀释成浓度为25、12.5、6.25、3.125μg/mL的供试品溶液,每稀释一次涡旋30 s。
1.2.2.2细菌内毒素工作标准品的稀释取细菌内毒素工作标准品(10 EU/支)1支,每支准确加入BET水1 mL,充分涡旋混合15 min,得浓度为10 EU/mL的细菌内毒素工作标准品,然后依次稀释成浓度为5、1、0.5、0.25、0.1 EU/mL的内毒素溶液,每稀释1次涡旋30 s。
1.2.2.3标准曲线的绘制取5支无热原试管依次分别加入0.1 mLBET水、0.1、0.25、0.5、1 EU/mL的内毒素标准溶液,再分别加入0.1 mL鲎试剂溶液,混匀,37℃孵育10 min。温育结束后,分别加入0.1 mL显色基质溶液,混匀,37℃孵育6 min。温育结束后,分别加入0.5 mL偶氮化试剂1,混匀;再分别加入0.5 mL偶氮化试剂2,混匀;再分别加入0.5 mL偶氮化试剂3,混匀,静置5 min,吸取混合液至无热源96孔板内,于545 nm波长处读取吸光度值。每个样品重复4孔,求取平均值。以内毒素浓度(EU/mL)为横坐标,吸光度值为纵坐标,计算回归方程。
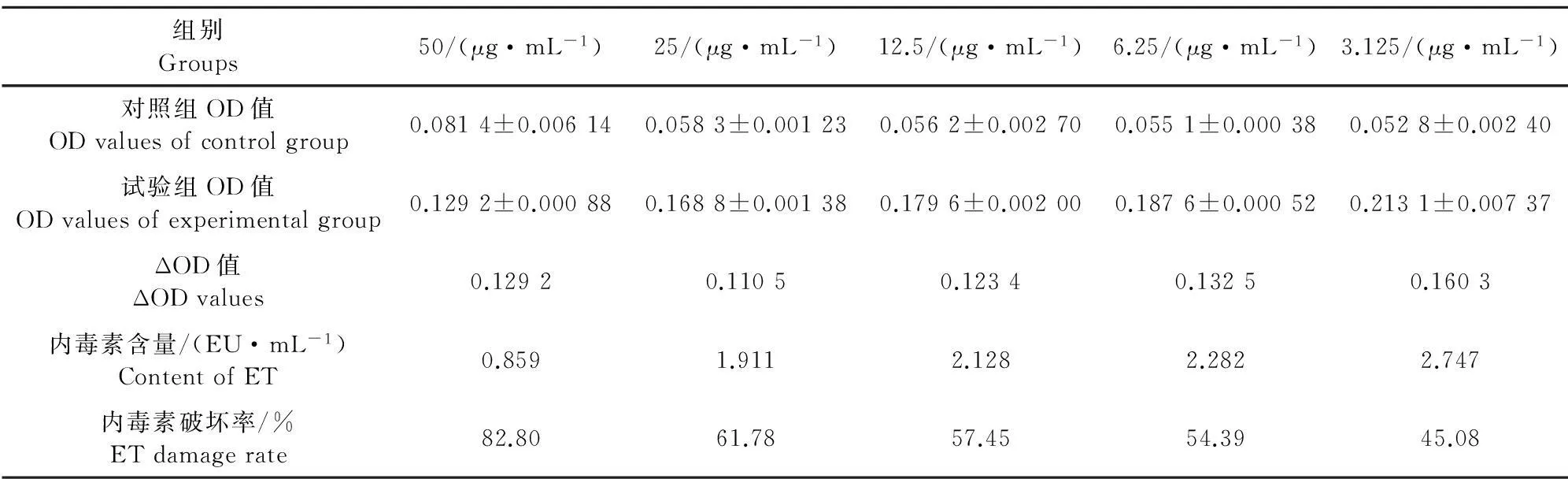
1.2.2.4黄芩苷对内毒素破坏率的测定取8支无热原试管依次分别加入0.05 mL不同浓度(50、25、12.5、6.25、3.125μg/mL)的供试品,分成试验组和对照组,每组4管。试验组每管分别加入0.05 mL 5 EU/mL内毒素标准溶液,对照组每管分别加入等量的BET水,混匀,37℃孵育60 min。温育结束后,分别加入0.1 mL鲎试剂溶液,混匀,37℃孵育10 min。温育结束后,分别加入0.1 mL显色基质溶液,混匀,37℃孵育6 min。温育结束后,分别加入0.5 mL偶氮化试剂1,混匀;再分别加入0.5 mL偶氮化试剂2,混匀;再分别加入0.5 mL偶氮化试剂3,混匀,静置5 min,吸取混合液至无热源96孔板内,于545 nm波长处读取吸光度值。每个样品重复4孔,求取ΔOD值(ΔOD = OD试验组-OD对照组 ),根据标准曲线,计算内毒素含量,然后利用公式:内毒素破坏率=(5-内毒素含量)/5×100%,计算内毒素破坏率。
2结果
2.1黄芩水煎液中黄芩苷的含量测定
2.1.1液相条件 试验中采用6 g/L的磷酸溶液-乙腈作为流动相,在此条件下黄芩苷与相邻色谱峰的分离效果良好,并且药物的峰形对称,没有拖尾现象。按此色谱条件测得黄芩水煎液样品和黄芩苷对照品的色谱图见图1和图2。
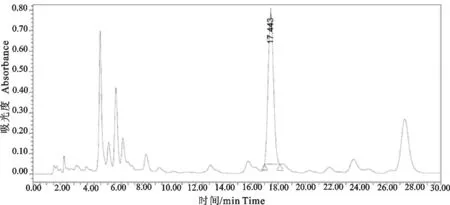
图1 黄芩水煎液样品的HPLC色谱图
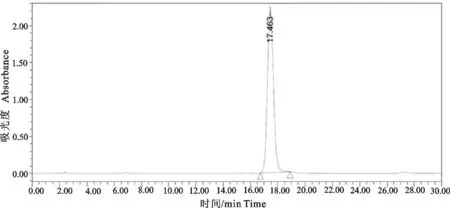
图2 黄芩苷对照品的HPLC色谱图
2.1.2标准曲线的绘制 以黄芩苷对照品进样量的对数值为横坐标,峰面积的对数值为纵坐标,黄芩苷含量测定的回归方程为y=0.949 3x+6.574 5,r =0.999 6,说明黄芩苷在5 μg~50 μg 范围内,峰面积的对数值与黄芩苷对照品进样量的对数值呈良好的线性关系(图3)。

图3 黄芩苷的标准曲线
2.1.3精密度试验 黄芩苷峰面积的RSD为1.37%,说明仪器精密度良好。
2.1.4稳定性试验 供试品24 h 内峰面积RSD为1.29%,说明供试品溶液在24 h 内稳定性良好。
2.1.5重复性试验 黄芩苷的平均含量(n=6)为3.125 g/kg,6份供试品峰面积RSD为0.93%,说明方法重复性良好。
2.1.6加样回收率试验 6份样品中黄芩苷的平均回收率为100%,RSD为1.40%,说明回收率良好。
2.1.7样品含量的测定 3批黄芩中的黄芩苷含量见表1,其平均值为3.14 g/kg,RSD为1.27%,说明该测定方法准确、可靠,可用于测定黄芩水煎液中的黄芩苷含量。
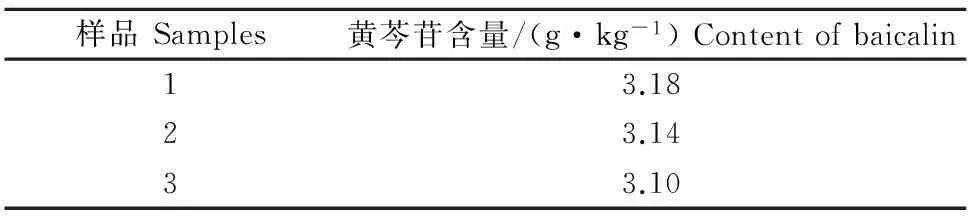
表1 黄芩水煎液中黄芩苷含量的测定结果
2.2显色基质法鲎试验对黄芩苷破坏内毒素定量测定
2.2.1标准曲线的绘制 以内毒素浓度(EU/mL)为横坐标,以545 nm吸光度值为纵坐标,计算回归方程为y=0.056 5x+0.001 1,r =0.986 1。标准曲线见图4。说明内毒素浓度在0.1 EU/mL~1.0 EU/mL与吸光度值之间呈线性相关。
2.2.2黄芩苷对内毒素破坏率的测定 不同浓度黄芩苷对内毒素的破坏率结果见表2,可知随着黄芩苷浓度的增高,其对内毒素的破坏率不断增加,当
黄芩苷浓度为50 μg/mL的时候,对内毒素的破坏率可达到82.8%,并且这种破坏作用呈浓度依赖性。
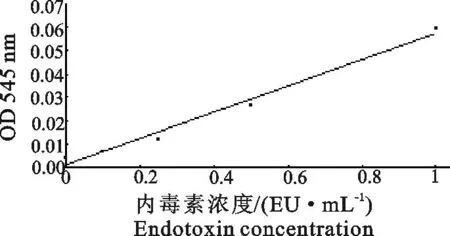
图4 特异性显色基质法标准曲线
组别Groups50/(μg·mL-1)25/(μg·mL-1)12.5/(μg·mL-1)6.25/(μg·mL-1)3.125/(μg·mL-1)对照组OD值ODvaluesofcontrolgroup0.0814±0.006140.0583±0.001230.0562±0.002700.0551±0.000380.0528±0.00240试验组OD值ODvaluesofexperimentalgroup0.1292±0.000880.1688±0.001380.1796±0.002000.1876±0.000520.2131±0.00737ΔOD值ΔODvalues0.12920.11050.12340.13250.1603内毒素含量/(EU·mL-1)ContentofET0.8591.9112.1282.2822.747内毒素破坏率/%ETdamagerate82.8061.7857.4554.3945.08
3讨论
3.1色谱条件的选择
在色谱条件优化过程中,流动相考察了甲醇-水-醋酸系统[16],甲醇-水- 磷酸系统[17],乙腈-水-醋酸系统以及乙腈-水-磷酸系统。黄芩苷的结构为5,6-二羟基酮-7-0葡萄糖醛酸苷,可以通过在流动相中加入磷酸来抑制其解离[18],防止色谱峰拖尾,从而改善峰形。经比较,乙腈-水- 磷酸系统较好,在此条件下出峰时间合适,黄芩水煎液中各成分能够得到较好的分离。
本试验通过建立高效液相色谱法分析黄芩水煎液中的水溶性化学成分,并测定了其中黄芩苷的含量。试验结果表明,本方法简单,准确、灵敏、重现性好,为评价黄芩质量提供了相关依据,同时保证了本试验测试成分选取的正确性。
3.2显色基质法鲎试验成分的选取
由图1~图2可知,在黄芩苷对照品色谱峰的相应位置上,供试品溶液具有相同保留时间的色谱峰,出峰时间一致,说明黄芩水煎液中含有黄芩苷并且不同批次黄芩中黄芩苷含量均为最高。考虑到抗内毒素的效果及后续产品的开发,本试验选取黄芩水煎液中含量最高的中药单体成分黄芩苷用于显色基质法鲎试验。
3.3黄芩苷抗内毒素作用
目前,抗生素作为抗菌助长剂添加到饲料中,对控制畜禽疾病的发生,促进畜禽生长发育,提高饲养效益确实起到积极的作用。抗生素是通过灭活饲料中的细菌,减少细菌内毒素的释放,从而减轻对机体的伤害,保证机体的正常发育。但是长期、大量地使用抗生素也产生很多问题,比如诱生了很多的广谱耐药菌、残留在动物类食品中的抗生素也日益增多等,世界各国都陆续开始限制或禁止将抗生素添加在饲料里。因此,我们想要寻找一种能够灭活细菌内毒素,部分代替抗生素的药物作为饲料添加剂来观察是否可以维持动物正常生长。
鲎试剂是FDA认可的LPS 检测试剂,也是目前最常用的细菌LPS检测试剂[19]。显色基质法鲎试剂灵敏度高,专一性强,采用此法来检测中药成分抗细菌内毒素作用,方法简易、快捷。其作用原理为细菌内毒素通过激活鲎试剂中的C因子,引起一系列酶促反应,最终使鲎试剂中的凝固酶原转化为凝固酶,该酶可以分解人工合成的显色基质,使其分解为多肽和黄色的对硝基苯胺(pNA,λmax = 405 nm)。在一定时间内,pNA的生成量与细菌内毒素浓度成正相关,据此,可以定量检测内毒素的浓度。 但影响该法的因素较多,尤其是反应液的pH。因此,本试验采用pH6.0~8.0的Tris缓冲液处理黄芩苷溶液,以避免pH对鲎试剂的影响。试验结果显示,浓度为3.125、6.25、12.5、25、50 μg/mL的黄芩苷对内毒素的破坏率分别为45.08%、54.39%、57.45%、61.78% 和82.80%。说明不同浓度的黄芩苷能不同程度地破坏内毒素且黄芩苷溶液破坏内毒素的作用具有浓度依赖性,浓度越大,灭活内毒素作用越强。以上结果提示,黄芩苷可能是黄芩拮抗内毒素作用的主要成分,为今后对黄芩苷破坏内毒素机制的研究以及对动物饲料添加剂的选取奠定了基础。
参考文献:
[1]常明向,章晶,陈科力.单味中药及活性成分体外抗内毒素实验研究[J].中国药师,2007,10(1):8.
[2]Rietschel E T,Brade L,Lindner B,et al.Biochemistry of lipopolysaccharides[M].Morrison D C,Ryan J L,eds.Bacterial Endotoxic lipopolysaccharides,1992:3.
[3]蒋建新,姚咏明,郑江.细菌内毒素基础与临床[M].北京:人民军医出版社,2004:16-200.
[4]吕根法,王国治,石宏伟,等.中草药拮抗内毒素作用机制研究进展[J].河南科技大学学报:医学版,2010,28(3):232-232.
[5]王自力,索占伟,穆祥,等.内毒素对微循环及血管内皮细胞功能影响的研究进展[J].动物医学进展,2003,24(6):45-48.
[6]Erridge C,Bennctt-Guerrero E,Poxton I R.Structure and function of lipopolysaccharides[J].Microbes and Infection,2002,4:837-851.
[7]国家兽药典委员会.中华人民共和国兽药典:二部[S].北京:化学工业出版社,2010.
[8]Kuroda M, Iwabuchi K,Minaki Y.Chemical constituents of the aerial parts ofScutellarialaterifloraand their alpha-giucosidase inhibitory activities[J].Nat Product Commun,2012,7(4):471-474.
[9]Zhang Z,Lian X,Li S,et al.Characterization of chemical ingredients and anticonvulsant activity of American skullcap(Scutetlarialateriflora)[J].Phytomedicine,2009,16(5):485-493.
[10]吴静,胡东,王克霞.黄芩和黄芩苷对幽门螺旋杆菌的体外抗菌活性研究[J].中药材,2008,3l(5):707-710.
[11]任学群,李宜雄.黄芩素抗肿瘤机制研究进展[J].河南大学学报:医学版,2010(3):175-179.
[12]杨莉,尤启冬, 杨勇,等.汉黄芩素抗肿瘤作用的研究进展[J].中国药科大学学报,2009,40(6):576-579.
[13]崔晓燕,张敏,刘晓明.黄芩含药血清对3种巨噬细胞的抗炎免疫活性[J].中国临床药理学杂志,2011,27(4):287-290.
[14]张汝学,贾正平,刘景龙,等.黄芩水提取物对急性肺损伤大鼠的保护作用及其与胆碱抗炎通路的相关性研究[J].中草药,2012,43(2):316-320.
[15]吴莹,金叶智,吴瑶,等.黄芩主要成分体外抗甲型流感病毒作用的研究[J].北京中医药大学学报,2010(8):541-545.
[16]赵晓霞,马二华,卡子文.HPLC法测定宁神口服液中黄芩苷含量[J].中医药信息,1995(1):46.
[17]国家兽药典委员会.中华人民共和国兽药典:一部[S].北京:化学工业出版社,2000.
[18]宋红英,刘放.反相高效液相色谱法测定黄芩及其制剂中黄芩苷含量[J].药学实践杂志,2002,20(5):286-288.
[19]Obata T,Nomura M,Kase Y,et al.Early detection of the limulus amebocyte lysate reaction evoked by endotoxins[J].Anal Biochem,2008,373(2):281-286.
Determination of Baicalin Component from Water Decoction ofScutellariae
baicalensisby HPLC and Study on Anti-endotoxin Effects of Baicalin
YANG Shu,ZHANG Qian,FENG Bo,WANG Ming-ming,MU Xiang
(BeijingAgricultureCollegeBeijingKeyLaboratoryofTCVM,Beijing,102206,China)
Abstract:The components of baicalin from the water decoction of Scutellariae baicalensis were determined by HPLC,the limulus test was adopted to make a quantitative determination of the related monomer components.The results of HPLC showed that the most component of the water decoction of Scutellariae baicalensisis baicalin.The result of the limulus test showed that different concentrations of baicalin( 50,25,12.5,6.25,3.125 μg/mL) had different destruction percentages of 45.08%,54.39%,57.45%,61.78% and 82.80% to endotoxixin,respectively,its destruction percentage by baicalin was in a dose-dependent manner.Then the major components of baicalin from the water decoction of Scutellariae baicalensishad anti-endotoxin effects.
Key words:water decoction of Scutellariae baicalensis;baicalin;HPLC;anti-endotoxin
文章编号:1007-5038(2016)03-0047-05
中图分类号:S858.74
文献标识码:A
作者简介:杨舒(1989-),女,河南郑州人,硕士研究生,主要从事中兽医学研究。*通讯作者
基金项目:国家现代农业科技成果惠民科技示范工程项目(Z121100007412004);“十二五”国家支撑计划(2011BAD34B03-5);国家自然科学基金项目(31272144)
收稿日期:2015-09-18
