山羊源产单核细胞李斯特菌的分离与鉴定
2016-04-07马光强刘丽娟王开功程振涛周碧君
马光强,刘丽娟,文 明,2,王开功,2,程振涛,2*,周碧君,2*
(1.贵州大学动物科学学院,贵州贵阳 550025;2.贵州省动物疫病与兽医公共卫生重点实验室,贵州贵阳 550025)
山羊源产单核细胞李斯特菌的分离与鉴定
马光强1,刘丽娟1,文明1,2,王开功1,2,程振涛1,2*,周碧君1,2*
(1.贵州大学动物科学学院,贵州贵阳 550025;2.贵州省动物疫病与兽医公共卫生重点实验室,贵州贵阳 550025)
摘要:从贵州省盘县某养羊场病例组织样本中分离出1株疑似产单核细胞李斯特菌(Lm)。通过革兰染色、生化鉴定、PCR扩增hly基因、克隆、测序、序列分析及药敏试验等方法对可疑菌株进行分析鉴定。结果显示,该分离菌的培养特性、菌落形态、菌体形状特征、生理生化特征均与文献报道的产单核细胞李斯特菌相同,并从该分离菌株基因组中扩增到大小约850 bp的Lm的特异性DNA片段,其序列与GenBank中其他Lm地方株核苷酸同源性在39.1%~99.7%之间,其中与从发病动物分离到的加拿大、瑞士参考株同源性最高,均达到99.7%,与其他途径分离到的参考菌株同源性都很低,分子水平上进一步证实分离菌株为产单核细胞李斯特菌,且从不同途径分离的地方株hly基因差异大。研究结果为本病临床防控与治疗提供理论依据。
关键词:产单核细胞李斯特菌;分离鉴定;hly基因;序列分析;山羊
产单核细胞李斯特菌(Listeriamonocytogenes,Lm)是一种兼性胞内寄生的革兰阳性杆菌,可穿越宿主的肠道屏障、血脑屏障和胎盘屏障,也是一种重要的食源性人兽共患病原菌[1-2]。机体主要靠细胞免疫功能清除本菌[3]。Lm在自然界中分布广泛,营腐生生活,能在0℃~45℃、pp.4~9.4的环境中生长,可以从腐败植物、水、土壤、粪便中分离到Lm[4],尤其是屠宰场和食品加工厂周围的环境,很容易被带菌粪便污染[5-6]。Lm引起的动物李斯特菌病以散发性或小范围暴发为主,可引起猪、绵羊、牛、家兔发生脑膜脑炎、流产和急性败血病,家禽感染可导致败血症和心肌坏死[7-8]。Lm也是李斯特菌属唯一感染人类的细菌[9],除了对畜牧业造成经济损失以外,还可通过动物性食品传染给人,对人类健康造成极大威胁[10]。
Lm的致病性大多与其毒力基因息息相关。贺春月等[11]2013年对我国14个省383株Lm的研究,得出hly基因是Lm中55个致病相关基因之一,并且存在于所有供试菌株中。随着遗传学的不断发展,已有很多证据证明hly是李斯特菌属中Lm特有的毒力标志基因,它编码的李斯特菌溶血素LLO是Lm重要且必须的毒力因子之一,不存在于其他非致病性李斯特菌中。基于其所建立的PCR检测方法可区分Lm和其他非致病性的李斯特菌[12]。
2015年1月,贵州省六盘水市盘县某羊场存栏波尔山羊1 000余只,其中有34只年龄2岁~4岁的羊只陆续表现出呼吸急促,食欲下降,机体消瘦,流涎,口吐白沫等症状,死亡19只,发病率3.4%,病死率55.88%。对该羊场2头发病羊的剖检可见肺充血、水肿,肠系膜淋巴结肿大,肝脏有灰白色坏死灶,脾脏肿大等病理变化。对2只羊的肝脏、脾脏、肾脏和脑组织进行细菌分离,对分离病原进行生化、分子生物学鉴定及耐药性分析,对临床病例做出确诊。对单增李斯特菌hly基因进行克隆测序,分析其与国内外分离菌株的基因同源性与亲缘关系,为贵州省羊场产单核细胞李斯特菌病的防控提供理论依据。
1材料与方法
1.1材料
1.1.1菌种及样本来源单增李斯特菌参考株GZ-CK,由贵州省动物疫病与兽医公共卫生重点实验室分离并保存;病羊,来自贵州省盘县某羊场。
1.1.2培养基及试剂细菌微量生化反应管,杭州微生物试剂有限公司产品;克隆载体pMD19-T由贵州省动物疫病与兽医公共卫生重点实验室保存;2×TaqPCR Master Mix、DNA Marker DL 2 000 、细菌基因组DNA提取试剂盒,天根生化科技有限公司产品;Gel Extraction Kit(50×)、EZNATMPlasmid Mini Kit质粒提取试剂盒,Omega公司产品;其他它试剂均为国产分析纯。
1.1.3引物参照文献[13]合成Lm hly基因特异性引物,序列为:hly-P1:5'-CCTAAGACGCCAATCGAAAAGAAA-3',hly-P2:5'-TAGTTCTACATCAACTGAGACAGA-3',预扩增片段大小约850 bp。引物由上海生工生物工程技术服务有限公司合成。
1.2方法
1.2.1病原菌的分离培养取病羊的肝脏、脾脏、肾脏和脑等病变组织在无菌条件下接种于鲜血琼脂培养基,每一病料接种两个平板,于37℃条件下分别进行需氧及厌氧培养24 h,然后在无菌条件下分别挑取血平板上的单个菌落,普通培养基(加血清)进行扩大纯培养和革兰染色镜检。
1.2.2生化鉴定将分离菌接种于胰蛋白胨大豆肉汤,37℃振荡培养20 h,接种生化反应管,于37℃培养48 h,观察并记录结果,参考对照表判定反应结果。
1.2.3药敏试验将分离株和参考株(GZ-CK)菌液调至0.5麦氏浓度,用无菌棉拭子蘸取菌悬液,在试管壁上挤压去掉多余菌液后均匀涂布于厚约4 mm的血琼脂平板,将药敏纸片均匀置于培养基表面,37 ℃恒温培养24 h。根据NCCLS抗微生物药物敏感试验的执行标准(纸片扩散法)判断结果。
1.2.4病原菌分子生物学鉴定
1.2.4.1基因组总DNA提取将分离株和参考株纯化培养后。按照细菌基因组DNA提取试剂盒说明书提取细菌基因组DNA。
1.2.4.2Lm-hly基因PCR扩增以所提取的基因组总DNA为模板,应用引物hly-P1/ hly-P2进行目的基因扩增。PCR反应体系为:2×TaqPCR MasterMix 12.5 μL,DNA模板 1.0 μL,上、下游引物各1.0 μL(10 μmol/L),加灭菌双蒸水补足至25 μL。PCR反应参数为:94 ℃预变性5 min;94 ℃40 s,57 ℃40 s,72 ℃90 s,34个循环;72 ℃延伸10 min,4 ℃终止反应。PCR反应结束后,PCR产物进行12 g/L琼脂糖凝胶电泳检测。
1.2.4.3Lm hly基因克隆及序列分析hly基因PCR产物经12 g/L琼脂糖凝胶电泳后,参照Gel Extraction Kit小量胶回收试剂盒操作说明书进行目的基因胶回收,回收产物与pMD19-T载体连接并转化感受态细胞Dpα。按照EZNATMPlasmid Mini Kit试剂盒提取重组菌质粒DNA进行PCR鉴定和双酶切鉴定,阳性重组质粒由上海生工生物工程技术服务有限公司测序。用DNA MAN等生物软件将Lm贵州分离株hly基因测序序列与国内外分离株进行同源性及系统发育树分析。
2结果
2.1病原形态及培养特性
组织材料接种普通营养琼脂、麦康凯琼脂培养基和血琼脂培养基37℃ 24 h,可见分离细菌在有氧和无氧条件下均生长,普通营养琼脂上生长稀疏,麦康凯琼脂上不生长,血琼脂平板上生长茂盛,呈中等大小、圆形、湿润、表面光滑、边缘整齐、灰白色、露滴样菌落,菌落周围产生β溶血环(图1、图2),与参考株及文献报道Lm的培养特性一致。革兰染色镜检显示,分离细菌为革兰阳性、无芽胞、无荚膜、两端钝圆、两极着色的短杆菌(图3、图4),分离细菌形态与文献报道一致。
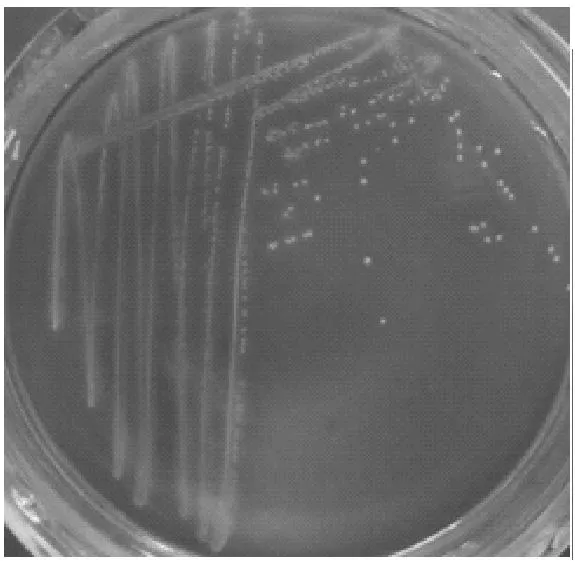
图1 分离菌在血平板上的生长情况
图2 参考菌在血平板上的生长情况
2.2生化鉴定结果
分离菌和Lm参考株分别接种于相应生化反应管,37℃培养24 h,结果见表1。由表1统计结果可知,分离菌株与Lm参考菌株的生化鉴定结果相同,且符合单增李斯特菌的生化特性,初步将其命名为Lm-GZPX01。
2.3药敏试验结果
选择5类21种抗菌药物进行Lm-GZPX01的药敏试验,结果见表2。分离株对β-内酰胺类药物广泛耐药,对氨基糖苷类药物较为敏感,对大环内酯类、喹诺酮类和磺胺类药物最敏感。
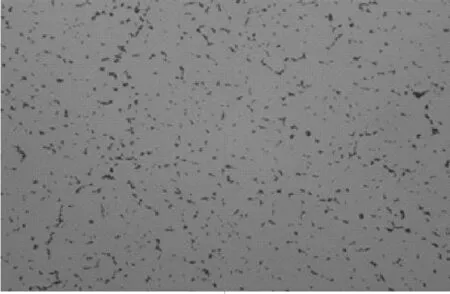
图3 分离菌革兰染色显微镜下观察结果(1 000×)

图4 参考菌革兰染色显微镜下观察结果(1 000×)

生理生化特征Physiologicalandbiochemicalcharacteristics分离菌Isolatedstrain参考菌Referencestrain过氧化氢Hydrogendioxide++葡萄糖Glucose++乳糖Lactose++果糖Fructose++海藻糖Mycose++麦芽糖Maltose++鼠李糖Rhamnose++山梨醇Sorbitol++七叶苷Esculoside++木糖Xylose--甘露醇Mannitol--棉子糖Melitose--卫矛醇Dulcitol--甲基红MethylRed(M-R)++乙酰甲基甲醇Voges-Proskauer(V-P)++硝酸盐Nitrate--
注:“+”阳性反应;“-”阴性反应。
Notes:"+"Positive;"-"Negative.
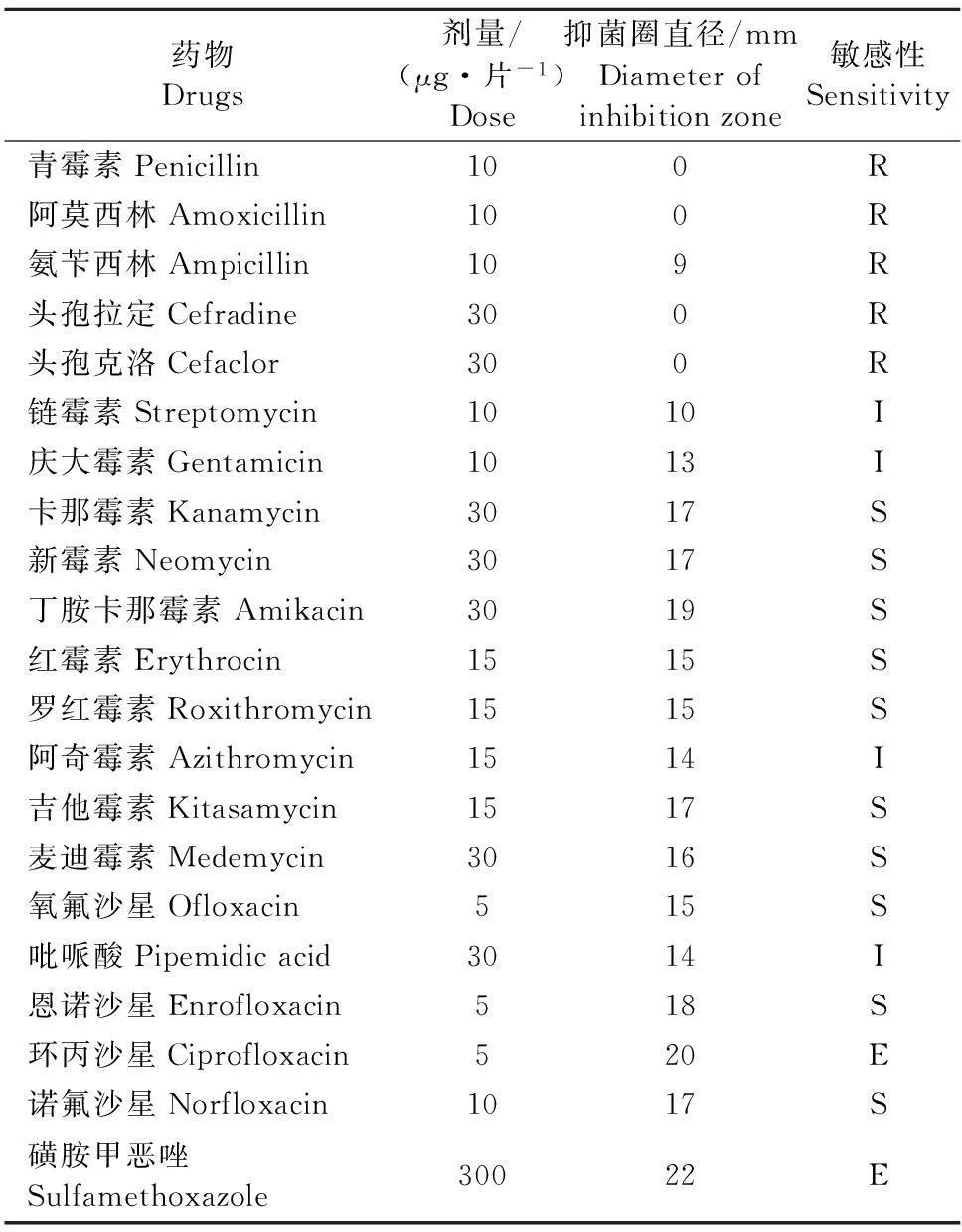
表2 分离菌药敏试验结果
注:E.极度敏感;S.高度敏感;I.中度敏感;R.耐药。
Note:E. Extreme sensitivity;S.High sensitivity; I.Intermediate sensitivity;R.Resistance.
2.4Lm-GZPX01和Lm GZ-CK PCR检测结果
以Lm-GZPX01和Lm GZ-CK基因组DNA为模板,采用特异性引物hly-P1/hly-P2进行PCR扩增,产物经12 g/L琼脂糖凝胶电泳,结果见图5。

M.DNA标准DL 2 000;1.Lm-GZPX01;2.Lm GZ-CK;3.阴性对照
M.DNA Marker DL 2 000;1.Lm-GZPX01;2.Lm GZ-CK;3.Negative control
图5PCR产物电泳鉴定结果
Fig.5Electrophoresis of PCR products
从图5可知, Lm-GZPX01和Lm GZ-CK基因组DNA模板均能扩增出大小约为850 bp的特异性片段,与预期扩增片段大小相符,初步说明分离细菌基因组含有hly基因序列,要确定是否是hly基因特异性片段尚需进行测序判断。
2.5目的基因克隆测序及序列分析结果
2.5.1重组质粒PCR及双酶切鉴定采用引物hly-1/hly-2对重组质粒进行PCR鉴定,应用限制性内切酶BamH I和SalI对重组质粒进行双酶切鉴定,结果见图6。
由图6可见,重组质粒PCR扩增可见一条大小约850 bp的特异性条带,与预期大小一致;双酶切产物中可见载体条带(2 692 bp)和目的条带(约850 bp),结果说明,成功构建了含Lm分离株和参考株hly基因的重组质粒。
2.5.2序列分析结果
2.5.2.1系统进化树分析结果应用BLAST软件将Lm-GZPX01 hly基因序列与 GenBank 中已发表部分Lm株 hly 基因序列进行系统进化树分析 (图7)。由图7可见,Lm-GZPX01与加拿大(Lm 08-5578)和瑞士(Lm60)参考菌株亲源关系最近,与实验室参考菌株亲缘关系较近,而与其他参考株亲缘性相对较远。
2.5.2.2同源性分析结果应用DNA Star分析
软件对Lm-GZPX01和国内外不同地方株到的hly基因序列进行核苷酸同源性分析(表3),结果显示,hly基因核苷酸同源性和与本实验室参考菌株、加拿大株和瑞士株最高,均达到99.7%,而与其他参考株均较低,介于39.1%~39.4%之间。

M.DNA标准DL 2 000;1.Lm-GZPX01重组质粒;2.Lm GZ-CK重组质粒;3.Lm-GZPX01重组质粒双酶切产物;4.参考株重组质粒双酶切产物;5.空质粒
M.DNA Marker DL 2 000;1.The recombinant plasmid of Lm-GZPX01;2.The recombinant plasmid of Lm GZ-CK;3.Double enzyme digestion products of Lm-GZPX01 recombinant plasmid;4.Double enzyme digestion products of Lm GZ-CK recombinant plasmid;5.Eempty plasmid
图6重组质粒PCR及酶切鉴定结果
Fig.6Identification results of recombinant plasmid by
PCR and enzyme digestion

图7 基于hly基因核苷酸序列的遗传进化树
3讨论
李氏杆菌病是由Lm引起的一种人兽共患病,其中羊最为敏感,该病在牛群中零星散发,其中多数病例与冬季饲喂质量较差的、发酵的青贮饲料有关。牛、羊的发病年龄基本一致,一般为2岁~3岁[14]。Lm作为一种重要的病原菌,广泛存在于自然界,由于Lm对各种恶劣环境条件有着较强的耐受性,使得其较易处于食物链的每一个环节而导致人和动物发病,使得各种食品受到污染,最终严重威胁人类的健康。本试验通过实验室细菌分离技术从贵州省盘县某养羊场临床病例获得分离菌株,其形态特征、革兰染色特性和生化特征均与Lm参考株相符;hly基因是Lm特有的基因,存在于所有Lm中,PCR鉴定结果证实其基因组中含有约850 bp的预期扩增hly基因核酸片段,基因测序结果证实,从贵州省某羊场病羊中分离的菌株确为单增李斯特菌。单增李斯特菌为规模化养羊场的主要病原菌之一[15-17],也是一种危害严重的食源性人兽共患病原菌[18-19],研究内容为本病防控及食品安全提出预警预报。

表3 Lm-GZPX01株hly基因与参考毒株的hly基因核苷酸及推导氨基酸同源性分析结果
hly基因是Lm主要的毒力基因,本研究中对Lm贵州分离株hly基因进行系统进化、核苷酸同源性分析表明,Lm贵州分离株与本实验室参考菌株、加拿大株和瑞士株进化关系近,而与其他参考菌株关系较远。比较菌株来源发现,与Lm贵州分离株hly基因序列同源性高的3株细菌均分离自发病动物,而其他菌株为屠宰场环境、加工厂食品、动物性食品及运输工具等来源的分离菌。不同来源分离株与基因特征关系相关性因素尚不明确,但对病原感染防控和环境污染防控可能预示不同解决方案。本研究亦对Lm本地分离株进行药物敏感试验分析,结果显示,分离菌对β-内酰胺类药物广泛耐药,对氨基糖苷类药物较为敏感,对大环内酯类、喹诺酮类和磺胺类药物最敏感。这与尹录等[20]2009年的Lm对β-内酰胺类药物敏感的研究结果不同,与王文燕[21]2014年的Lm对环丙沙星、氧氟沙星敏感的研究结果相似。由于李斯特菌容易产生耐药性,故在进行该病的治疗时应避免长时间使用同一种或同一类抗菌药物,以避免或减缓其强耐药性菌株的出现。产单核细胞李斯特菌广泛分布于自然界,主要经食源性散播,污染饲草的来源和途径,因此,预防该病原菌的感染要从严格把控饲料的生产、加工、储存等途径尽量减少污染。结合药物敏感试验,定期对山羊群体进行药物防控,使用消毒药物对养殖环境进行消毒是有效控制疫情的重要手段。
参考文献:
[1]陆承平.兽医微生物学[M].5版.北京:中国农业出版社,2013:179.
[2]李浩欣,段纲,项勋,等.仔猪李斯特杆菌的分离与鉴定[J].中国畜牧兽医,2015(7):1883-1889.
[3]杨建伟.单核细胞增生性李斯特菌最新研究进展[J].齐鲁医学杂志,2013(5):465-467.
[4]田静.熟肉制品中单增李斯特菌的风险评估及风险管理措施的研究[D] .北京:中国疾病预防控制中心,2010.
[5]Takahashi T,Ochiai Y,Matsudate H,et al.Isolation ofListeriamonocytogenesfrom the skin of slaughtered beef cattle[J].J Vet Med Sci,2007,69(10):1077-1079.
[6]Orsi R H,den Bakker H C,Wiedmann M.Listeriamonocytogeneslineages:Genomics,evolution,ecology,and phenotypic characteristics[J].Int J Med Microbiol,2011,301(2):79-96.
[7]陈溥言.兽医传染病学[M].5版.北京:中国农业出版社,2006:162.
[8]崔焕忠,乔立桥,王义冲.单核细胞增生性李斯特菌的主要毒力因子及其致病机理[J].中国畜牧兽医,2010(1):128-133.
[9]Vanghele M,Ganea E.The role of bacterial molecular chaperones in pathogen survival within the host[J].Rom J Biochem,2010,47(87):100.
[10]王国梁,殷月兰,焦库华,等.绵羊李斯特菌病病原诊断及其生物学特性研究[J].中国人兽共患病学报, 2013(7):639-645.
[11]贺春月,王艳,王天姝,等.中国部分食品来源单增李斯特菌中致病相关基因的分布研究[J]. 疾病监测,2013(5):384-388.
[12]董慧.产单核细胞李斯特菌hly和actA基因的原核表达及其产物的单克隆抗体研制[D]. 江苏扬州:扬州大学,2006.
[13]周晓辉,焦新安.产单核细胞李斯特菌的分子鉴定与亚分型研究[J].中国人兽共患病杂志,2003,19(5):44-47.
[14]周环.牛李斯特菌脑炎的流行、诊断与防治[J].现代畜牧科技,2015(2):126.
[15]Bhasin S K,Chaturvedi S,Sharma A K,et al.Knowledge amongst adult population regarding vectors of malaria in 21 states of India[J].J Commun Dis,2001,33(4):286-296.
[16]蒋原.食源性病原微生物检测指南[M].北京:中国标准出版社,2010:113-115.
[17]Nightingale K K,Windham K,Wiedmam M.Evolution and molecular phylogeny ofListeriamonocytogenesisolated from human and animal listeriosiscases and foods[J].J Bacteriol,2005,187(16):5537-5551.
[18]贾艳艳,何雷,郁川,等.豫西地区市售鸭翅中单增李斯特菌毒力基因的检测[J].中国畜牧兽医,2014(11):283-287.
[19]肖开提,冬不拉提,白军民,等. 一起羊李氏杆菌病的诊断及病因分析[J].中国畜牧兽医,2007(11):117-118.
[20]尹录,杜艳芬,赫明雷,等.哈尔滨市鲜肉中单核细胞增生性李斯特菌的分离鉴定及耐药性分析[J].中国预防兽医学报,2009(12):929-932.
[21]王文燕.猪肉中单核细胞增生李斯特菌的分离与耐药性筛查[D]. 广东广州:华南理工大学,2014.
Isolation and Identification of aListeriamonocytogenesStrain in Caprine
MA Guang-qiang1, LIU Li-juan1,WEN Ming1,2,WANG Kai-gong1,2,CHENG Zhen-tao1,2, ZHOU Bi-jun1,2
(1.CollegeofAnimalScience,GuizhouUiversity,Guiyang,Guizhou,550025,China;2.KeyLaboratoryofAnimalDiseaseandVeterinaryPublicHealthinGuizhouProvince,Guiyang,Guizhou,550025,China)
Abstract:A Listeria monocytogenes(Lm) was isolated from the tissue samples of a infected case in a caprine farm in Pan county of Guizhou province.The isolated strain was analysed and identified by means of Gram staining,biochemical identification,PCR amplification of hly gene,cloning,sequencing,sequence analysis and drug susceptibility test.The results showed that a suspected Lm was isolated from a suspected caprine case,and its cultural characteristics,colony morphology,and physiological-biochemical characteristics were the same as the Lm in literature reports.A specific DNA fragment about 850 bp of Lm was amplified.The nucleotide homology is between 39.1%-99.7% compared with part of strains in GenBank,and is the higest with the strains from Canada and Switzerland(99.7%),very low with the other strains isolated from other ways.The result from the molecular level confirmed that the isolate is a Lm,and the genetic differences between the hly genes of local strains isolated from different ways were significant.The results can provide theoretical data for prevention and treatment of the disease.
Key words:Listeria monocytogenes;isolation and identification;hly gene;sequence analysis;goat
文章编号:1007-5038(2016)03-0033-06
中图分类号:S852.61
文献标识码:A
作者简介:马光强(1987-),男,贵州石阡人,硕士研究生,主要从事动物疫病细菌学研究。*通讯作者
基金项目:贵州省农业攻关项目(黔科合NY[2014]3042号)
收稿日期:2015-08-26
