卵巢上皮癌组织中CRM1、P-p27ser10表达及其对癌细胞增殖的影响
2016-03-28高菲菲薛恺王酉上海市第八人民医院上海005复旦大学附属肿瘤医院上海交通大学附属仁济医院
高菲菲,薛恺,王酉(上海市第八人民医院,上海005;复旦大学附属肿瘤医院;上海交通大学附属仁济医院)
卵巢上皮癌组织中CRM1、P-p27ser10表达及其对癌细胞增殖的影响
高菲菲1,薛恺2,王酉3
(1上海市第八人民医院,上海200235;2复旦大学附属肿瘤医院;3上海交通大学附属仁济医院)
摘要:目的 观察卵巢上皮癌(EOC)组织中出核因子1(CRM1)和10号位丝氨酸(S10)磷酸化p27(P-p27ser10)的表达,并探讨二者对EOC细胞株SKOV3增殖的影响。方法 取64例手术切除的EOC组织,采用免疫组化法检测P-p27ser10、CRM1蛋白表达,分析二者与临床病理特征的关系。以p27野生型[p27(WT)]为模板,构建S10突变的p27去磷酸化突变细胞[p27(S10A)组]和拟磷酸化突变细胞[p27(S10D)组],分别转染S10磷酸化通路相关分子CRM1 siRNA和siRNA阴性质粒到p27(S10D)细胞,建立S10D+siCRM1组和S10D+sictrl组,CCK-8法检测p27 (WT)、p27(S10A)、阴性对照、S10D+siCRM1和S10D+sictrl组细胞的增殖情况,流式细胞仪分析各组细胞周期。结果 P-p27ser10和CRM1在卵巢癌组织中的高表达率分别为76.6%、64.1%,其表达升高与卵巢癌的组织学分级、病理分期有关(P均<0.05),二者表达呈正相关(r=0.656,P<0.01)。S10D+sictrl组较S10A组G1/S期细胞比例明显减少,S10D+siCRM1组较S10D+sictrl组G1/S期细胞比例明显增多(P均<0.05)。S10D+sictrl组细胞增殖较S10A组加快,S10D+siCRM1组较S10D+sictrl组减慢(P均<0.05)。结论 EOC组织中CRM1和P-p27ser10表达升高;CRM1参与了p27 S10磷酸化的出核降解过程,抑制p27 S10磷酸化及CRM1表达均可引起细胞周期阻滞,降低EOC细胞的增殖能力。
关键词:卵巢肿瘤;p27蛋白;10号位丝氨酸;磷酸化;出核因子1;细胞增殖
肿瘤细胞的过度增生与肿瘤细胞增殖周期调控因子紊乱有关。p27蛋白是一种细胞周期激酶(CDK)抑制剂,可负性调控细胞周期,使细胞周期停滞在G1期[1]。p27主要在细胞核内发挥抑癌基因作用,其亚细胞定位在很大程度上影响生物学功能[2]。出核因子1(CRM1)是p27重要的出核蛋白,可以介导10号位丝氨酸(S10)磷酸化后的p27出核转运,该通路可能与肿瘤的异常增殖及周期调控紊乱密切相关[3~5]。2011~2014年,我们观察了S10磷酸化p27(P-p27ser10)、CRM1在卵巢上皮癌(EOC)中的表达及与EOC细胞增殖的关系。现报告如下。
1 材料与方法
1.1材料 收集2004~2009年在南京医科大学附属无锡妇幼保健院手术切除的EOC标本64例,患者年龄30~74岁。排除其他恶性肿瘤,术前均未行放化疗。均经组织病理学检查确诊,根据2000年FIGO公布的手术病理分期标准[5],Ⅰ~Ⅱ期28例,Ⅲ~Ⅳ期36例。EOC细胞株SKOV3购自中国科学院细胞库,用RPMI1640完全培养基于5%CO2、饱和湿度、37℃常规培养传代,收集对数生长期细胞用于实验。
1.2EOC组织中CRM1、P-p27ser10蛋白表达检测取手术切除的EOC组织,4%甲醛固定,石蜡包埋、切片,常规脱蜡、水化,微波抗原修复,使用免疫组化试剂盒检测CRM1、P-p27ser10蛋白表达。显微镜下观察染色情况,每5个视野计数200个细胞,计算阳性细胞所占百分比。CRM1阳性细胞≤10%为低表达,>10%为高表达[7];P-p27ser10阳性细胞≤5%为低表达,>5%为高表达[8]。
1.3抑制p27 S10磷酸化与CRM1表达对SKOV3细胞周期和增殖的影响观察1.3.1 质粒构建与siRNA转染 扩增人类p27 cDNA全长序列,将其重组于pcDNA3.1及pEGFPN1载体,构建野生型p27-EGFP融合蛋白表达质粒。以野生型p27基因真核表达质粒pEGFP/N1-p27(WT)为模板,采用重叠延伸特异位点诱变法构建EGFP标记的突变型p27基因表达载体,一为pEGFP/N1-p27(S10A)(丝氨酸突变为丙氨酸,不能发生磷酸化),二为pEGFP/N1-p27(S10D)(丝氨酸突变为天冬氨酸,为拟磷酸化突变体)。用Lipofectamine 2000分别转染p27(WT)、p27(S10A)、p27 (S10D)质粒进入SKOV3。48 h后,在含G418 500 μg/mL的培养基中进行阳性细胞筛选,获得稳定表达p27(WT)、p27(S10A)、p27(S10D)细胞。扩增引物:p27(S10A)上游引物S10A_F为5′-TAGGTGCCCCGTTAGACACTCG-3′,扩增长度为35 bp;下游引物S10A_R为5′-CGAGTGTCTAACGGGGCACCTA-3′,扩增长度为579 bp;p27(S10D):上游引物S10D_F为5′-TAGGGTCCCCGTTAGACACTCG-3′,扩增长度为35 bp;下游引物S10D_R为5′-CGAGTGTCTAACGGGGACCCTA-3′,扩增长度为579 bp。CRM1 siRNA序列:正义GGCUGCUGAACUCUAUAGA、反义UCUAUAGAGUUCAGCAGCC。分别转染CRM1 siRNA和siRNA对照质粒到p27(S10D)细胞,建立S10D+siCRM1组和S10D+sictrl组,用空载体作为阴性对照。24 h后收集各组细胞进行后续实验。
1.3.2细胞周期检测 取细胞用70%乙醇-20℃固定24 h,冷PBS洗涤;50 μg/mL碘化丙啶(PI)和250 μg/mL核糖核酸酶孵育30 min,过滤,流式细胞仪检测细胞周期分布。
1.3.3细胞增殖检测 采用CCK-8法。取各组细胞,按2×104/mL接种于96孔板;待细胞完全贴壁后,更换为预先配置好的含10%CCK-8试剂的基础培养基,37℃孵育1~2 h;用酶标仪在450 nm波长处检测吸光度OD值,OD值越大,表示细胞增殖能力越强。
1.4统计学方法 采用SPSS15.0统计软件。计量资料以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析;计数资料采用χ2检验及Fisher精确概率法;相关性分析采用Pearson相关性检验。P<0.05为差异有统计学意义。
2 结果
2.1CRM1、P-p27ser10蛋白表达及其与EOC临床病理特征的关系 CRM1和P-p27ser10蛋白主要表达于细胞核内,在胞质中有少量表达。CRM1蛋白高表达49例(76.6%),低表达15例(23.4%);P-p27ser10蛋白高表达41例(64.1%),低表达23例(35.9%)。CRM1及P-p27ser10蛋白表达与临床病理特征的关系见表1。CRM1高表达与肿瘤FIGO分期、组织学分级及淋巴结转移情况有关,P-p27ser10高表达与肿瘤FIGO分期及组织学分级有关(P均<0.05)。
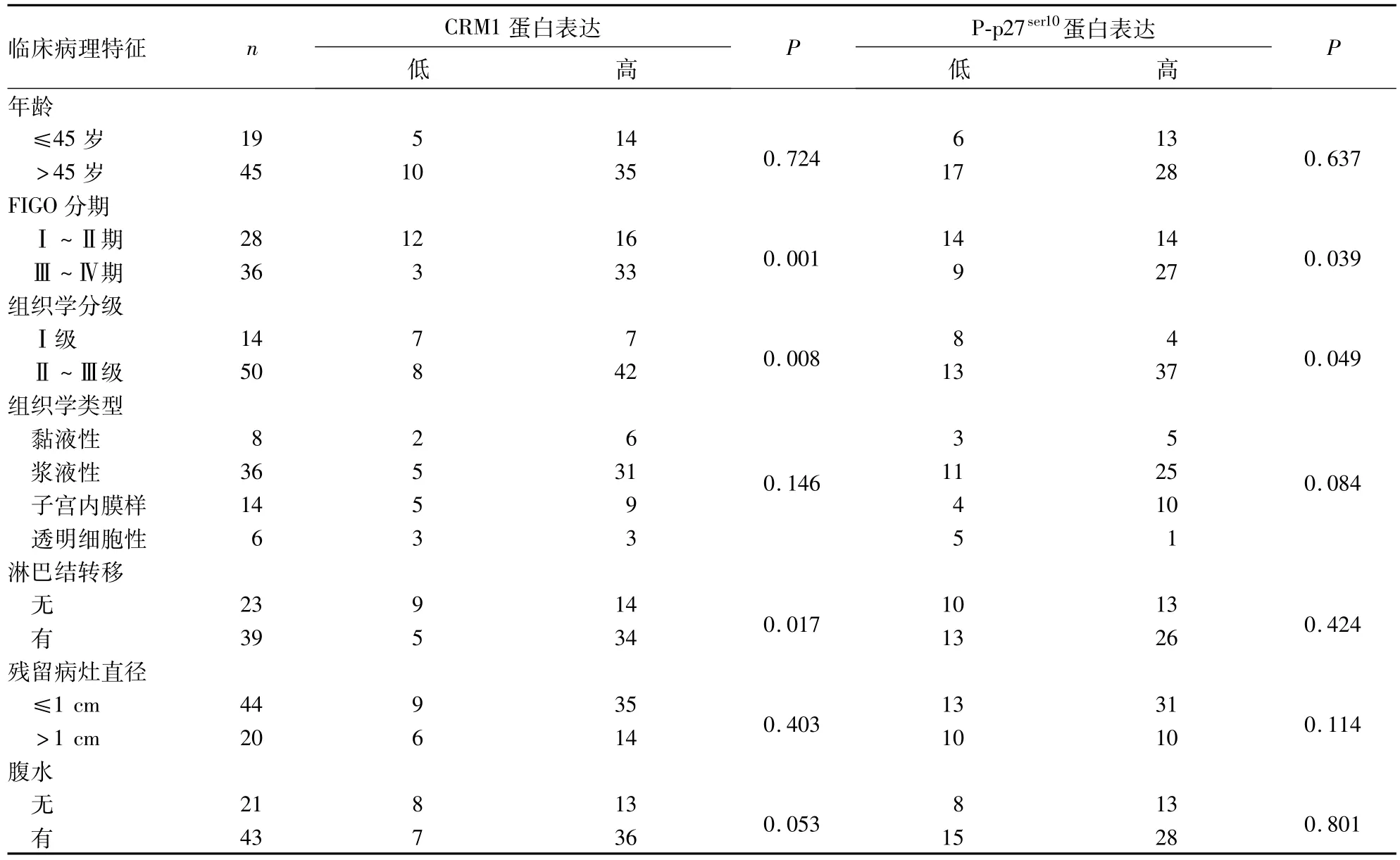
表1 CRM1和P-p27ser10蛋白表达与临床病理特征的关系(例)
2.2CRM1与P-p27ser10表达的相关性 Pearson相关性分析表明,CRM1与P-p27ser10的表达呈正相关(r=0.656,P<0.01)。
2.3抑制p27 S10磷酸化与CRM1表达SKOV3细胞周期和增殖的影响
2.3.1各组G1期和S期细胞所占比例比较 见表2。
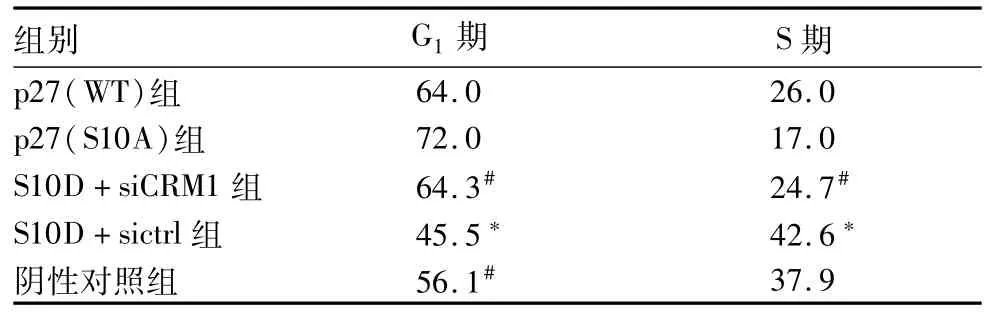
表2 各组G1期和S期细胞所占比例比较(%)
2.3.2各组细胞增殖情况比较 p27(WT)、p27 (S10A)、阴性对照、S10D+siCRM1、S10D+sictrl组培养72 h的OD值分别为0.75±0.15、0.70± 0.10、1.23±0.16、1.32±0.08、1.80±0.21,S10D+sictrl组较其他四组增殖明显加快(P均<0.05),S10D+siCRM1组较S10D+sictrl组增殖明显减慢(P<0.05),p27(WT)和p27(S10A)组较阴性对照组增殖加快(P均<0.05);阴性对照与S10D+si-CRM1组相比差异无统计学意义。
3 讨论
研究表明,大部分肿瘤的发生是由于癌基因和抑癌基因调控的细胞增殖、分化以及细胞周期调控信号的通路改变所造成的。细胞周期抑制因子p27具有调节细胞周期、细胞增殖、凋亡及分化等多种生物学功能,p27相关调控机制异常与许多细胞的恶性转化有关[6,7]。作为细胞周期的“制动”因素,细胞核内p27蛋白的降解速度直接决定其绝对数量[8]。p27翻译后蛋白的调控主要通过蛋白修饰(如磷酸化)来进行[9],这种翻译后蛋白修饰决定了蛋白质的稳定性和亚细胞定位。目前已发现至少三条不同的途径参与p27蛋白的降解,其中最主要的是p27 S10磷酸化位点依赖的p27磷酸化出核-泛素/蛋白酶体途径[10,11],S10磷酸化对于p27和CRM1之间的连接是必不可少的[12]。
研究显示,CRM1参与介导蛋白质和信使RNA的核转运,是一种重要的亚细胞调节因子。很多穿梭于核膜的肿瘤相关蛋白,如肿瘤抑制蛋白和致癌蛋白,均需要CRM1作为核转运分子。研究发现,CRM1与p27的出核转运有关[13],CRM1可以识别磷酸化的p27,从而介导p27的出核降解。CRM1表达升高可促进p27降解,提示CRM1可能通过促进p27的凋亡来控制p27的活性[14,15]。
本研究显示,CRM1和P-p27ser10在EOC组织中呈高表达,CRM1高表达与肿瘤FIGO分期、肿瘤分级及淋巴结转移情况相关,P-p27ser10高表达与肿瘤FIGO分期及组织学分级有关。相关性分析显示,P-p27ser10与CRM1在EOC组织中的表达呈正相关。研究显示,P-p27ser10与CRM1是p27出核转运通路上的关键分子,它们与p27的生物学功能密切相关。本研究构建了p27(WT)、p27(S10A)、p27(S10D)细胞,用空载体作为阴性对照组,观察各组细胞周期及细胞增殖情况。由于只有p27(S10D)拟磷酸化细胞才能发挥类似p27磷酸化的过程,因此我们分别转染CRM1 siRNA和siRNA阴性质粒到p27 (S10D)细胞,结果显示,与p27拟磷酸化组(S10D +sictrl组)比较,p27(S10A)组增殖减慢。沉默CRM1的表达后,p27(S10D)组的细胞周期进程明显减慢,S10D+siCRM1组较S10D+sictrl组细胞增殖明显减慢。表明抑制p27 S10磷酸化和抑制CRM1表达可引起SKOV3细胞周期阻滞,降低癌细胞的增殖能力。CRM1可通过抑制p27 S10磷酸化来影响SKOV3的细胞周期进程及增殖。
综上所述,CRM1相关的p27 S10磷酸化通路可能是导致EOC细胞内p27出核降解的重要机制之一,p27 S10的异常磷酸化和CRM1的表达变化都可能引起细胞周期调控紊乱,最终可能导致癌细胞的恶性增殖及EOC的恶性进展。
参考文献:
[1]Tang L,Wang Y,Strom A,et al.Lapatinib induces p27(Kip1)-dependent G(1)arrest through both transcriptional and post-translational mechanisms[J].Cell Cycle,2013,12(16):2665-2674.
[2]Jakel H,Peschel I,Kunze C,et al.Regulation of p27(Kip1)by mitogen-induced tyrosine phosphorylation[J].Cell Cycle,2012,11(10):1910-1917.
[3]Lee JG,Song JS,Smith RE,et al.Human corneal endothelial cells employ phosphorylation of p27(Kip1)at both Ser10 and Thr187 sites for FGF-2-mediated cell proliferation via PI 3-kinase[J].Invest Ophthalmol Vis Sci,2011,52(11):8216-8223.
[4]Wang Y,Yu YN,Song S,et al.JAB1 and phospho-Ser10 p27 expression profile determine human hepatocellular carcinoma prognosis[J].J Cancer Res Clin Oncol,2014,140(6):969-978.
[5]Turner JG,Sullivan DM.CRM1-mediated nuclear export of proteins and drug resistance in cancer[J].Curr Med Chem,2008,15 (26):2648-2655.
[6]Goode EL,Fridley BL,Vierkant RA,et al.Candidate gene analysis using imputed genotypes:cell cycle single-nucleotide polymorphisms and ovarian cancer risk[J].Cancer Epidemiol Biomarkers Prev,2009,18(3):935-944.
[7]De Siervi A,De Luca P,Byun JS,et al.Transcriptional autoregulation by BRCA1[J].Cancer Res,2010,70(2):532-542.
[8]Polyak K,Lee MH,Erdjument-Bromage H,et al.Cloning of p27Kip1,a cyclin-dependent kinase inhibitor and a potential mediator of extracellular antimitogenic signals[J].Cell,1994,78(1):59-66.
[9]Viglietto G,Motti ML,Fusco A.Understanding p27(kip1)deregulation in cancer:down-regulation or mislocalization[J].Cell Cycle,2002,1(6):394-400.
[10]Zhang W,Bergamaschi D,Jin B,et al.Posttranslational modifications of p27kip1 determine its binding specificity to different cyclins and cyclin-dependent kinases in vivo[J].Blood,2005,105 (9):3691-3698.
[11]Hara T,Kamura T,Nakayama K,et al.Degradation of p27 (Kip1)at the G(0)-G(1)transition mediated by a Skp2-independent ubiquitination pathway[J].J Biol Chem,2001,276 (52):48937-48943.
[12]Lee JG,Kay EP.Two populations of p27 use differential kinetics to phosphorylate Ser-10 and Thr-187 via phosphatidylinositol 3-Kinase in response to fibroblast growth factor-2 stimulation[J].J Biol Chem,2007,282(9):6444-6454.
[13]Yao Y,Dong Y,Lin F,et al.The expression of CRM1 is associated with prognosis in human osteosarcoma[J].Oncol Rep,2009,21(1):229-235.
[14]Besson A,Gurian-West M,Chen X,et al.A pathway in quiescent cells that controls p27Kip1 stability,subcellular localization,and tumor suppression[J].Genes Dev,2006,20(1):47-64.
[15]Escobar-Hoyos LF,Shah R,Roa-Peña L,et al.Keratin-17 Promotes p27KIP1 Nuclear Export and Degradation and Offers Potential Prognostic Utility[J].Cancer Res,2015,75(17):3650-3662.
Expression of CRM1 and P-p27ser10in epithelial ovarian cancer tissues and their influence on proliferation of cancer cells
GAO Feifei1,XUE Kai,WANG You
(1 Shanghai Eighth People Hospital,Shanghai 200235,China)
Abstract:Objective To observe the expression of chromosome region maintenance 1(CRM1)and P-p27ser10in epithelial ovarian cancer(EOC)tissues,and to discuss their influence on the proliferation of EOC SKOV3 cell line.Methods We analyzed the association between the expression of CRM1 and P-p27ser10and clinical-pathological characteristics by using immunohistochemical method in 64 EOC samples.Using p27 wild type[p27(WT)]as the template,we established the p27 dephosphorylated mutants with S10 mutation[p27(S10A)group]and with mimic phosphorylated mutation[p27 (S10D)group].In the p27(S10D)group,SKOV3 were respectively transfected by CRM1-targeted siRNA(S10D+si-CRM1 group)and siRNA negative plasmid(S10D+sictrl group).CCK-8 and flow cytometry were respectively used to detect the proliferation and cell cycle in the p27(WT)group,p27(S10A)group,negative control group,S10D+siCRM1 group and S10D+sictrl group.Results In 64 EOC samples,the high expression rates of P-p27ser10and CRM1 were respectively 76.6%and 64.1%,whose high expression rates were associated with histological grade and clinical stage(all P <0.05),and they were positively correlated with each other(r=0.656,P<0.01).As for cells in the G1/S phase,the percentage of cells in the S10D+sictrl group was significantly lower than that of the p27(S10A)group and the percentage of cells in the S10D+siCRM1 group was significantly higher than that of the S10D+sictrl group(all P<0.05).CCK-8 showed that cell proliferation was significantly faster in the S10D+sictrl group than in the p27 S10A group while the cellbook=2,ebook=7proliferation was significantly slower in the S10D+siCRM1 group than in the S10D+sictrl group(all P<0.05).Conclusions The expression of CRM1 and P-p27ser10was increased in EOC.CRM1 participated in the process of p27 S10 phosphorylated nuclear export degradation.The inhibition of both p27 S10 phosphorylation and CRM1 expression leaded to cell cycle arrest and decreased cell proliferation in EOC.
Key words:ovarian neoplasms;p27 protein;ser10;phosphorylation;chromosome region maintenance 1;cell proliferation
收稿日期:(2015-01-28)
通信作者简介:王酉(1982-),女,主治医师,主要研究方向为妇科肿瘤的基础及临床治疗。E-mail:hanghangwang@hotmail.com
作者简介:第一高菲菲(1981-),女,主治医师,主要研究方向为妇科肿瘤的临床治疗。E-mail:ffhigh@sina.com
基金项目:国家自然科学基金资助项目(81001160;81400161)。
中图分类号:R737.3
文献标志码:A
文章编号:1002-266X(2016)02-0001-04
doi:10.3969/j.issn.1002-266X.2016.02.001
