强精煎对奥硝唑所致少弱精子症大鼠抗氧化作用实验研究*
2016-03-27陆海旺王德胜徐杰新覃智标梁劲松庞秋华崔锦珠
宾 彬,陆海旺,王 杰,王德胜,徐杰新,覃智标,梁劲松,庞秋华,崔锦珠
(广西中医药大学第一附属医院,南宁 530023)
强精煎对奥硝唑所致少弱精子症大鼠抗氧化作用实验研究*
宾 彬,陆海旺△,王 杰,王德胜,徐杰新,覃智标,梁劲松,庞秋华,崔锦珠
(广西中医药大学第一附属医院,南宁 530023)
目的:观察强精煎对奥硝唑(ORN)诱导的少弱精子症大鼠附睾精子氧化应激的保护作用。方法:60只大鼠按随机数字表法分为4组,模型组给予ORN,黄精赞育胶囊组给予ORN+黄精赞育胶囊,强精煎组给予ORN+强精煎,空白组给予生理盐水。测定大鼠附睾精子的浓度、活动率、附睾丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、一氧化氮合酶(NOS)活力以及睾丸附睾超微病理。结果:与空白组比较,模型组精子浓度及活动率、附睾SOD、GSH-Px活力明显降低,MDA浓度及NOS活力显著升高;与模型组比较,强精煎组及黄精赞育胶囊组精子浓度及活动率、SOD及GSH-Px活力升高,MDA、NOS活力降低。模型组生精上皮破损显著、紊乱,精子产量锐减,强精煎组及黄精赞育胶囊组生精上皮受损轻、生精产量接近空白组。结论:强精煎可增强抗氧化酶活性,抑制氧化应激对生精功能和精子活力的不良影响。
抗氧化作用;ROS;少、弱精子症;健脾益肾法;强精煎
活性氧在精子运动及其获能中起重要作用,适量的活性氧可保护精子活力,反之过高的活性氧则造成精子膜的损伤,抑制精子活力,导致精子总活力下降,进而影响精-卵结合,还可损伤精子 DNA,而精子 DNA的改变可以使有缺陷的 DNA传给胎儿[1]。研究表明,活性氧在精子的DNA损伤中扮演重要角色[2]。因此,抗氧化药物在男性不育治疗中的应用在国内外均得到重视[3-4]。本研究通过诱导少弱精子症大鼠,观察强精煎对少弱精子症大鼠附睾精子的抗氧化作用及其对睾丸、附睾上皮病理损伤的保护作用。
1 材料与方法
1.1 主要仪器及试剂
MACRO精子计数板和CFT-9201X型CASA精子分析系统(江苏瑞琪有限公司生产);752型 紫外-可见分光光度计(上海菁华科技仪器有限公司); HR801型酶标仪(深圳华科瑞科技有限公司);扫描电子显微镜,广西医科大学电镜室提供分析服务。
考马斯亮蓝蛋白、NOS、SOD、MDA、GSH-Px等试剂盒,来自南京建成生物工程研究所。
1.2 药物
强精煎组成:菟丝子、枸杞各 20 g,当归、紫河车、神曲各10 g,黄芪、益母草各30 g,党参、续断、鹿角霜各15 g[5],采用单味免煎中药(江阴天江药业有限公司生产);黄精赞育胶囊(由黄精、肉苁蓉、淫羊藿、紫河车、党参、当归、蛇床子、水蛭、牡蛎等组成),上海新亚药业邗江有限公司生产;奥硝唑胶囊,购自四川百利药业有限公司。
1.3 动物来源、分组及给药方案
8~10周龄的60只SD雄性性成熟大鼠,体质量(280±10)g,采购于广西医科大学实验动物中心。按随机数字表法分成4组,分组及给药方法参照本课题组前期实验方法,ORN用量加倍。模型组给予 ORN800 mg/kg,黄精赞育胶囊组给予 ORN (800 mg/kg)+黄精赞育胶囊(400 mg/kg),强精煎组给予ORN(800 mg/kg)+强精煎(10 g/kg),空白组给予生理盐水,试验药物混悬液使用生理盐水配制[5]。各组溶液灌胃体积均为4 mL,每日1次,连续28 d,具体给药剂量根据大鼠每7 d 1次的体质量变化进行适时调整。
1.4 大鼠附睾精子浓度及活力测定
最后1次灌胃24 h后,以10%浓度的Urethane腹腔注射法麻醉大鼠,剪开腹腔,仔细完整地分离一侧附睾尾,迅速置于盛有2 mL 37℃的生理盐水平皿中剪碎,混匀并温浴片刻(30 s左右)[5],待精子充分扩散后,使用精子计数板和CASA检测精子数量,并计算精子活力。
1.5 SOD、MDA、GSH-Px、NOS活力的测定
根据考马斯亮蓝蛋白试剂盒所示方法,取单侧附睾尾用4℃生理盐水在冰水浴中制成10%的附睾组织匀浆,转速3000 r/min离心10 min,收集上清液分批冻存,比色法测定附睾组织蛋白的含量。最后根据试剂盒步骤测定SOD、MDA、NOS、GSH-Px活性。
1.6 超微病理分析
以电镜专用的2.5%戊二醛固定各组大鼠睾丸和附睾尾,4℃冰箱保存过夜、切片。电镜超微扫描观察生精上皮、精子数量等情况。
1.7 统计学方法
采用PEMS3.1统计软件进行分析,计量资料均符合正态分布,以均数±标准差(±s)表示,组间比较采用单因素方差分析多重比较,方差齐以 LSD-t检验,方差不齐用Dunnett’s T3检验,P<0.05为差异有统计学意义。
2 结果
2.1 附睾精子浓度及活力
表1显示,模型组精子浓度、活动率呈现明显下降,与空白组比较差异有统计学意义(P<0.05)。强精煎组与黄精赞育胶囊组精子浓度、活动率接近,优于模型组(P<0.05),与空白组仍有差异(P<0.05)。这表明800 mg/kg剂量ORN不但严重损伤了精子活力,也严重损害睾丸的生精功能,导致精子生成数量显著减少。强精煎及黄精赞育胶囊干预后的大鼠附睾精子数量、活力尽管低于空白组,但仍显著高于模型组。由此可见,强精煎能修复ORN氧化应激诱导的生精损伤,保护生精功能,提高精子活力。
表1 强精煎对大鼠精子浓度、活力的影响(±s)

表1 强精煎对大鼠精子浓度、活力的影响(±s)
注:与模型组比较:△P<0.05;与空白组比较:*P<0.05
组别 鼠数 精子浓度(×106/ml) 活动率(%) 15 54.67±6.31 71.03±6.23模 型 组 15 10.60±2.64* 10.65±1.27*黄精赞育胶囊组 15 36.93±4.02 49.42±4.66强 精 煎 组 15 37.47±2.97*△ 50.31±5.90空白组*△
2.2 附睾匀浆MDA、SOD、GSH-Px、NOS活力
表2显示,与其余各组比较,模型组大鼠附睾NOS活力、丙二醛浓度升高(P<0.05)。黄精赞育胶囊组、强精煎组丙二醛浓度接近,与模型组、空白组比较差异有统计学意义(P<0.05)。模型组超氧化物歧化酶、GSH-Px活力明显下降,显著低于空白组(P<0.05)。黄精赞育胶囊组、强精煎组超氧化物歧化酶、GSH-Px活力均显著优于模型组(P<0.05),但仍不及空白组(P<0.05),说明强精煎增强了大鼠附睾内抗氧化酶的活性,清除活性氧,抑制过度的氧化应激,与本课题前期研究结论一致[5]。
表2 强精煎对大鼠附睾MDA、SOD、GSH-Px、NOS活力的影响(±s)
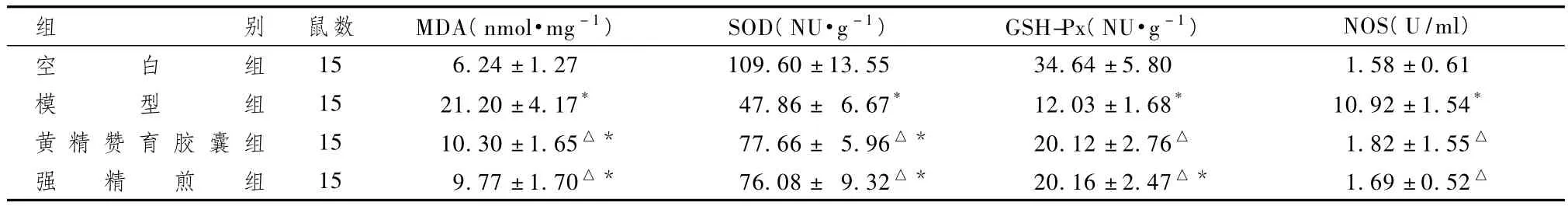
表2 强精煎对大鼠附睾MDA、SOD、GSH-Px、NOS活力的影响(±s)
注:与模型组比较:△P<0.05;与空白组比较:*P<0.05
组别 鼠数 MDA(nmol·mg-1) SOD(NU·g-1) GSH-Px(NU·g-1) NOS(U/ml)空 白 组 15 6.24±1.27 109.60±13.55 34.64±5.80 1.58±0.61模 型 组 15 21.20±4.17* 47.86± 6.67* 12.03±1.68* 10.92±1.54*黄 精 赞 育 胶 囊 组 15 10.30±1.65△* 77.66± 5.96△* 20.12±2.76△ 1.82±1.55△强 精 煎 组 15 9.77±1.70△* 76.08± 9.32△* 20.16±2.47△* 1.69±0.52△
2.3 睾丸附睾超微病理
在强精煎组、黄精赞育胶囊组,生精上皮排列紧密,附睾上皮较为完整,生精活跃,与空白组尚存在一定差距(图1、3、4);而模型组生精小管间隙增宽分离、空虚,生精上皮受损严重,层次大部分缺失,精子数量显著少于其余各组(图2),比既往研究显示出更为显著的病理损伤[5]。
3 讨论
ORN是常用的第三代硝基咪唑类药物的衍生物。有学者研究发现,大剂量奥硝唑对雄性生育力有较强的毒性作用,当剂量达到800 mg/(kg·d)时,可导致大鼠睾丸质量显著减轻,精子细胞明显减少,生精细胞大片脱落,精子日产量也显著减少[6]。因此本实验使用该药持续灌胃诱导出少弱精子症大鼠模型。
ROS主要包括过氧化氢、O2-、OH-、一氧化氮等自由基,可危及细胞功能及存活。活性氧必须不停地被灭活,睾丸附睾中仅需保持一定的浓度且可受控制的活性氧以维持精子的生理功能。在生殖系统中,抗氧化系统主要由超氧化物歧化酶、谷胱甘肽过氧化酶以及其他血红素蛋白过氧化物酶等构成[5]。其中,超氧化物歧化酶能清除O2-尤为重要,能抵抗 ROS对精子产生的毒性,从而维持机体氧化-抗氧化系统平衡,SOD还与精子数量呈正相关[7]。谷胱甘肽过氧化酶主要是清除过氧化氢,保护细胞膜结构和功能,若酶保护系统中某部分被削弱,该系统则会失效并引发永久的细胞损伤[5-8]。
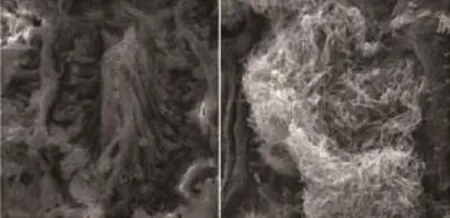
图1 空白组
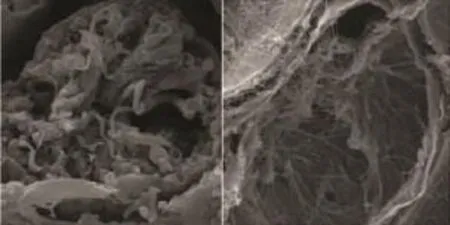
图2 模型组

图3 黄精赞育胶囊组
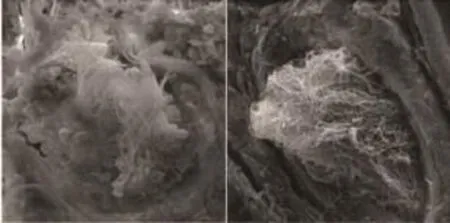
图4 强精煎组
精子质膜中有多聚不饱和脂肪酸(PUFA)大量存在,其对过量ROS引起的损伤极其敏感,而存在于精子胞质内的ROS清除酶数量有限,其补充来源于精浆,从而维持自身的抗氧化系统。精子质膜的流动性较为脆弱,能被生殖道内过量的活性氧所破坏,导致精子发生障碍,并对精子产生毒副作用。过高的活性氧引起精子膜发生脂质过氧化反应,继而产生脂质过氧化及其降解产物,如丙二醛可使精子外观结构、功能及代谢异常,从而导致男性生育力受损[9-11]。过高的活性氧破坏精子DNA完整性,引起精子形态异常,并形成恶性循环[11]。丙二醛是氧化应激反应程度的标志物,是衡量体内自由基产生程度的可靠指标[5]。而一氧化氮合酶活性增强诱导NO生成增多,过量的NO可引起精子结构改变,损伤精子活动能力。
笔者前期临床研究表明,强精煎可显著改善少弱精子症患者的精子数量和活力,且有良好的安全性[13]。本研究中,强精煎组超氧化物歧化酶、谷胱甘肽过氧化物酶活力明显优于奥硝唑模型组,而一氧化氮合成酶活力、丙二醛浓度显著低于模型组;生精上皮较为完整,精子数量与活力均优于奥硝唑模型组,可见强精煎中药可增强生殖系统的抗氧化酶活性,拮抗氧化损伤,维持精子发生,提高精子活力。方中菟丝子、枸杞为子类药物填补肾精,党参、黄芪补气健脾,当归补血活血,牡蛎固精涩精,益母草活血清热利湿,全方具有健脾补肾、清热利湿兼活血之功。药理实验表明,枸杞的有效成分枸杞多糖(LBP)能提高大鼠超氧化物歧化酶活性[14],LBP还可抑制过氧化氢诱导的睾丸生精细胞病理损伤[15-16];菟丝子有效成分能增强精子悬液中超氧化物歧化酶活力,降低丙二醛浓度[17];党参多糖可显著降低大鼠Leydig细胞的丙二醛含量,增强谷胱甘肽过氧化物酶的活力[18];五味子的活性成分既能增强抗氧化酶活性,又可清除氧自由基;紫河车多种酶有较强的抗氧化作用;黄芪原液体外添加于人类精子可提高其活力和活动率[19];鹿茸、当归、续断的有效成分也具有抗氧化应激作用[20-21]。
综上所述,强精煎能降低附睾丙二醛、一氧化氮合成酶含量,提高超氧化物歧化酶、谷胱甘肽过氧化物酶等活力,使得生殖系统免受氧化应激损伤,维持抗氧化酶系统,修复睾丸及附睾病理损伤,促进精子发生,为中医药抗氧化治疗少弱精子症提供了新的方法。其不足之处在于对ORN的睾丸毒性研究尚未涉及,对中药强精煎修复生精上皮、提高精子活力的相关分子生物学机制也有待进一步的研究。
[1] 戴继灿.男性不育的辅助生殖技术处理:潜在风险与思考[J].中华男科学杂志,2011,5:387-390.
[2] F.Khosravi,M.R.Valojerdi,M.Amanlou,L.Karimian,F.Abolhassani.Relationship of seminal reactive nitrogen and oxygen species and total antioxidant capacity with sperm DNA fragmentation in infertile couples with normal and abnormal sperm parameters[J].Andrologia,2014,46(1):17-23.
[3] Golbidi S,Laher I.Antioxidant therapy in human endocrinedisorders[J].Medical Science Monitor:International Medical Journal of Experimental and Clinical Research,2010,16(1): RA9-24.
[4] 王亚轩,杨书文,瞿长宝,等.左旋肉碱治疗弱精子症患者的疗效观察[J].中华男科学杂志,2010,16(5):420-422.
[5] 宾彬,陆海旺,王德胜,等.强精煎对实验大鼠附睾精子抗氧化作用的研究[J].时珍国医国药,2013,24(5):1056-1058.
[6] 熊芬,李高,庞雪冰,等.奥硝唑对雄性大鼠生育功能的影响[J].生殖与避孕,2006,26(2):81-85.
[7] Murarka Shivaa,Anil K.Gautama,Yogendra Vermaa,et al.Association between sperm quality,oxidative stress,and seminal antioxidant activity[J].Clinical Biochemistry,2011,44(4): 319-324.
[8] 黄宇烽,潘连军,黄卫东.男科医师手册[M].北京:人民卫生出版社,2009:104.
[9] Michno Anna, Raszeja-Specht Anna, Jankowska-Kulawy Agnieszka,et al.Effect of L-carnitine on acetyl-CoA content and activity of blood platelets in healthy and diabetic persons[J].Clinical chemistry,2005,51(9):1673-1682.
[10] 李铮,陈国武,商学军,等.左旋肉碱和乙酰左旋肉碱合用治疗少弱精子症有效性与安全性的多中心随机对照临床研究[J].中华男科学杂志,2005,11(10):761-764.
[11] 陈俊清,罗胜萍,黄诚刚.精浆活性氧水平与男性不育的相关性研究[J].国际检验医学杂志,2011,32(9):1002-1004.
[12] Hauser R,Meeker JD,Singh NP,et al.DNA damage in human sperm is related to urinary levels of phthalate monoester and oxidative metabolites[J].Human reproduction (Oxford,England),2007,22(3):688-695.
[13] 宾彬,王杰,陈定雄,等.强精煎治疗少弱精子症临床疗效及安全性研究[J].西部中医药,2012,25(4):5-7.
[14] 黄晓兰,杨明亮,吴晓旻,等.枸杞多糖对大鼠生殖系统保护作用的机制探讨[J].武汉大学学报:医学版,2004,25(1): 29-31.
[15] 黄晓兰,闫俊,吴晓旻,等.枸杞多糖对H2O2诱导的小鼠生殖细胞损伤的影响[J].食品科学,2003,24(12):116-118.
[16] 黄晓兰,杨明亮,吴晓旻,等.枸杞多糖对小鼠睾丸细胞DNA损伤的保护作用[J].卫生研究,2003,32(6):599-601.
[17] 杨欣,丁彩飞,张永华,等.菟丝子水提物对人精子膜结构和功能氧化损伤的干预作用[J].中国药学杂志,2006,41(7): 515-518.
[18] 徐斯凡,王丽蕃,赵莹,等.藏党参多糖对睾丸间质细胞抗氧化作用研究[J].时珍国医国药,2012,23(7):1593-1595.
[19] 王本祥.现代中药药理与临床[M].天津:天津科技翻译出版公司,2004:6.
[20] 贾敏,杨铁虹,姚秀娟,等.当归多糖硫酸酯的抗氧化作用研究[J].中药材,2007,30(2):185-188.
[21] 黄春林,朱晓新.中药药理与临床手册[M].北京:人民卫生出版社,2006:653.
Experimental Study of Qiang Jing Jian's Anti Oxidative Effects of the Rats with Little Weak Sperm Induced by Ornidazole
BIN Bin,LU Hai-wang,WANG Jie,WANG De-sheng,XU Jie-xin,QIN Zhi-biao,LIANG Jing-song,PANG Qiu-hua,CUI Jin-zhu
(The First Affiliated Hospital of Guangxi University of Chinese Medicine,Guangxi,Nanning 530023,China)
Objective:To study the antioxidant effect of Qiang Jing Decoction on epididymis sperms of rats with Ornidazole-Induced oligoasthenozoospermia.Method:60 rats were divided into 4 groups randomly.the model group were given ORN;rats in the Huangjing Zanyu Capsule group were given ORN and Huangjing Zanyu Capsule;rats in the Qiang Jing Decoction group were given ORN Qiang Jing Decoction granule;the blank group were given saline;the concentration and motility of rats’sperms and the epididymis homogenate activity of MDA,SOD,GSH-PX,and NOS as well as the ultrastructure changes of testis and epididymis were detected.Results:Compared to the blank group,the quantity and motility of rats’sperms and the activity of SOD and GSH-PX in model group were reduced significantly,the content of MDA and NOS were highly rose,In Qiang Jing Decoction group and Huangjing Zanyu Capsule group,the sperms quantity and motility and the activity of SOD and GSH-PX were reduced,but significantly higher than model group,while the activity of MDA and NOS significantly lower than the model group.The testis seminiferous epithelial were destroyed and the level structure showed incompletely and the sperm production were decreased.in the model group,while in Qiang Jing Decoction group and Huangjing zanyu Capsule group,the seminiferous epithelial were more completely and the sperm production was approached to the blank group.Conclusion:the Qiang Jing Decoction can enhance the activity of antioxidant enzymes,restraining oxidative stress injury and protecting the spermatogenic function.
Antioxidant;ROS;Oligoasthenozoospermia;Invigorating spleen and kidney;Qiang Jing Decoction
R285.5
:B
:1006-3250(2016)04-0484-04
2015-08-06
国家自然科学基金资助项目(81060297)-健脾益肾法对少、弱精子症大鼠的抗氧化作用及其调控机制的研究
宾 彬(1964-),男,广西平南人,教授,医学学士,从事男科学与生殖医学的临床与研究。
△通讯作者:陆海旺(1986-),男(壮族),广西南宁人,住院医师,医学硕士,从事男科疾病的中医药临床与研究,Tel: 15977462577,E-mail:haivang@163.com。
