基于NLRP3炎性体信号通路研究桂枝芍药知母汤对尿酸钠诱导大鼠巨噬细胞炎性信号表达的影响*
2016-03-27房树标王永辉李艳彦
房树标,王永辉,李艳彦,周 然△
(1.湖北中医药大学基础医学院,武汉 430065;2.山西中医学院,太原 030024)
基于NLRP3炎性体信号通路研究桂枝芍药知母汤对尿酸钠诱导大鼠巨噬细胞炎性信号表达的影响*
房树标1,2,王永辉2,李艳彦2,周 然2△
(1.湖北中医药大学基础医学院,武汉 430065;2.山西中医学院,太原 030024)
目的:基于NLRP3炎性体(NACHT-LRR-PYD-containing proteins 3 inflammasome)信号通路观察桂枝芍药知母汤(GD)对尿酸钠诱导的大鼠巨噬细胞炎性信号表达的影响,以期探明其抗炎作用机制。方法:大鼠30只按体质量随机分为5组各6只,GD高、中、低剂量组(4、8、16 g·kg-1)、秋水仙碱阳性对照组(3×10-4g·kg-1)均灌胃给药,正常组给予等容积蒸馏水,每天1次,连续给药7 d,最后1次灌胃1 h后所有大鼠乙醚麻醉取血清备用。SD雄性大鼠20只,参照文献方法提取分离大鼠巨噬细胞接种培养12 h。细胞试验分为2个实验组(不加受体抑制剂,加NALP3受体抑制剂),每个实验组均含6个组,正常对照组加入正常大鼠血清,模型对照组、高、中、低剂量组、秋水仙碱组全部滴加200 μg·L-1的尿酸钠混悬液造模,同时滴加含药血清置于 CO2细胞培养箱中孵育 2 h取出。酶联免疫吸附实验(ELISA)法测定炎性因子白介素-1β(interleukin-1 beta,IL-1β)、白介素-6 (interleukin-6,IL-6)、肿瘤坏死因子-α(tumornecrosisfactor-a,TNF-α)的表达,DNA-蛋白质互作ELISA(DPI-ELISA)方法检测核因子-KB(nuclear factor-kappa B,NF-KB)活性;Western免疫印迹(WesternBlot)检测凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)、半胱天冬酶-12(Csapase-12)信号衔接蛋白表达水平;逆转录 PCR(reverse transcription-PCR,RTPCR)观测NLRP3炎性体mRNA的表达。结果:细胞造模12 h后与正常组比较,实验模型组大鼠巨噬细胞IL-1β、IL-6、TNF-α、NFKB、ASC、NALP3 mRNA表达水平明显升高,Csapase-12表达水平明显降低;与模型组比较,给药各组 IL-1β、IL-6、TNF-α、NALP3 mRNA及GD中、高剂量组NF-KB、ASC表达均明显降低,GD高剂量组Csapase-12表达明显升高,而秋水仙碱组Csapase-12表达无明显增加。结论:GD抗炎作用机制可能与降低巨噬细胞NLRP3、ASC表达、抑制IL-1β分化成熟及NF-KB活化、降低NLRP3炎性体信号通路炎性因子表达有关。与秋水仙碱不同的是,GD能够增加Capase-12表达,负反馈抑制NLRP3炎性体信号通路炎性因子表达,提示GD治疗GA新的抗炎机制。在加入NALP3受体抑制剂下,GD仍能降低模型大鼠巨噬细胞中TNF-α、NF-KB表达,提示GD可以通过另外信号通路发挥抗炎作用。
桂枝芍药知母汤;巨噬细胞;NLRP3炎性体;信号通路
近年来,痛风性关节炎(gouty arthritis GA)在我国的发病率明显升高,严重影响着人们的工作及身心健康。治疗GA常规用药非甾类抗炎药、秋水仙碱、糖皮质激素有严格的禁忌症和明显的毒副作用。因此,从中医学中发掘疗效确切、副作用少的GA治疗方药具有重要医学价值和社会意义。桂枝芍药知母汤(GD)出自《金匮要略·中风历节病脉证并治》,具有祛风除湿、温经散寒、滋阴清热之功效。主治风寒湿痹日久,渐次化热伤阴之风湿历节,非常切合GA的病因病机,在临床治疗GA取得很好的疗效。研究[1-2]发现,桂枝芍药知母汤(GD)具有较好抗炎、镇痛等作用,能有效控制痛风性关节炎的症状,但其具体作用机制尚不明确。本课题组拟以尿酸钠诱导大鼠巨噬细胞为模型,观察GD对模型大鼠巨噬细胞 NALP3炎性体 mRNA以及炎性因子TNF-α、IL-1β等表达的影响,以进一步探明 GD的药效作用机制,为GD治疗GA的临床应用及新药开发提供理论和实验依据。
1 材料
1.1 药品
桂枝芍药知母汤煎剂组成:桂枝12 g,白芍9 g,甘草6 g,麻黄6 g,生姜15 g,白术15 g,知母12 g,防风12 g,炮附子12 g。药材购自湖北金药堂大药房有限公司,经湖北中医药大学药学院陈科力教授鉴定,均符合2010版药典要求。原方参照传统水煮工艺加工成煎剂,浓缩成浓度为1.25~1.30(80℃)的浸膏约40 ml,相当于含生药2 g·mL-1,给药前可根据需要适当稀释。秋水仙碱由西双版纳药业有限责任公司生产(批号140706)。
1.2 动物
健康雄性SPF级SD大鼠50只,体质量180~200 g,购自湖北省实验动物研究中心(合格证号SCXK(鄂)2008-0005),试验前适应性饲养7 d。
1.3 试剂
尿酸钠(MSU)(上海谷研生物科技有限公司,批号6519R416),取MSU 0.1 g研成细粉,加生理盐水适量研磨,并稀释至500.0 ml,配制成浓度为200 mg·L-1的尿酸钠混悬液;细胞核蛋白提取试剂盒(碧云天生物技术有限公司,批号 P0027);基于dsDNA修饰微孔板类 ELISA试剂盒(Abnova,96T,批号0465441);细胞RIPA裂解液(P1003B,碧云天生物技术有限公司);cooktail蛋白酶抑制剂(ROCHE,批 号 04693132001);异 甘 草 素Isoliquiritigenin(东京化成工业株式会社,批号10082);DMEM培养基(低糖)500ML(HyClone,批号NZL1272);胎牛血清100ML(浙江天杭生物科技股份有限公司,四季青,批号150119);0.4%台盼蓝染色液;瑞氏-吉姆萨染色液(百奥斯生物科技有限公司);大鼠外周血淋巴细胞分离液 KIT200ML(天津市灏洋生物制品科技有限责任公司,批号LTS1083);磷酸缓冲盐溶液(Pbs,自配),二抗试剂盒(Dako REALTM EnVision TM Detection System,Peroxidase/DAB+,Rabbit/MouseCode K5007);正常山羊血清(武汉博士德,批号AR1009);兔抗大鼠ASC、Csapase-1亚型抗体(一抗:武汉博士德生物工程有限公司)、羊抗兔酶标抗体(二抗,武汉科瑞生物技术有限公司);大鼠 beta-actin抗体(天津三箭,批号KM9001);化学发光试剂ECL(碧云天生物有限公司,批号 P0018);BCA蛋白定量试剂盒(艾德来,批号PP0102);PageRuler prestained protein ladder (Thermo,批号 26616);硝酸纤维素膜(PVDF膜) (Millipore,IPVH00010);曝光胶片(Kodak,XBT-1);显影定影液(Kodak,批号6610190);其他ELISA检测试剂盒(购于武汉博士德);焦碳酸二乙酯 DEPC (美国Amresco,E174);TRIzol®试剂(Invitrogen,批号15596026);逆转录酶 (fermentas,批号EP0442);引物dNTP(fermentas,批号R0191);RNA酶抑制剂(fermentas,E00381);快速定量PCR试剂盒(KAPA,KK4605);TBS、柠檬酸、盐酸酒精等试剂(湖北百奥斯生物科技有限公司配制)。
1.4 仪器
RT6100酶标仪(美国雷杜),PRO200匀浆器(美国),低温高速离心机(美国 Beckman Coulter公司);迷你电泳槽 DYZC-24DN(北京六一);超净工作台(YJ-875型,苏州净化设备厂);二氧化碳培养箱(MCO-15A型,日本三洋公司);倒置显微镜(CX-31型,日本奥林巴斯公司);电子分析天平(HR-120型,德国塞多利斯公司);细胞培养板(40106,Cyagen Biosciences Inc);低速台式离心机(TDL-50B型,上海安亭科学仪器厂);电泳仪(041BR126007型,BIO-RAO);低温离心机(Til-16G型 上海安亭科学仪器厂);Real time-PCR仪(ABI stepone plus)。
2 方法
2.1 含药血清制备
取健康雄性SD大鼠30只,按随机数字表法分为正常对照组、桂枝芍药知母汤高、中、低剂量组、秋水仙碱对照组(均用正常大鼠给药)5组。各组灌胃给予相应药物溶液,正常对照组灌胃给予纯水,桂枝芍药知母汤低、中、高剂量组用药剂量(相当生药)分别为4、8、16 g·kg-1,秋水仙碱对照组用药剂量为3×10-4g·kg-1,连续给药7 d。各组试验动物最后1次灌胃1 h后乙醚麻醉,无菌条件下腹主动脉取血,静置2 h以上,1500 r·min-1,离心15 min后取血清,56℃,30 min灭活、分装,-20℃冰箱保存备用。
2.2 大鼠巨噬细胞分离、培养及给药
健康SD雄性大鼠20只,参照文献[3]方法提取分离大鼠巨噬细胞,孵育12 h后换液以去掉少数未贴壁细胞。将细胞消化后均匀分组接种在6孔板(用于免疫印迹 Westblot和 RT-PCR检测)和24孔板(用于ELISA检测)内,细胞浓度分别为1.2×106·mL-1和1.0×105·mL-1。细胞试验分为2个实验组(不加受体抑制剂,全部加10 μl NALP3受体抑制剂-异甘草素10 μg·mL-1),每个实验组均含6个组(正常对照组、模型对照组、高剂量组、中剂量组、低剂量组、秋水仙碱组),每组平行4孔,除正常对照组加入正常大鼠血清外,其余组全部滴加200 mg· L-1的尿酸钠混悬液造模,同时滴加含药血清及细胞培养液,置于CO2细胞培养箱中(37℃、湿度100%、体积分数5%CO2)孵育2 h后取出培养板备测。
2.3 巨噬细胞 IL-1β、IL-6、TNF-α、NF-KB活性表达
各组细胞取上清液,按ELISA法检测试剂盒操作说明书绘制标准曲线,测定IL-1β、IL-6、TNF-α;用细胞核蛋白提取试剂盒提取各组细胞核蛋白,参照DPI-ELISA检测试剂盒操作说明书检测 NF-KB活性。
2.4 巨噬细胞中ASC、Csapase-12蛋白表达
取适量裂解液,在使用前数分钟内按1 ml裂解液中加10 ul蛋白酶 cocktail。各组细胞倒掉培养液,加入4℃预冷的 PBS,平放轻轻摇动洗涤细胞,然后弃去PBS洗涤2次。将培养皿置于冰上,向培养皿内加入4℃预冷的细胞RIPA裂解液150 μL,再用手指轻弹以充分裂解细胞。冰上孵育15 min,中间摇动培养皿3次,移液管吸取溶解产物至预冷的微量离心管内,4℃、12000 r·min-1离心5 min。小心吸取上清液至冷冻管,移入-20℃低温冰箱中保存,用于免疫印迹 Westblot检测。显色条带以 Quantity One 4.62版凝胶光密度分析软件进行分析,测定各组IOD。
2.5 巨噬细胞中NALP3 mRNA的表达
参照文献方法提取细胞总RNA,检测 RNA纯度及完整性,制备c DNA,-20℃保存。
表1显示,RT-PCR反应:引物由 primer5.0软件设计,并由英俊公司合成。引物的配制:将引物瞬时离心,粉末沉到管底。按照说明书加入去离子水加盖混匀,配成100 uM/L的贮存液;另取EP管,将上、下游引物稀释为10.0 uM/L终浓度的工作液; cDNA的配置:将cDNA从冰箱中取出,加入适量的去离子水稀释至合适的浓度;反应条件:95℃ 3min,95℃ 3 s,目的基因退火温度30 s,40个循环,72℃30 s,72℃ 10 min,4℃ 保存,结果处理采用2-ΔΔCT法进行分析。

表1 引物序列及产物大小
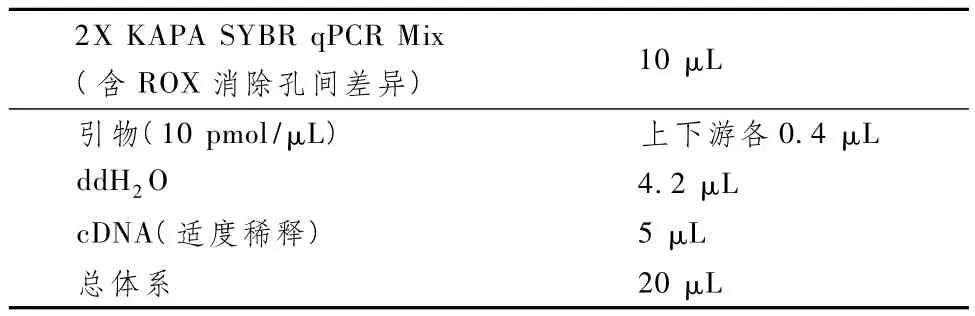
表2 反应体系
2.6 统计学方法
采用SPSS 13.0统计软件进行统计分析,所有数据以均数 ±标准差(±s)表示,组间比较采用LDS单因素方差分析,多组间比较采用方差分析,P<0.05为差异有统计学意义。
3 结果
3.1 一般状况观察
鉴于细胞受体及信号衔接蛋白表达在炎性因子表达之前,故采用炎性因子IL-1β、TNF-α、IL-6、NFKB的表达值作为细胞造模指标。预先配制 500、300、200、100、50 mg·L-1浓度的尿酸钠混悬液,分别取2、4、8、12、24 h 5个时间段摸索尿酸钠诱导大鼠巨噬细胞造模。结果发现,200 mg·L-1的尿酸钠酸混悬液造模2 h后,除空白组外其余5组细胞均出现IL-1β、TNF-α、IL-6、NF-KB表达升高,差异有统计学意义(P<0.05),表明尿酸钠诱导大鼠巨噬细胞造模成功。
3.2 GD含药血清对大鼠巨噬细胞 IL-1β、IL-6、TNF-α、NF-KB表达的影响
表3、4显示,2个实验组与正常组比较,模型组大鼠巨噬细胞中IL-1β、IL-6、TNF-α、NF-KB表达水平明显升高(P<0.05);与模型组比较,给药各组IL-1β、IL-6、TNF-α及GD高、中剂量组NF-KB表达均明显降低(P<0.05),NALP3受体抑制剂明显减少了各组巨噬细胞 IL-1β的表达,但对 TNF-α、NFKB活性无明显影响。
表3 GD含药血清对大鼠巨噬细胞IL-1β、IL-6、TNF-α、NF-KB表达的影响(±s)

表3 GD含药血清对大鼠巨噬细胞IL-1β、IL-6、TNF-α、NF-KB表达的影响(±s)
注:与正常组比较:1)P<0.05;与模型组比较:2)P<0.05,(表4~6同)
组别/不加受体抑制剂 鼠数 剂量/g·kg-1活性正 常 对 照 组 10 — 126.27±1.762) 0.97±0.042) 358.23±43.482) 0.258±0.0052)IL-1β /ng·L-1IL-6 /μg·L-1TNF-α /ng·L-1 NF-KB模 型 对 照 组 10 — 356.98±2.151) 1.84±0.031) 625.81±21.031) 0.314±0.0051)GD 低 剂 量 组 10 4 333.00±3.65 1.79±0.08 487.53±32.832) 0.303±0.003 GD 中 剂 量 组 10 8 281.30±3.412) 1.73±0.14 454.89±35.082) 0.295±0.001 GD 高 剂 量 组 10 16 270.62±1.572) 1.58±0.062) 452.47±20.302) 0.286±0.0052)秋 水 仙 碱 组 10 3×10-4 262.78±3.712) 1.71±0.012) 394.81±30.152) 0.278±0.0032)
表4 GD含药血清对大鼠巨噬细胞IL-1β、IL-6、TNF-α、NF-KB表达的影响(±s)

表4 GD含药血清对大鼠巨噬细胞IL-1β、IL-6、TNF-α、NF-KB表达的影响(±s)
组别/加NALP3抑制剂 鼠数 剂量/g·kg-1活性正 常 对 照 组 10 — 115.83± 1.602) 0.95±0.072) 386.14±39.712) 0.261±0.0022)IL-1β /ng·L-1IL-6 /μg·L-1TNF-α /ng·L-1 NF-KB模 型 对 照 组 10 — 249.22± 7.421) 1.84±0.021) 587.47±27.631) 0.308±0.0041)GD 低 剂 量 组 10 4 191.02± 2.752) 1.73±0.07 512.86±33.452) 0.300±0.002 GD 中 剂 量 组 10 8 186.06± 1.982) 1.54±0.072) 498.94±26.352) 0.296±0.0052)GD 高 剂 量 组 10 16 160.83±10.742) 1.40±0.102) 511.23±20.622) 0.287±0.0042)2)秋 水 仙 碱 组 10 3×10-4 154.72±13.112) 1.84±0.09 455.36±19.312) 0.280±0.0012)2)
3.3 GD含药血清对大鼠巨噬细胞中 ASC、Csapase-12蛋白表达的影响
图1表5显示,2个实验组与正常组比较,模型组大鼠巨噬细胞中 ASC表达水平明显升高,Csapase-12表达水平明显降低(P<0.05)。与模型组比较,秋水仙碱组及GD高、中剂量组ASC表达均明显降低(P<0.05),GD高剂量组Csapase-12表达明显升高(P<0.05),而秋水仙碱组 Csapase-12表达无明显增加(P>0.05)。
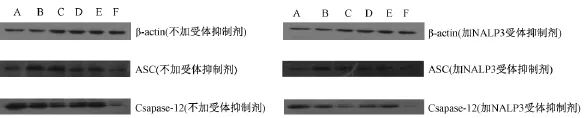
图1 大鼠巨噬细胞中ASC、Csapase-12蛋白Westblot电泳条带
表5 GD含药血清对大鼠巨噬细胞中ASC、Csapase-12蛋白表达的影响(±s)
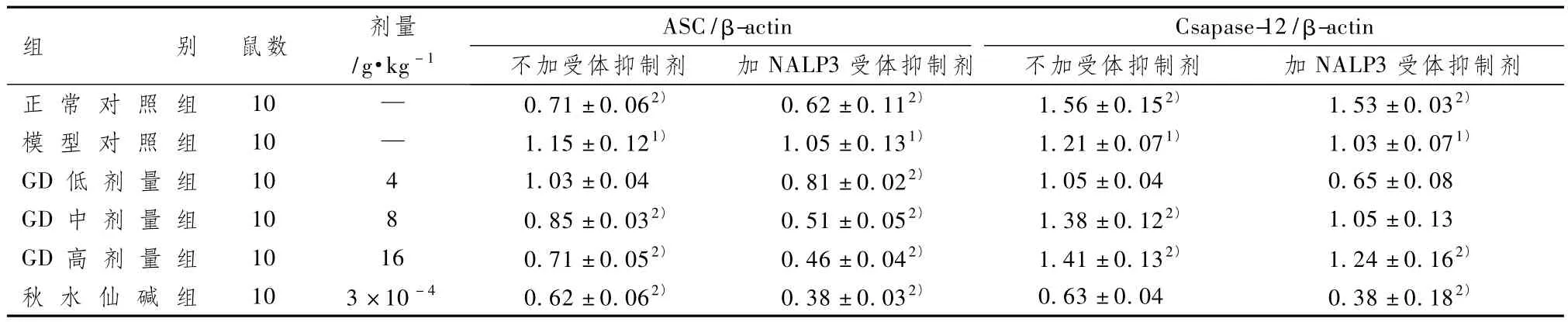
表5 GD含药血清对大鼠巨噬细胞中ASC、Csapase-12蛋白表达的影响(±s)
组ASC/β-actin Csapase-12/β受体抑制剂正 常 对 照 组 10 — 0.71±0.062) 0.62±0.112) 1.56±0.152) 1.53±0.032)别 鼠数 剂量/g·kg-1-actin不加受体抑制剂 加NALP3受体抑制剂 不加受体抑制剂 加NALP3模 型 对 照 组 10 — 1.15±0.121) 1.05±0.131) 1.21±0.071) 1.03±0.071)GD 低 剂 量 组 10 4 1.03±0.04 0.81±0.022) 1.05±0.04 0.65±0.08 GD 中 剂 量 组 10 8 0.85±0.032) 0.51±0.052) 1.38±0.122) 1.05±0.13 GD 高 剂 量 组 10 16 0.71±0.052) 0.46±0.042) 1.41±0.132) 1.24±0.162)秋 水 仙 碱 组 10 3×10-4 0.62±0.062) 0.38±0.032) 0.63±0.04 0.38±0.182)
3.4 GD含药血清对大鼠巨噬细胞中巨噬细胞中NALP3 mRNA表达的影响
表6显示,2个实验组与正常组比较,模型组大鼠巨噬细胞中NALP3 mRNA的表达水平明显升高(P<0.05);与模型组比较,给药各组NALP3 mRNA的表达均明显降低(P<0.05),NALP3受体抑制剂明显抑制各组巨噬细胞的NALP3 mRNA表达。
4 讨论
“NLRP3炎性体信号通路”中 NLRP3是 NOD样受体之一NLRP蛋白家族中的一个典型代表,是固有免疫系统识别病原体的一类重要感受器,广泛参与对病原相关分子模式 (pathogen-associated molecular patterns,PAMP)的识别,同时也可以感知内源性损伤相关的分子模式(damage associatedmolecular patterns,DAMPs),引起相应的炎症反应[4]。当NLRP3识别的配体直接或间接地结合于亮氨酸重复序列 (leucine-richrepeat,LRR)时,NLRP3被活化且构象发生变化,暴露出核苷酸结合寡聚化结构域 (nucleotide binding oligomerization domain,NOD),亦称NACHT结构域,并通过 ATP聚合形成高度有序的 NLRP3蛋白寡聚体。随后通过其效应结构域 PYD募集凋亡相关斑点样蛋白ASC和带有半胱天冬酶活化募集结构域(caspase activiting andrecruitment domain,CARD)的 caspase-1,形成复杂的复合物即 NLRP3炎性体[5]。ASC的CARD与caspase-1的 CARD区相互作用。活化的caspase-1也称白细胞介素 IL-1β转化酶,可以诱导激活IL-1β前体,并将 IL-1β的前体在天冬氨酸裂解,形成活化的成熟lL-1β分泌到细胞外,产生各种免疫反应[6]。
表6 GD含药血清对大鼠巨噬细胞中NALP3 mRNA的相对表达量影响(±s)
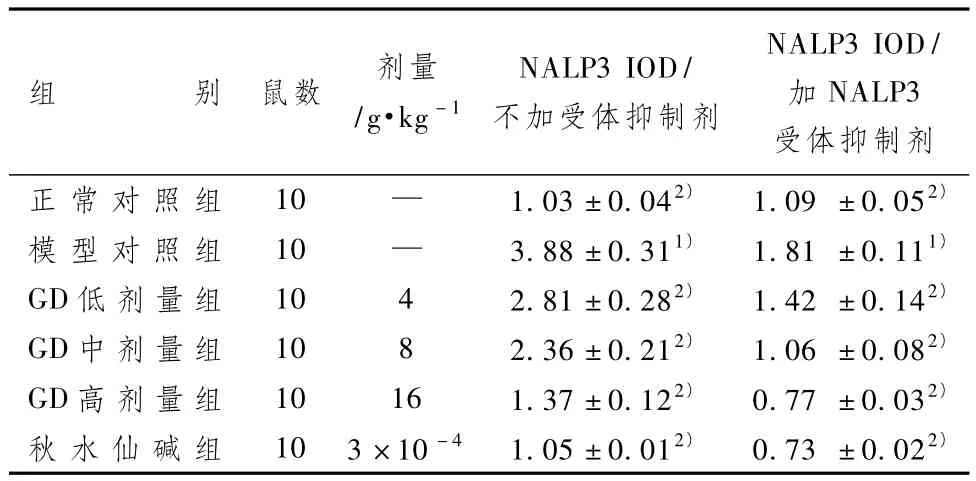
表6 GD含药血清对大鼠巨噬细胞中NALP3 mRNA的相对表达量影响(±s)
组NALP3 IOD/加NALP3受体抑制剂正 常 对 照 组 10 — 1.03±0.042) 1.09 ±0.052)别 鼠数 剂量/g·kg-1NALP3 IOD/不加受体抑制剂模 型 对 照 组 10 — 3.88±0.311) 1.81 ±0.111)GD低剂量组 10 4 2.81±0.282) 1.42 ±0.142)GD中剂量组 10 8 2.36±0.212) 1.06 ±0.082)GD高剂量组 10 16 1.37±0.122) 0.77 ±0.032)秋 水 仙 碱 组 10 3×10-4 1.05±0.012) 0.73 ±0.022)
MSU晶体是痛风的关键诱导因素,同时也是NLRP3炎性小体的激动剂。尿酸盐晶体被巨噬细胞吞噬后可能通过促进钾离子外流[7]和诱导线粒体产生大量活性氧ROS[8-9],使NLRP3炎性体活化,激活Caspase-1,分解无活性的 IL-1前体(pro-IL-1β),分泌和释放成熟的 IL-1β[10-11],活化的 IL-1β被靶细胞(如滑膜细胞)上的 IL-1受体结合,激活炎症转录因子(如 NF-κB),生成大量炎症介质,如TNF-α、IL-6[12]等,进一步加重其诱导的炎症反应[13]。
实验过程中先用大鼠含尿酸钠血清造模干预巨噬细胞,分别取30 min及1、2、4、8、12 h共6个时间段摸索尿酸钠诱导大鼠巨噬细胞造模。结果发现,造模12 h后细胞IL-1β表达均无明显升高,表明含尿酸钠血清诱导大鼠巨噬细胞造模不成功。考虑痛风性关节炎是沉积到关节中的尿酸钠结晶刺激引发的炎症反应,参阅文献[14]细胞造模给药方法,采用尿酸钠溶液直接干预细胞造模成功。
实验结果表明,GD能够显著降低模型大鼠巨噬细胞中NLRP3 mRNA、ASC蛋白表达及炎性细胞因子IL-1β、TNF-α、IL-6表达,从一定程度揭示GD抗炎机制可能与降低NLRP3炎性体、ASC表达、增加Capase-12表达、抑制 IL-1β分化成熟及 NF-KB活化、降低NLRP3炎性体信号通路炎性因子表达有关。
实验中发现,与秋水仙碱不同的是 GD各剂量组能够增加模型大鼠巨噬细胞中 Capase-12的表达。据文献报道[15],Capase-12 蛋白是具有与Capase-1高度相似的CARD结构域,能够干扰ASC的CARD与 caspase-1的 CARD区相互作用,抑制NLRP3炎性体活化,进而抑制炎性因子IL-1β表达,提示GD新的抗炎机制。
NALP3受体抑制剂明显减少各组巨噬细胞IL-1β的表达,但对TNF-α、NF-KB无明显影响,而GD却能降低模型大鼠巨噬细胞中TNF-α、NF-KB表达,提示GD可以通过另外信号通路发挥抗炎作用。
[1] 兰青,尹美珍,李世普.大鼠腹腔巨噬细胞的分离培养与鉴定[J].武汉理工大学学报,2009,31(9):40-42.
[2] 李雅,肖碧跃,赵国荣,等.桂枝芍药知母汤对急性痛风性关节炎大鼠 IL-6、TNF-α表达的影响[J].新中医,2013,45 (11):131-132.
[3] 兰青,尹美珍,李世普.大鼠腹腔巨噬细胞的分离培养与鉴定[J].武汉理工大学学报,2009,31(9):40-42.
[4] Martinon F.Detection of immune danger signals by NLRP3[J].J Leukoc BioL,2008,83:507-511.
[5] Martinon F,Pétrilli V,Mayor A,etal.Gout-associated uric acid crystals activate the NLRP3 inflammasome[J].Nature,2006,(440):237-241.
[6] FranchiL, Eigenbrod T, Mu oz-Planillo R, etc. The inflammasome:a caspase-1 activation platform that regulates immune responses and disease pathogenesis[J].Nat Immunol,2009,10:241-247.
[7] ShiY,MucsiAD,Ng G.Monosodium urate crystalsin inflammation and immunity[J].Immunol Rev,2010,233(1): 203-217.
[8] 童玉娜,何娅妮.NALP3炎性体与非感染性炎症疾病[J].生理科学进展,2011,42(4):317-320.
[9] 李翔,田湉,张艳.NLRP3炎性复合体在抗感染免疫中的作用[J].细胞与分子免疫学杂志,2012,28(4):439-441.
[10] Latz E.The inflammasomes: mechanisms of activation and function[J].Curr Opin Immunol,2010,22(1):28-33.
[11] Cassel SL,Joly S,Sutterwala FS.The NLRP3 inflammasome:a sensor of immune danger signals[J].Semin Immunol,2009,21 (4):194-198.
[12] Mcgeough MD,Pena CA,MuellerJL,et al.IL-6 is a marker of inflammation with no direct role in inflammasome-mediated mouse models[J].J Immunol,2012,189(6):2707-2711.
[13] Martinon F. Mechanisms of uric acid crystal-mediated autoinflammation[J].Immunol Rev,2010,233(1):218-232.
[14] 李晓红,李顺英,赵永娜,等.粗根荨麻水提取部分对AA大鼠腹腔巨噬细胞 PGE2水平及体外LPS诱导腹腔巨噬细胞COX-2 mRNA表达的影响[J].时珍国医国药,2008,19(9): 2132-2134.
[15] Saleh M1,Mathison JC,Wolinski MK,et al.Enhanced bacterial clearance and sepsis resistance in caspase-12-deficient mice[J].Nature,2006,440(7087):1064-1068.
Research on The Effect of Guizhishaoyaozhimu Decoction on The Expression of Inflammatory Signal in Macrophage Induced with Monosodium Urate Crystals Based on NLRP3 Inflammasomes Signaling Pathway
FANG Shu-biao1,2,Wang Yong-hui2,LI Yan-yan2,ZHOU ran2△
(1.Basic Medicine College of Hubei University of Chinese Medicine,Wuhan 430065,China; 2.Shanxi University of Traditional Chinese Medicin,Taiyuan 030024,China)
Objective:To study the effect of Guizhishaoyaozhimu Decoction(GD)on the expression of inflammatory signal in macrophage induced with monosodium urate crystals based on NLRP3 inflammasomes signaling pathway and explore the anti inflammation mechanism.Methods:30 male SD rats were randomly divided into 5 groups with 6 rats each group according to weight.The high,medium,low dose group of GD(4,8,16 g mg·kg-1)and colchicine group(3× 10-4g·kg-1)were treated with medicine by gastric administration,the normal group were given equal volume of distilled water.Medicine or distilled water was given once daily for inhibitor seven consecutive days throughout the experiment.One hour after the last gastric administration,all rats were anesthetized with ether,and the serum was collected and incubated for 12 hour.Macrophage were isolated from 30 male SD rats and cultured according to the methods from literatures and randomly divided into 2 experiments(no receptor inhibitors,plus NALP3 receptor inhibitors experiment)with 6 groups each experiment.The normal was added to normal rat serum,the model group,the high,medium and low dose group of GD and colchicine group were added uric acid sodium suspension of 200 μg·L-1to induce into cell model with serum containing medicine.All cells were put into the CO2 cell incubator for 2 hour.The expression of Inflammatory cytokine such as interleukin-1 beta(IL-1)and interleukin-6(IL-6),tumor necrosis factor alpha(TNF)were detected with Enzyme linked immunosorbent assay(ELISA),and activity of nuclear factor-KB(nuclear factor kappa B(NF KB)was detected with DNA-protein interaction-ELISA(DPI-ELISA).The expression levels of apoptosis associated protein(ASC),Capase-12signaling proteins were detected by Western blot.The mRNA expression levels of NACHT-LRR-PYD-containing proteins 3 (NLRP3)inflammasome was detected with reverse transcription-PCR(RT-PCR).Result:Compared with normal group after 12 hours,the expression of IL-1β,IL-6,TNF-α,NF-KB,ASC and NLRP3 inflammasomes in macrophage of the model group significantly increased,whereas Capase-12 significantly decreased.The expression of IL-1β、IL-6、TNF-α、NALP3 mRNA in all drug delivery groups,and NF-KB、ASC in medium and high dose group of GD significantly decreased than the model group,whereas Capase-12 in high dose group of GD increased and there was no significant increase in group of Colchicine.Conclusion:The anti inflammation mechanism of GD is related to decreasing the expression levels of NLRP3 and ASC and increasing the expression of Capase-12,and accordingly inhibiting the maturation of IL-1βand the activation of NFKB,reducing the expression of inflammatory factors in NLRP3 inflammasomes signaling pathway.Different from the colchicine,GD significantly increased the expression of Capase-12 to inhibit the expression of inflammatory factors in NLRP3 inflammasomes signaling pathway in Negative feedback mode that suggested a new anti-inflammatory mechanism of GD.GD can also reduced the expression of NF-KB and TNF-in macrophage In the case of applying NALP3 receptor inhibitor,suggesting that GD can exert anti-inflammatory effect through the other signaling pathways.
Guizhishaoyaozhimu Decoction;macrophage;NLRP3 inflammasomes;signaling pathway
R285.5
:B
:1006-3250(2016)04-0472-05
2015-11-20
山西省科技创新团队建设项目(2012081018)
房树标,主管药师,医学博士,从事新药物质基础研究。
△通讯作者:周 然,教授,医学博士,从事中药药理及实验方剂学研究,Tel:18636117158,E-mail:wyh766188@sina.com。
