中空纤维三相液相微萃取荧光光度法测定绿豆芽中的吲哚类植物生长素
2016-03-24吐尔洪买买提木尼热阿布都艾尼谢尔艾力加帕尔
陈 露,吐尔洪·买买提,木尼热·阿布都艾尼,谢尔艾力·加帕尔
(新疆大学 化学化工学院 石油天然气重点实验室,新疆 乌鲁木齐 830046)
中空纤维三相液相微萃取荧光光度法测定绿豆芽中的吲哚类植物生长素
陈露,吐尔洪·买买提*,木尼热·阿布都艾尼,谢尔艾力·加帕尔
(新疆大学化学化工学院石油天然气重点实验室,新疆乌鲁木齐830046)
摘要:基于中空纤维液相微萃取技术,建立了绿豆芽中吲哚类植物生长素的荧光检测方法。通过L9(34)正交实验,对中空纤维液相微萃取条件进行优化,得到的优化条件为:样品溶液的pH值调为 4.0,萃取溶剂为正辛醇,接受相为pH 12.0的NaOH,搅拌速度为1 000 r/min,萃取时间为60 min。在最优萃取条件下,吲哚类植物生长素的富集倍数可达 92 倍。供体相中吲哚类植物生长素的质量浓度在 1.71~50.0 mg/L范围内呈良好的线性关系,相关系数为0.997 9,检出限(S/N=3)为0.57 mg/L,样品的加标回收率为88.6%~100.7%,相对标准偏差(RSD)不大于 4.8%。该方法操作简单,环境友好,可用于绿豆芽中吲哚类植物生长素含量的准确快速测定。
关键词:中空纤维三相液相微萃取;吲哚类植物生长素;正交实验;荧光光度法;绿豆芽

图1 吲哚类植物生长素的结构示意图Fig.1 Molecular structure of indole phytohormonesn=1, 2, 3 represented IAA, IPA, IBA, respectively
植物生长素是植物体内微量存在并调控植物生长﹑分化和发育的化合物[1]。吲哚类植物生长素是最先发现的可促进植物生长的植物激素[2],主要包括吲哚乙酸(IAA)﹑吲哚丙酸(IPA)和吲哚丁酸(IBA),它们由不饱和芳香环和吲哚侧链环组成[3],其结构如图 1 所示。由于植物体内生长素的含量很低[4],并且容易被热、光和氧降解,许多干扰基质也会影响其直接测定,因此分离和富集对生长素含量的测定显得尤为重要[5]。
提取植物激素的常用富集技术有固相萃取(SPE)[6]﹑固相微萃取(SPME)[7]﹑微波辅助萃取[8]﹑液相微萃取(LPME)[9]等。传统的富集技术不仅操作繁琐耗时,而且需使用大量的有机溶剂,难以实现自动化[10]。SPME虽然可以克服上述缺点,但使用成本高,存在交叉污染,不能直接与高效液相色谱(HPLC)联用,因此应用受到限制[11]。以多孔中空纤维为载体的液相微萃取(HF-LPME)是 20 世纪 90 年代由 Pederson-B jerggaard 首次提出的萃取技术[12],主要是通过有机溶剂在纤维壁孔中形成的液膜进行传质,在多孔的中空纤维腔内进行萃取[13]。中空纤维液相微萃取集采样、萃取和浓缩于一体,具有富集倍数高、有机溶剂消耗少、样品净化能力强等优点,是一种环境友好的样品前处理技术[14],已被广泛应用于食品[15]、环境[16]、医学[17]等领域。
荧光检测分析具有高灵敏度、高选择性、操作简单等优点[18-19],适合于植物生长素的测定,Liu等[20]通过同步荧光法测定了果汁中 IAA 和 2-萘氧乙酸(BNOA)的含量。本文将三相中空纤维液相微萃取与荧光检测结合测定了绿豆芽中的吲哚类植物生长素,该方法简化了样品前处理过程,缩短了分析时间,提高了分析效率,使用少量的有机溶剂有效去除了基质中复杂的干扰组分,简单快速,可用于绿豆芽中吲哚类植物生长素的痕量测定。
1实验部分
970CRT荧光分光光度计(上海精密科学仪器有限公司);KQ5200B 超声波清洗器(昆山超声仪器有限公司);UV-1800紫外可见分光光度计(日本岛津公司);1810-B 型石英自动双重纯水蒸馏器(上海市中晨数字技术设备有限公司);pH 211 型酸度计(HANNA instruments),HC-2062 型高速离心机(安徽中科中佳科学仪器有限公司);磁力搅拌器(法国,IKA color squid);Accurel Q 3/2 聚丙烯中空纤维(Membrana GmbH,Wuppertal,德国;壁厚 200 μm,孔径 0.2 μm,内径 600 μm)。
IAA、2,4-二氯苯氧基乙酸(2,4-D)、9-蒽甲醇(9-NA)、1-萘乙酸(1-NAA)、1-芘丁酸(1-PBA)均购自百灵威科技有限公司,氢氧化钠、无水磷酸氢二钠、无水磷酸二氢钠、甲醇、正辛醇等购自国药集团化学试剂有限公司,所有试剂均为分析纯,实验用水为二次蒸馏水(自制)。
1.2实验方法
1.2.1绿豆芽的培育称取100 g 绿豆置于200 mL 烧杯中,用蒸馏水洗净,置于暗处,提供适宜的温度和湿度,每天定时换水2~3次,3天后,收集生长的豆芽,于-20 ℃下储存备用。
1.2.2绿豆芽中植物生长素的提取取5 g 按上述方法培育的绿豆芽研磨,加20 mL NaH2PO4-H3PO4(pH 9.0)缓冲溶液,并在4 ℃ 下于暗处过夜提取植物生长素。然后将提取液在高速离心机中离心(9 000 r/min,5 min),收集上清液。逐滴加入1 mol/L的HCl,调上清液至所需pH值。

图2 中空纤维液相微萃取示意图Fig.2 Scheme of hollow fiber-liquid phase microextraction
1.2.3中空纤维萃取绿豆芽中吲哚类植物生长素将放有微型搅拌磁子的玻璃瓶固定于磁力搅拌器上,加入8 mL 样品溶液,将中空纤维截成约8 cm长的小段,在丙酮中超声清洗10 min,以去除中空纤维表面的杂质,然后将中空纤维用N2吹干。将中空纤维小段在正辛醇中浸泡5 min,使纤维孔壁充满正辛醇,取出中空纤维后,用移液枪向中空纤维管内定量注入一定浓度的NaOH溶液作为接受相,然后将中空纤维迅速浸入到样品溶液中,用封口膜将进样口两端密封,开启恒温磁力搅拌器,在一定搅拌速度下萃取一定时间后,用移液枪抽取50 μL 接受相,并定量稀释,以激发波长λex=294 nm,测定发射波长λem=360 nm 处的荧光强度,根据荧光强度计算绿豆芽中吲哚类植物生长素的含量。实验装置如图2所示。
1.2.4正交实验为了更加有效地利用中空纤维萃取绿豆芽中吲哚类植物生长素,建立 L9(34)正交实验水平因素表,以萃取时间、转速、接受相NaOH的pH值和给体相HCl的pH值作为考察因素,通过单因素实验,选出影响绿豆芽中吲哚类植物生长素提取效果的各因素中有意义的三水平,进行正交实验(见表1),优化萃取绿豆芽中吲哚类植物生长素的最佳测定条件。
针对上述问题,为了消除不匹配的线路电阻和不对称负荷对电流分配的影响,本文提出了一种基于自适应虚拟阻抗的分布式控制策略。该控制策略在传统下垂控制的基础上,结合本地和相邻DG单元输出的电流和初始虚拟阻抗值,根据系统特性自动调节等效输出虚拟阻抗,使接口变流器的虚拟电阻与线路电阻的和逐渐收敛于相同值,以实现电流的动态均衡分配。另外,虚拟阻抗控制中由于线路电阻的影响带来的电压偏移,则通过添加电压控制器利用动态一致性观察法进行补偿。

表1 正交实验设计
2结果与讨论
2.1分配系数的测定
分配系数(Ka/d)直接影响富集倍数、加标回收率的大小。研究表明,两相LPME只用于亲脂性高或中等的化合物分析,其Ka/d通常大于 500,不适用于亲水的中性分析物;而对于酸碱性分析物,需要三相LPME,通过控制供体相和接受相的 pH 值,使分析物以非离子化状态存在,来提高分配系数。吲哚乙酸﹑吲哚丙酸和吲哚丁酸的分子结构中均含有羧基,故选用三相 LPME 模式。以IAA 为代表物对两相间的分配情况进行考察,首先用等体积的正辛醇萃取 50 mg/L 的IAA-HCl溶液(pH 4.0),萃取完成后,收集有机层和HCl供体相,在λmax=280.0 nm 处测定吸光度。然后在有机层中加入等体积的 NaOH(pH 12.0)反萃取,再收集有机层和NaOH接受相,在λmax= 280.0 nm 处测定吸光度。根据中空纤维三相液相微萃取分配系数的定义,Ka/d=Korg/d×Ka/org,其中Ka/d为分配系数,Korg/d为萃取达平衡时分析物在有机相的浓度与在样品中浓度的比值,Ka/org为萃取达平衡时分析物在接受相中的浓度与在有机相中浓度的比值。计算可知,Korg/d=10.62,Ka/org=12.43,分配系数为132.29。结果表明,分析物在从水相萃取到有机相,然后从有机相反萃取到水相的过程中,均有较高的萃取率,可采用该体系萃取绿豆芽中的吲哚类植物生长素。
2.2萃取条件的优化
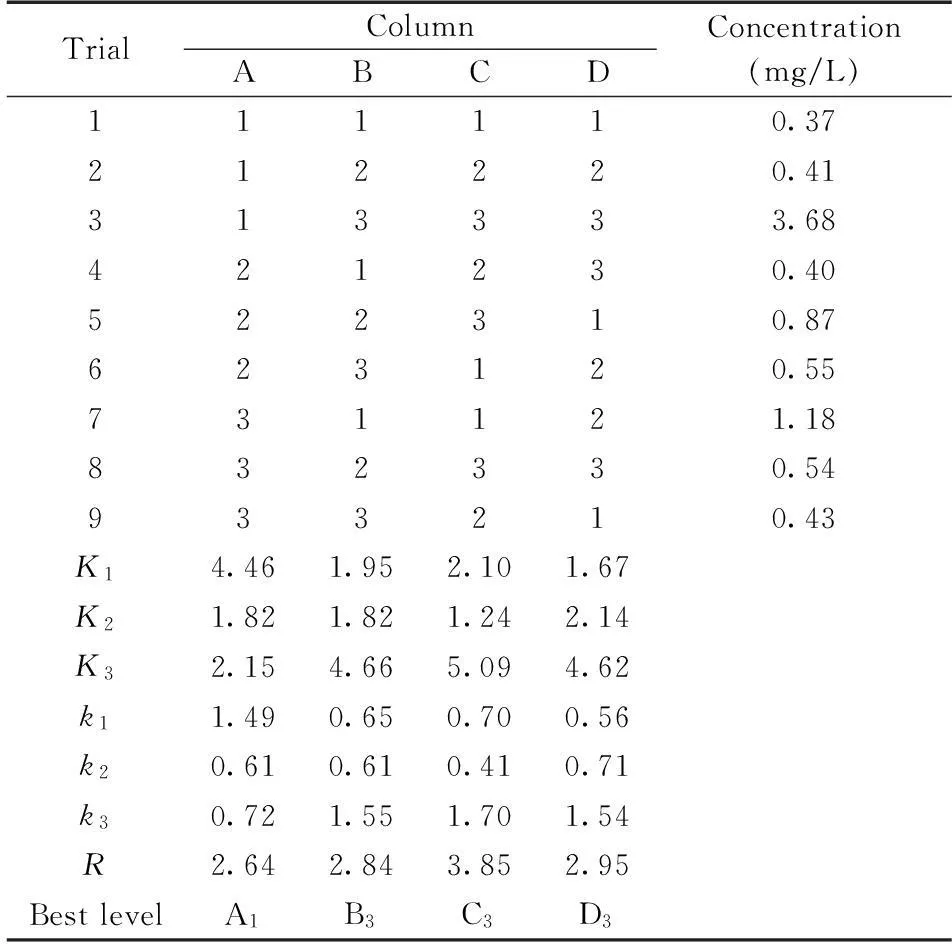
表2 实验方案与结果
植物激素的提取液通常选用有机溶剂[21],如符继红等[22]采用 80%的甲醇溶液对拟南芥中的生长素进行提取,Wang等[5]用80%的甲醇对绿豆样品进行预处理。本研究选择NaH2PO4-H3PO4缓冲溶液作为提取液,分析物经该缓冲溶液提取后,可直接作为给体相进行萃取,而用有机溶剂提取时,需先将有机溶剂蒸出,再将分析物重新用水相溶解配制给体相才能萃取。
吲哚类植物生长素包括吲哚乙酸、吲哚丙酸、吲哚丁酸等都具有吲哚环骨架结构特征。紫外分光光度计和荧光分光光度计均可用于其测定分析,但因其在植物体内含量很低,加之紫外检测器的灵敏度较低,故本研究选用荧光分光光度计进行测定。
正交实验的结果列于表2。从极差分析结果可看出,RC>RD>RB>RA,4个因素对提取率的影响大小依次为:NaOH的pH值(C)>HCl 的pH值(D)>转速(B)>萃取时间(A),其中接受相NaOH的pH值影响较为显著。中空纤维萃取的最佳条件为A1B3C3D3:即萃取时间为60 min,转速1 000 r/min,接受相NaOH的pH值12.0,样品的pH值为4.0 。按 A1B3C3D3条件进行3次平行实验,平均值为3.71 mg/L,高于表2中其他测试结果,故选择A1B3C3D3为最佳萃取条件。
根据萃取过程分析,吲哚类植物生长素先被萃取到萃取剂正辛醇中,随后在中空纤维界面遇碱离子化,再被反萃取到接受相NaOH中,从而实现对吲哚类植物生长素的选择性富集。吲哚类植物生长素分子结构中含有羧基,当供体相pH值为4.0 时,它们大部分以分子状态存在,极性减弱,减少了其在水中的溶解度,进而增大了在萃取剂正辛醇中的分配。随着接受相NaOH 浓度的增大,吲哚类植物生长素的离子化状态逐渐增加,极性也随之增加,当接受相的pH值为12.0时,吲哚类植物生长素达到最大离子化状态,大大降低了其在正辛醇中的溶解度,增大了在接受相中的溶解度,因此可以获得最佳的萃取效率。
2.3线性范围与检出限

图3 不同浓度加标样品的荧光光谱图Fig.3 Fluorescence spectra of series spiked solutionλex/λem=294/360 nm;spiked concentration(1-6):0,5,10,15,30,50 mg/L;insert:calibration curve
对绿豆芽提取液样品进行梯度加标实验,分别配制0,5,10,15,30,50 mg/L的加标样品,在最优萃取条件下测定,以荧光强度(F)对吲哚类植物生长素的质量浓度(ρ,mg/L)进行线性回归,标准曲线如图3插图所示。方法的线性范围为 1.71~50.0 mg/L,线性方程为F=14.264ρ+21.083,相关系数为0.997 9,检出限(S/N=3)为0.57 mg/L。
2.4富集倍数与精密度
富集倍数为萃取完成后接受相中分析物的浓度与萃取前样品中分析物的起始浓度之比。选择0.1 mg/L的IAA-HCl(pH 4.0)样品溶液进行富集倍数的考察,在最优的萃取条件下平行测定3次,得到富集倍数为92,3次测定值的相对标准偏差(RSD)为 5.0%。
2.5加标回收率与相对标准偏差
为了验证方法的准确性,在最优的萃取条件下进行加标回收实验。绿豆芽提取样品的加标浓度分别为5,15,30 mg/L,每个浓度平行测定3次,测定结果见表3。加标回收率为88.6%~100.7%,测定值的RSD为 1.8%~ 4.8%,表明该方法有较高的准确度和重现性,通过中空纤维液相微萃取能够去除影响绿豆芽中吲哚类植物生长素测定的干扰物。

表3 绿豆芽样品中吲哚类植物生长素的加标回收实验结果
2.6实际样品的测定

表4 绿豆芽中吲哚类植物生长素的含量
按照本方法对自培和购买的绿豆芽进行样品前处理,在最优的萃取条件下分别测定了两种绿豆芽中吲哚类植物生长素的含量,平行测定3次,测定结果见表4,测定值的RSD均不大于1.6%。自培和市售绿豆芽中吲哚类植物生长素的含量分别为7.25 μg/g 和8.20 μg/g,说明该方法可用于绿豆芽中吲哚类植物生长素的测定。

表5 方法的干扰实验
2.7干扰实验
为了验证方法的可行性,进行干扰实验。干扰物的选择根据:①样品中可能存在,并具有与目标化合物相近的物理化学性质和生物活性的物质,如2,4-D、1-NAA等生长素;②具有荧光性质的酸性化合物,如9-NA 和 1-PBA,因为这类物质可能会与目标化合物一起被萃取与检出。一般样品中干扰物与目标物浓度水平相当,本文选择两者浓度比例为10∶1,而且干扰物浓度大于其最大浓度值。向8 mL 绿豆样品中分别加入 IAA、2,4-D、1-NAA、9-NA 和1-PBA 的甲醇标准溶液,IAA浓度为10 mg/L,其余化合物浓度均为100 mg/L,在最优条件下萃取后测定,结果见表5。结果显示,当绿豆样品中添加IAA 标品时,接受相的荧光强度比空白绿豆样品增加了141.38,而添加物为2,4-D、1-NAA、9-NA 和 1-PBA时,1-NAA引起的荧光强度变化最大,但其值仅为10.86;表明2,4-D、9-NA 和 1-PBA的加入基本不使荧光强度发生变化,由此可见,干扰物对吲哚类植物生长素的测定几乎无影响。
2.8测定方法对比
将HF-LPME与已有方法进行对比,结果见表6。本方法的相关系数(0.997 9)高于其他方法,RSD小于SPE/GC-MS、MWCNT-HPLC和MAG-MIP-HPLC等方法,说明本方法获得数据可以与HPLC、GC-MS 等高端仪器测得的数据相媲美,且该方法简单、快捷、重现性好,可用于绿豆芽中吲哚类植物生长素含量的测定。

表6 HF-LPME与其它方法的对比
a:hollow fiber-liquid phase microextraction-fluorescence;b:solid phase extraction/gas chromatography-mass spectrometry;c:multi-walled carbon nanotube-high performance liquid chromatography;d:molecularly imprinted monolayer-surface plasmon resonance, e:magnetic molecularly imprinted polymer-high performance liquid chromatography, f:high performance liquid chromatography-chemiluminescence
3结论
本文通过正交试验,优化了中空纤维萃取绿豆芽中吲哚类植物生长素的最优条件,同时建立了吲哚类植物生长素的荧光检测分析方法。取50 μL萃取完成后中空纤维中的接受相,用高纯水稀释至500 μL,在λex/λem=294/360 nm处测定荧光强度,用本方法萃取绿豆芽中的吲哚类植物生长素,操作简单﹑方便快捷,其线性范围为1.71~50.0 mg/L(r=0.997 9),检出限为0.57 mg/L,富集倍数为92,加标回收率不小于88.6%。该方法可用于绿豆芽中吲哚类植物生长素含量的测定。
参考文献:
[1]Chen J G,Du X M,Zhao H Y,Zhou X.J.PlantGrowthRegul.,1996,15(4):173-177.
[2]Epstein E,Ludwig Müller J.Physiol.Plant,1993,88(2):382-389.
[3]Riov J,Yang S.J.PlantGrowthRegul.,1989,8(2):131-141.
[4]Xi Z,Zhang Z,Sun Y,Shi Z,Tian W.Talanta,2009,79(2):216-221.
[5]Wang Z H,Xia J F,Han Q,Shi H N,Guo X M,Wang H,Ding M Y.Chin.Chem.Lett.,2013,24(7):588-592.
[6]Zhang H W,Li K,Liang Z X,Wang F Y,Lu Q W.Chin.Chem.Lett.,2012,23(6):723-726.
[7]Zhang S W,Zou C J,Luo N,Weng Q F,Cai L S,Wu C Y,Xing J.Chin.Chem.Lett.,2010,21(1):85-88.
[8]Tong X,Xiao X,Li G.J.Chromatogr.B,2011,879(24):2397-2402.
[9]Faraji H,Saber Tehrani M,Mirzaie A,Husain S W.J.PlanarChromatogr.,2011,24(3):214-217.
[10]Ghambarian M,Yamini Y,Esrafili A.Microchim.Acta,2012,177(3/4):271-294.
[11]Kataoka H,Saito K.J.Pharm.Biomed.,2011,54(5):926-950.
[12]Pedersen-Bjergaard S,Rasmussen K E.Anal.Chem.,1999,71(14):2650-2656.
[13]Luo M B,Liu W,Li B P,Zhi Y.Chin.J.Anal.Chem.(罗明标,刘维,李伯平,枝杨.分析化学),2007,7(35):1071-1077.
[14]Sun W J,Du Z X,Yu W L,Zhou L L.J.Instrum.Anal.(孙文军,杜振霞,于文莲,周丽丽.分析测试学报),2012,31(12):1487-1492.
[15]Cao J P,Xie Q L,Zhou J M,Yi Z H.J.Instrum.Anal.(曹江平,解启龙,周继梅,易宗慧.分析测试学报),2015,34(5):616-624.
[16]Hou D K,He J,Zhang F J,KHureldavaa Otgonbayar.J.Instrum.Anal.(侯德坤,何江,张福金,呼日乐达瓦.分析测试学报),2014,33(5):606-614.
[17]Liu Y,Zhang F C,Jiang Y.J.Instrum.Anal.(刘彦,张福成,蒋晔.分析测试学报),2012,31(6):725-729.
[18]Zhang J,Fu Y,Li G,Zhao R Y.Biochem.Biophys.Res.Commun.,2012,425(3):696-700.
[19]Muhammad A,Muhammad T,Yimit O,Yakup B.J.Fluoresc.,2013,23(3):599-604.
[20]Liu X,Wan Y.Spectrochim.ActaA,2013,111:230-236.
[21]Ma Z,Ge L,Lee A S Y,Yong J S N,Tan S N,Ong E S.Anal.Chim.Acta,2008,610(1):274-281.
[22]Fu J H,Chu J F,Wang J D,Yan C Y.Chin.J.Anal.Chem.(符继红,褚金芳,王吉德,闫存玉.分析化学),2009,37(9):1324-1327.
[23]Wu P G,Tan Y,Zhang J,Wang L Y,Tang Y,Jiang W,Pan X D,Ma B J,Ni Z N,Wang T J.Chin.J.Anal.Chem.(吴平谷,谭莹,张晶,王立媛,汤鋆,姜维,潘晓东,马冰洁,倪竹南,王天娇.分析化学),2014,42(6):866-871.
[24]Prasad B B,Prasad A,Tiwari M P.Biosens.Bioelectron.,2013,39(1):236-243.
[25]Wei C,Zhou H,Chen C,Li Z,Zhou J.Anal.Lett.,2011,44(18):2911-2921.
[26]ZhangY,Li Y,Hu Y,Li G,Chen Y.J.Chromatogr.A,2010,1217(47):7337-7344.
Spectrofluorimetric Determination of Indole Phytohormones in Bean Sprout Using Three Phase Hollow Fiber-Liquid Phase Microextraction
CHEN Lu, TURGHUN Muhammad*, MUNIRA Abuduani, SHIRALI Jappar
(College of Chemistry & Chemical Engineering, Xinjiang University, Key Laboratory of Oil and Gas Fine Chemical,Educational Ministry of China, Urumqi830046, China)
Abstract:A new method using three phase hollow fiber-liquid phase microextraction was developed for the determination of indole phytohormones in bean sprout by spectrofluorimetry.The parameters affecting liquid phase microextraction performance were optimized using L9(34)orthogonal experiment.The optimum extraction was achieved by adjusting sample solution pH value to 4.0, using 1-octanol as organic extraction solvent, pH 12.0 solution as acceptor phase, and stirring the solution at 1 000 r/min for 60 min.Under the optimum conditions, the calibration curve showed a good linearity(r=0.997 9) in the range of 1.71-50.0 mg/L, with a detection limit of 0.57 mg/L.Recoveries for spiked samples from 88.6%to 100.7%were obtained with RSDs not more than 4.8%.The proposed method was simple, green and accurate in the determination of indole phytohormones in bean sprout.
Key words:hollow fiber three phase liquid phase microextraction;indole phytohormones;orthogonal experiment;spectrofluorimetry;bean sprout
中图分类号:O657.3;S963.732
文献标识码:A
文章编号:1004-4957(2016)02-0229-06
doi:10.3969/j.issn.1004-4957.2016.02.016
*通讯作者:吐尔洪·买买提,博士,教授,研究方向:分析化学,Tel:0991-8582654,E-mail:turghunm@sina.com
基金项目:国家自然科学基金资助项目(21365020;21565025)
收稿日期:2015-07-15;修回日期:2015-08-19
