肉桂酸和咖啡酸对莴苣生长的化感作用及其机理研究
2016-03-23燕志强李秀壮何小凤杨晓燕
郭 凯,燕志强,金 辉,李秀壮,何小凤,杨晓燕,秦 波*
(1 中国科学院大学,北京 100049;2 中国科学院兰州化学物理研究所 中国科学院西北特色植物资源化学重点实验室/甘肃天然药物重点实验室,兰州 730000)
肉桂酸和咖啡酸对莴苣生长的化感作用及其机理研究
郭凯1,2,燕志强2,金辉2,李秀壮2,何小凤2,杨晓燕2,秦波2*
(1 中国科学院大学,北京 100049;2 中国科学院兰州化学物理研究所 中国科学院西北特色植物资源化学重点实验室/甘肃天然药物重点实验室,兰州 730000)
摘要:该研究以莴苣为受体植物,分析了酚酸类化感物质肉桂酸和咖啡酸对莴苣幼苗生长的活性效应及其作用机理,以揭示酚酸类化合物的化感作用机制。结果显示:(1)不同浓度的肉桂酸均对莴苣幼苗根长、茎长及鲜重产生明显的抑制作用,当肉桂酸的浓度为1 000 μmol/L时其对莴苣幼苗根长、茎长及鲜重的抑制率分别达到了89%、74%和49%;咖啡酸对莴苣幼苗根长和茎长均表现出低浓度(0.1、1.0和10 μmol/L)促进、高浓度(100和1 000 μmol/L)抑制的活性作用模式,且高浓度下肉桂酸对幼苗生长的抑制作用明显强于咖啡酸。(2)较低浓度(0.1、1.0和10 μmol/L)的肉桂酸和咖啡酸对莴苣根尖细胞活力均无明显影响;高浓度(100和1 000 μmol/L)的肉桂酸和咖啡酸使莴苣根尖细胞的死亡数明显增加。(3)低浓度(0.1和1.0 μmol/L)的肉桂酸和较低浓度(0.1、1.0和10 μmol/L)的咖啡酸对莴苣根部的活性氧积累均无明显影响;当肉桂酸处理浓度大于10 μmol/L及咖啡酸处理浓度大于100 μmol/L时,随着浓度的升高莴苣根部活性氧的积累大量增加。研究表明,一定浓度的肉桂酸和咖啡酸均能够诱导莴苣体内活性氧的产生和积累,并降低幼苗根尖细胞的活力,进而影响莴苣幼苗的生长发育,且肉桂酸的生长抑制作用明显强于咖啡酸。
关键词:肉桂酸;咖啡酸;莴苣;化感效应;作用机理
Molisch于1937年首次提出了植物化感作用的概念,认为是所有植物(含微生物)之间的相互作用[1]。Rice在1984年将其较完善地定义为环境中一种植物(含微生物)直接或者间接地通过化学物质的释放对另一种植物(含微生物)产生有利或者不利影响的现象[2]。化感作用广泛存在于自然界中,与生态系统中的生物入侵以及农业中的连作障碍等现象密切相关[3-4]。植物化感物质是植物体内次生代谢的产物,自然状况下主要通过体外释放挥发物质、表面淋溶、根部分泌和残体分解等4种途径进入环境[3]。化感物质能够对受体植物生长发育的多个方面产生有利或不利的影响,对化感物质活性作用机理的解释是植物化感研究中最主要的难点之一[5-6]。
酚酸通常为芳香环上带有活性羧基的有机酸,是引起植物自毒作用的主要原因[7]。酚酸类化感物质普遍存在于高等植物体内及其土壤中,主要通过根系的分泌作用释放到环境中,进而抑制周围其他植物的生长[8-10]。肉桂酸和咖啡酸是两种常见的酚酸类化感物质。肉桂酸是茄子根系分泌物中主要的化感物质之一[11],能够抑制过氧化物酶的活性并诱导类脂的过氧化[12],对黄瓜[13]、大豆[14]、辣椒[15]等多种植物的种子萌发及生长也产生影响。咖啡酸能够抑制磷酸化酶、蛋白酶等多种酶的活性,对多种植物的萌发和生长产生影响[16-18]。前人对肉桂酸和咖啡酸这两种酚酸的化感作用机制有报道[13,18],但对于不同结构酚酸类化合物化感作用效果差异的原因缺少相应的研究和佐证。本研究以化感作用较为敏感的莴苣为受体植物,在明确肉桂酸和咖啡酸活性作用效果的基础上,进一步探讨了2种酚酸类化合物对植物细胞活力以及活性氧的影响,并比较和分析了2种酚酸类化合物产生的化感作用效果的差异,为揭示肉桂酸和咖啡酸介导的化感作用及连作障碍机制提供参考。
1材料和方法
1.1实验材料
莴苣品种为‘四季白尖叶’,种子购于四川种都种业有限公司。肉桂酸(反式为主)和咖啡酸标准品购于上海迈瑞尔化学技术有限公司,纯度95%。
1.2材料培养与处理
肉桂酸和咖啡酸的标准品分别用DMSO溶解配制成100 mmol/L的母液,并用蒸馏水稀释100倍得到最高试验浓度为1 000 μmol/L的溶液,然后将此溶液依次稀释10倍,得到最终处理浓度分别为1 000、100、10、1.0和0.1 μmol/L的5种处理溶液,分别取1 mL各种浓度的处理溶液置于铺有滤纸的六孔板中。将莴苣种子放在培养皿中的湿润滤纸上,并置于恒温恒湿的培养箱(瑞华,HP150HS)中,25 ℃黑暗条件下萌发24 h后,选取生长一致的莴苣幼苗转移到上述六孔板的滤纸上,以含有相同DMSO含量的水溶液为对照,每个处理至少6株幼苗,相同条件下继续培养48 h后,进行相关指标的观察和测定。
1.3测定指标与方法
1.3.1生长指标测量肉桂酸和咖啡酸处理48 h后用毫米刻度尺测量幼苗的根长和茎长,用分析天平(Mettler-Toledo,AL104)测量幼苗鲜重。其中抑制率的计算公式为:
抑制率=(对照组数据-处理组数据)/对照组数据×100%
1.3.2细胞活力观察细胞活力观察参照Koodkaew等[19]的方法。切取约0.5 cm的莴苣幼苗根尖,放入含有12.5 μg/mL二乙酸荧光素(FDA)和5 μg/mL碘化丙啶(PI)的染液中,避光着色10 min,蒸馏水冲洗干净后置于载玻片上,在荧光显微镜(Leica,DMI4000B)下用450~490 nm激发光和520 nm发射光下观察并拍照。
1.3.3活性氧观察活性氧观察参考Garnczarska[20]的方法。室温下莴苣幼苗的根在二氢乙锭(dihydroethidium,DHE)染色液(含10 mmol/L DHE,0.01%丙酮和100 mmol/L CaCl2,pH=4.75)中避光染色5 min,然后在100 mmol/L CaCl2中震荡清洗10 min以去除多余的染料,在荧光显微镜(Leica,DMI4000B)下用450~490 nm激发光和520 nm发射光下观察并拍照。
1.4数据处理
用SPSS 16.0进行差异显著性分析,用Photoshop 7.0进行图片处理。
2结果与分析
2.1肉桂酸和咖啡酸对莴苣幼苗生长的影响
不同浓度肉桂酸对受体植物莴苣幼苗的根、茎的伸长和鲜重均表现出抑制作用,且抑制作用随处理浓度的升高而增强(表1)。其中,莴苣幼苗根长在较低浓度(0.1、1.0和10 μmol/L)的处理下比对照显著减少了10%~14%,而在100和1 000 μmol/L浓度下的抑制率分别达到了24%和89%,在1 000 μmol/L下幼苗主根的生长几乎完全受到抑制;莴苣幼苗茎的生长在肉桂酸处理浓度达到1.0 μmol/L时开始受到显著性抑制,且抑制作用随处理浓度的升高而增强,当浓度升高到1 000 μmol/L时已受到强烈的抑制(抑制率为74%);鲜重指标反映了幼苗整体生长水平,莴苣幼苗鲜重在 0.1 μmol/L的肉桂酸处理下已受到显著性抑制,且随着处理浓度的升高抑制效果更加显著,鲜重的抑制率在浓度为1 000 μmol/L时已达到48%;随着肉桂酸处理浓度(0.1、1、10和100 μmol/L)的升高,根长/茎长的数值随之增大,表明相对于根长肉桂酸对莴苣幼苗茎长的抑制作用逐渐增强,当浓度升高到1 000 μmol/L时肉桂酸对根长的抑制作用显著强于茎长。以上结果表明,肉桂酸通过对幼苗根、茎的伸长以及鲜重的抑制来影响莴苣幼苗的整体生长状况,且在低浓度下就产生显著的抑制作用,并存在剂量效应。
同时,咖啡酸对受体植物莴苣幼苗的根、茎的伸长均表现出低浓度促进、高浓度抑制的作用模式(表2)。其中,莴苣幼苗的主根长在咖啡酸的浓度为0.1和1.0 μmol/L时比对照(0 μmol/L)有一定的增加,并在10 μmol/L时达到显著水平;而在高浓度(100和1 000 μmol/L)咖啡酸处理下主根长受到显著抑制,抑制率分别为12%和25%。与主根生长的作用效果不同,莴苣茎的生长在 0.1 μmol/L的咖啡酸处理下就受到显著促进,当浓度为1.0和10 μmol/L时虽仍受到一定促进,但未达到显著性水平;在高浓度(100和1 000 μmol/L)咖啡酸处理下,茎长受到显著抑制,抑制率分别为30%和41%。莴苣幼苗的鲜重在0.1、1.0和10 μmol/L的咖啡酸处理下与对照并无显著性差异,仅在高浓度(100和1 000 μmol/L)时受到显著性抑制,抑制率分别为15%和29%(表2);根长/茎长的数据表明较低处理浓度(0.1、1和10 μmol/L)下的咖啡酸对莴苣幼苗根长和茎长的促进作用效果相比对照无显著差异,高浓度(100和1 000 μmol/L)下咖啡酸对茎长的抑制作用显著强于根长。可见,咖啡酸主要是通过促进或抑制莴苣幼苗根、茎的伸长来影响其整体生长情况,且高浓度咖啡酸对幼苗茎长的抑制要明显强于对根长的抑制。
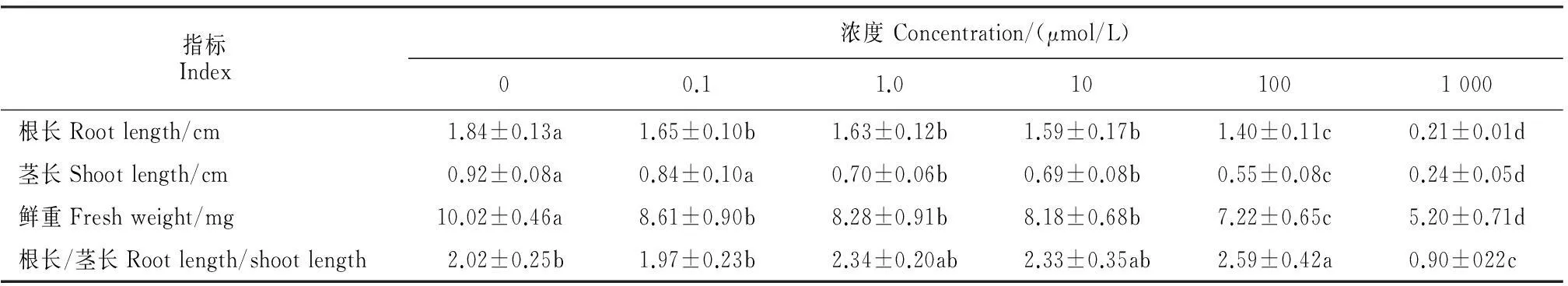
表1 肉桂酸对莴苣幼苗根长、茎长和鲜重的化感作用
注:表中所列数据为平均值±标准偏差;同指标内不同字母表示处理间在0.05水平存在显著性差异;下同。
Note:The data listed in the table as mean±SD;Different normal letters in the same characters indicated significant differences among treatments at 0.05 level;The same as below.
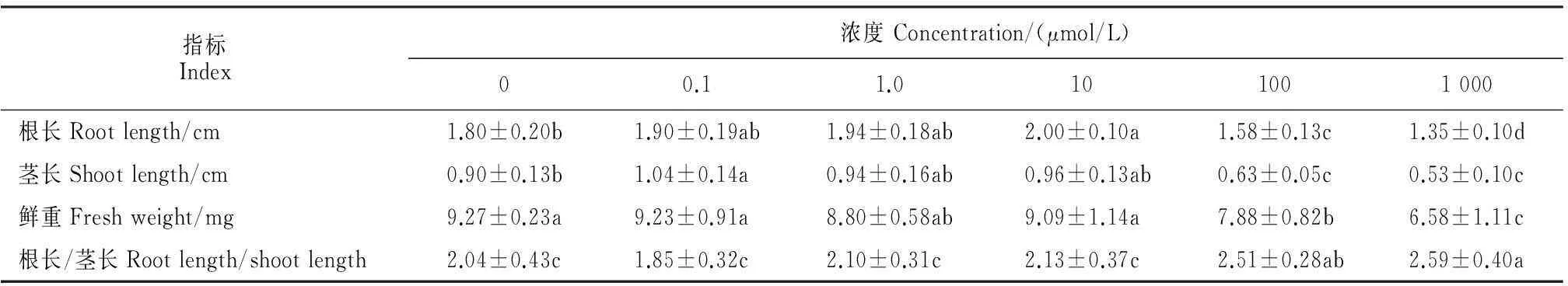
表2 咖啡酸对莴苣幼苗根长、茎长和鲜重的化感作用
通过比较可以发现,肉桂酸在各种浓度下均对莴苣幼苗根、茎的伸长以及鲜重产生抑制作用,咖啡酸对幼苗根、茎的伸长则表现出低浓度促进、高浓度抑制的效果;高浓度(100和1 000 μmol/L)处理下,肉桂酸对莴苣幼苗根、茎的伸长以及鲜重的抑制作用明显强于咖啡酸。
2.2肉桂酸和咖啡酸对莴苣根尖细胞活力的影响
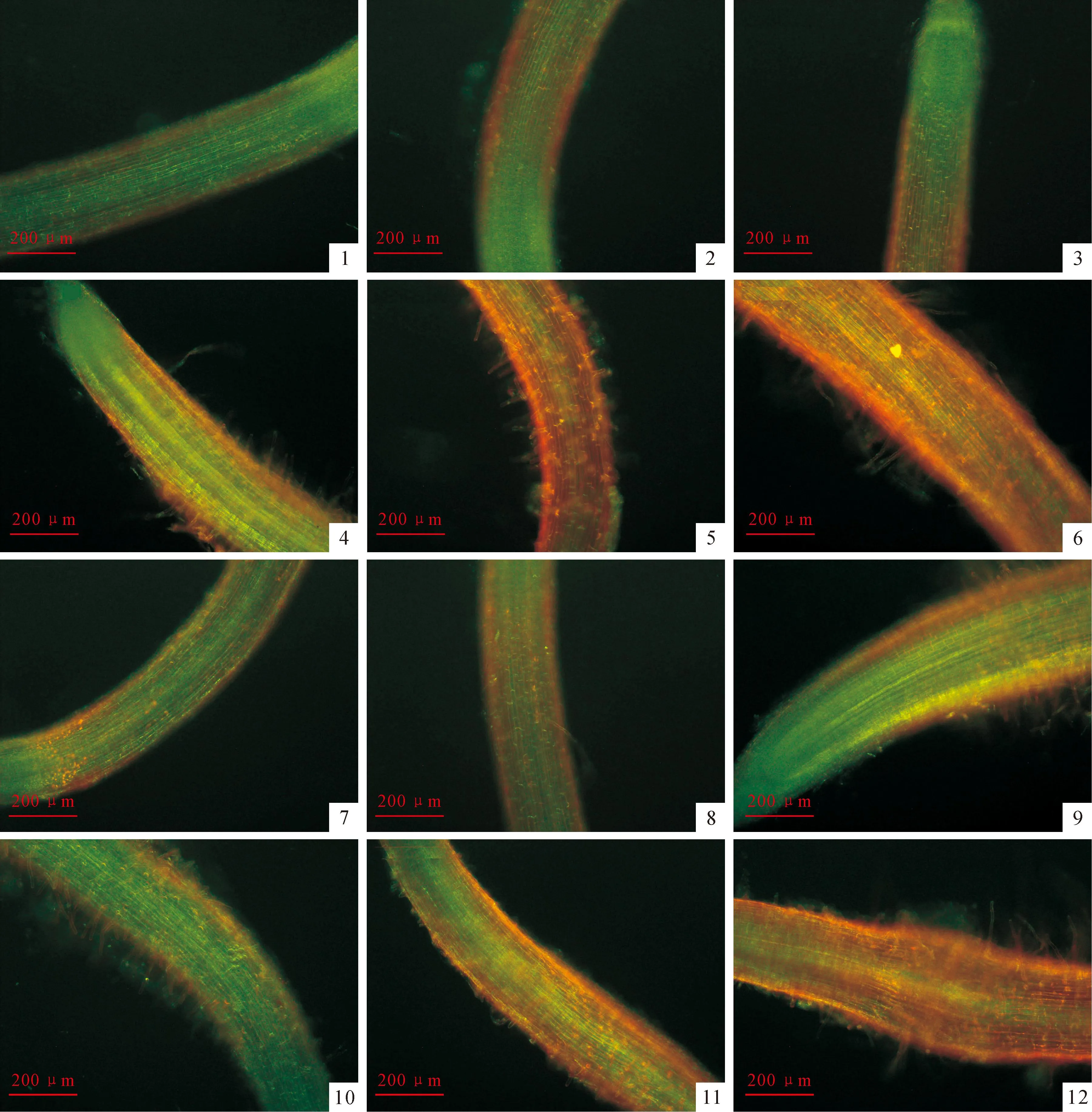
逆境条件会导致植物体内相关的酶失活或变性,严重时会造成细胞和组织的死亡。因此植物细胞活力的检测是判定植物受伤害程度的直接和有效的方法[21]。本实验采用荧光染料染色的方法分别检测了不同浓度肉桂酸和咖啡酸处理下莴苣根尖细胞活力的变化情况。利用PI能使死细胞着色及FDA能使活细胞着色的特性,可以用荧光显微镜观察FDA/PI双染色后植物根尖的细胞活力[19]。结果(图版Ⅰ,1~12)显示,处理2 d后,较低浓度(0.1、1.0和10 μmol/L)的肉桂酸(图版Ⅰ,1~4)和咖啡酸(图版Ⅰ,7~10)对莴苣根尖细胞活力无明显影响,染色结果与对照基本一致;当浓度达到100 μmol/L时,受体根尖细胞的死亡数均明显增加(图版Ⅰ,5、11);而在最高试验浓度1 000 μmol/L下,肉桂酸和咖啡酸均使大部分的根尖细胞失去活力,同时可以看出肉桂酸使幼苗根部膨大变形(图版Ⅰ,6、12)。以上结果说明一定浓度的肉桂酸和咖啡酸均能够使莴苣根尖细胞的死亡数增加,显著降低莴苣根尖细胞活力。
2.3肉桂酸和咖啡酸对莴苣根部活性氧的影响
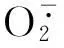
3讨论
随着现代生物学理论技术和分离分析技术的快速发展,化感作用已成为解决农业可持续发展以及生态平衡等方面的研究热点[25]。酚酸类化合物是一类重要的化感物质,广泛地存在于植物体内和耕种土壤中。酚酸类物质在土壤中积累是引起作物连作障碍的主要原因,对次年作物生长和土壤活性具有破坏性的影响,具有重要的研究意义[26-27]。
本试验以两种酚酸类化感物质肉桂酸和咖啡酸为研究对象,以蔬菜类植物莴苣为受体,采用植物生理学的方法,系统研究了肉桂酸和咖啡酸对莴苣幼苗生长指标以及对莴苣根部细胞活力和活性氧方面的影响,并比较和分析了2种酚酸类化合物作用效果的差异。结果显示,不同浓度下的肉桂酸均对莴苣幼苗根长、茎长及鲜重等生长指标产生明显的抑制作用;咖啡酸对莴苣幼苗根长和茎长均表现出低浓度(0.1、1.0和10 μmol/L)促进、高浓度(100和1 000 μmol/L)抑制的活性作用模式,且高浓度下肉桂酸对幼苗生长的抑制作用明显强于咖啡酸。
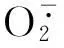
本研究有关细胞活性和活性氧累积的观察结果表明,在较高浓度(100和1 000 μmol/L)的肉桂酸和咖啡酸作用下,莴苣根尖端大部分细胞失去活力。低浓度(0.1和1.0 μmol/L)的肉桂酸和较低浓度(0.1、1.0和10 μmol/L)的咖啡酸对莴苣根部的活性氧积累均无明显影响;当肉桂酸处理浓度大于10 μmol/L及咖啡酸处理浓度大于100 μmol/L时,随着浓度的增大莴苣根部活性氧的积累大量增多。据此可以初步推测莴苣幼苗在两种酚酸类化感物质的胁迫作用下会诱导活性氧的产生和积累,而活性氧的积累会进一步导致细胞膜结构和功能的破坏以及细胞活力的下降,最终影响受体植株的生长发育。
本研究通过对肉桂酸和咖啡酸化感作用机理的探索,初步阐释了酚酸类物质对受体植物化感作用的植物生理学机理,并分析了不同结构酚酸类物质作用效果差异的原因,可为进一步揭示酚酸类物质化感作用以及作物连作障碍机理提供方法和依据。
参考文献:
[1]MOLISCH H.Der einfluss einer pflanze auf die andere,allelopathie[M].Jena:Verlag Von Gustav Fischer,1937:13-20.
[2]RICE E L.Allelopathy,2nd ed[M].Orlando:Academic Press,1984:34-42.
[3]李雪利,李正,等.植物化感作用研究进展[J].中国农学通报,2009,25(23):142-146.
LI X L,LI Z,etal.Advances on allelopathy of plants[J].ChineseAgriculturalScienceBulletin,2009,25(23):142-146.
[4]张重义,林文雄.药用植物的化感自毒作用与连作障碍[J].中国生态农业学报,2009,17(1):189-196.
ZHANG Z Y,LIN W X.Continuous cropping obstacle and allelopathic autotoxicity of medicinal plants[J].ChineseJournalofEco-Agriculture,2009,17(1):189-196.
[5]柴强,黄高宝.植物化感作用的机理、影响因素及应用潜力[J].西北植物学报,2003,23(3):509-515.
CHAI Q,HUANG G B.Review on action mechanism affecting factors and applied potential of allelopathy[J].ActaBot.Boreal.-Occident.Sin.,2003,23(3):509-515.
[6]杨甲月,燕志强,等.瑞香狼毒根中活性物质的分离鉴定及作用机理[J].西北植物学报,2011,31(2):291-297.
YANG J Y,YAN Z Q,etal.Isolation of plant growth inhibitory components from the root ofStellerachamaejasmeand function mechanism[J].ActaBot.Boreal.-Occident.Sin.,2011,31(2):291-297.
[7]谢星光,陈晏,等.酚酸类物质的化感作用研究进展[J].生态学报,2014,34(22):6 417-6 428.
XIE X G,CHEN Y,etal.A review of allelopathic researches on phenolic acids[J].ActaEcologicaSinica,2014,34(22):6 417-6 428.
[8]INDERJIT K M.Plant phenolics in allelopathy[J].Bot.Rev.,1996,62:186-202.
[9]吴凤芝,赵凤艳,马凤鸣.酚酸物质及其化感作用[J].东北农业大学学报,2001,32(4):313-319.
WU F Z,ZHAO F Y,MA F M.Phenolic acid substances and allelopathy mechanisms[J].JournalofNortheastAgriculturalUniversity,2001,32(4):313-319.
[10]LI Z H,WANG Q,RUAN X,etal.Phenolics and plant allelopathy[J].Molecules,2010,15:8 933-8 952.
[11]陈绍莉,等.嫁接对茄子根系分泌物中肉桂酸和香草醛的调节效应[J].应用生态学报,2008,19(11):2 394-2 399.
CHEN S L,etal.Regulation effects of grafting on cinnamic acid and vanillin in eggplant root exudates[J].ChineseJournalofAppliedEcology,2008,19(11):2 394-2 399.
[12]BAZIRAMAKENGA R,etal.Effects of benzoic and cinnamic acids on membrane permeability of soybean roots[J].J.Chem.Ecol.,1995,10:1 271-1 285.
[13]王茹华,浦洪欣,等.肉桂酸对黄瓜的化感效应研究[J].黑龙江八一农垦大学学报,2015,27(3):14-16.
WANG R H,PU H X,etal.Allelopathic effect of cinnamic acid on cucumber[J].JournalofHeilongjiangBayiAgriculturalUniversity,2015,27(3):14-16.
[14]陈龙,李建东,等.几种酚酸对大豆种子萌发的化感效应[J].种子,2011,30(5):83-86.
CHEN L,LI J D,etal.Allelopathy effect of several phenolic acids on seed germination of soybean[J].Seed,2011,30(5):83-86.
[15]李夏,周宝利,等.茄子自毒物质对辣椒种子萌发及枯萎菌的化感效应[J].生态学报,2009,29(2):960-965.
LI X,ZHOU B L,etal.Effects of the autotoxic substance in eggplants on pepper seed germination andFusariumoxysporumf sp.[J].ActaEcologicaSinica,2009,29(2):960-965.
[16]EIUHELLIG F A.Mechanism of action of allelochemicals in allelopathy[J].Allelopathy,1995,1:97-115.
[17]ALSAADAWI I S,AI-HADITHY S M,etal.Effects of three phenolic acids on chlorophyll content and ions uptake in cowpea seedlings[J].JournalofChemicalEcology,1986,12(1):221-227.
[18]BATISH D R,SINGH H P,KAUR S,KOHLI R K,YADAV S S.Caffeic acid affects early growth,and morphogenetic response of hypocotyl cuttings of mung bean (Phaseolusaureus)[J].JournalofPlantPhysiology,2008,165(3):297-305.
[19]KOODKAEW I,SUNOHARA Y,MATSUYAMA S,etal.Phytotoxic action mechanism of hapalocyclamide in lettuce seedlings[J].PlantPhysiologyandBiochemistry,2012,58(9):23-28.
[20]GARNCZARSKA M.Response of the ascorbate-glutathione cycle to re-aeration following hypoxia in lupine roots[J].PlantPhysiologyandBiochemistry,2005,43(6):583-590.
[21]LIN Z F,LIU N,LIN G Z,etal.In situ localization of superoxide generated in leaves ofAlocasiamacrorrhiza(L.) Shott under various stresses[J].J.PlantBiol.,52:340-347.
[22]田敏,饶龙兵,李纪元,等.植物细胞中的活性氧及其生理作用[J].植物生理学通讯,2005,41(2):235-241.
TIAN M,RAO L B,LI J Y.Reactive oxygen species (ROS) and its physiological functions in plant cells[J].PlantPhysiologyCommunications,2005,41(2):235-241.
[23]OVERMYER K,BROSCHE M,KANGASJARVI J.Reactive oxygen species and hormonal control of cell death[J].TrendsinPlantscience,2003,8(7):335-342.
[24]李翔,杨顺义,等.黄花棘豆水提液对燕麦的化感作用及其机理研究[J].西北植物学报,2011,31(7):1 367-1 375.
LI X,YANG S Y,etal.Allelopathy and its mechanism of extract solution ofOxytropisochrocephalaonAvenasativa[J].ActaBot.Boreal.-Occident.Sin.,2011,31(7):1 367-1 375.
[25]MANOEL B A,ROSEANE C S,LIZIANE M L,etal.Allelopathy,an alternative tool to improve cropping systemsA.review[J].AgronomyforSustainableDevelopment,2011,12(31):379-395.
[26]杨期和,叶万辉,等.植物化感物质对种子萌发的影响[J].生态学杂志,2005,24(12):1 459-1 465.
YANG Q H,YE W H,etal.Effects of allelochemicals on seed germination[J].ChineseJournalofEcology,2005,24(12):1 459-1 465.
[27]赵春贵,张立伟,等.肉桂酸及其衍生物抗氧化活性研究[J].食品科学,2005,26(1):218-222.
ZHAO C G,ZHANG L W,etal.Study on anti-oxidation effects of cinnamic acid and its derivants[J].ChineseFoodScience,2005,26(1):218-222.
[28]LI H H,MASAFUMI I,etal.Interactions of trans-cinnamic acid,its related phenolic allelochemicals,and abscisic acid in seeding growth and seed germination of lettuce[J].JournalofChemicalEcology,1993,19(8):1 775-1 787.
[29]WANG X X,ZHANG T L,DAI C C.Advance in mechanism and countermeasures of peanut succession monocropping obstacles[J].Soils,2010,42(4):505-512.
[30]王丹丹,杨建设,等.绿原酸对莴苣生长的化感作用及其机理研究[J].西北植物学报,2014,34(5):957-962.WANG D D,YANG J S,etal.Allelopathy effect and mechanism of chlorogenic acid on the growth of lettuce[J].ActaBot.Boreal.-Occident.Sin.,2014,34(5):957-962.

图版 ⅠFDA和PI双染色后肉桂酸和咖啡酸处理莴苣根尖细胞活力观察
根尖的灰色部位代表失去活力的细胞;1~6.肉桂酸浓度分别为0、0.1、1.0、10、100和1 000 μmol/L;7~12.咖啡酸处理浓度分别为0、0.1、1.0、10、100和1 000 μmol/L。
Plate ⅠCell viability of lettuce root tips treated by cinnamic acid and caffeic acid after dyeing with FDA and PI
The gray zone of root tips represented cells without viability;Fig.1-6.The concentrations of cinnamic acid were 0,0.1,1.0,10,100 and 1 000 μmol/L,respectively.Fig.7-12.The concentrations of caffeic acid were 0,0.1,1.0,10,100 and 1 000 μmol/L,respectively.
图版 ⅡDHE染色后肉桂酸和咖啡酸处理莴苣根部活性氧积累观察
根部的橘红色部位代表积累活性氧的细胞;1~6.肉桂酸浓度分别为0、0.1、1.0、10、100和1 000 μmol/L;7~12.咖啡酸浓度分别为0、0.1、1.0、10、100和1 000 μmol/L。
Plate ⅡEffects of cinnamic acid and caffeic acid on ROS production in lettuce roots dyeing with DHE
The orange red zone of roots represented cells that accumulating ROS;Fig.1-6.The concentrations of cinnamic acid were 0,0.1,1.0,10,100 and 1 000 μmol/L,respectively;Fig.7-12.The concentrations of caffeic acid were 0,0.1,1.0,10,100 and 1 000 μmol/L,respectively.
(编辑:裴阿卫)
Allelopathic Effect and Mechanism of Cinnamic Acid and Caffeic Acid on the Growth of Lettuce
GUO Kai1,2,YAN Zhiqiang2,JIN Hui2,LI Xiuzhuang2,
HE Xiaofeng2,YANG Xiaoyan2,QIN Bo2*
(1 University of Chinese Academy of Sciences,Beijing 100049,China;2 Key Laboratory of Chemistry of Northwestern Plant Resources and Key Laboratory for Natural Medicine of Gansu Province,Lanzhou Institute of Chemical Physics,Chinese Academy of Sciences,Lanzhou 730000,China)
Abstract:In this paper,we investigated the allelopathic effects of cinnamic acid and caffeic acid and their phytotoxic mechanism on lettuce seedlings,in order to reveal the mechanism of allelopathy by phenolic acids.The results showed that:(1)root length,shoot length and fresh weight of lettuce seedlings were all obviously inhibited by cinnamic acid at different concentrations,and the inhibition rate of root length,shoot length and fresh weight at concentration of 1 000 μmol/L was 89%,74% and 49%,respectively.Root length and shoot length of lettuce seedlings both were promoted at low concentration (0.1,1.0 and 10 μmol/L) and inhibited at high concentration (100 and 1 000 μmol/L) by caffeic acid.Besides,the growth inhibition of cinnamic acid on lettuce seedlings was obviously stronger than that of caffeic acid at high concentration.(2)Cinnamic acid and caffeic acid both had no significant effect on cell viability in lettuce root tips at low concentration (0.1,1.0 and 10 μmol/L).High concentration (100 and 1 000 μmol/L) of cinnamic acid and caffeic acid both significantly increased the number of dead cells.(3)Low concentration of cinnamic acid (0.1 and 1.0 μmol/L) and caffeic acid (0.1,1.0 and 10 μmol/L) both had no significant effect on the accumulation of reactive oxygen species (ROS).When the concentration of cinnamic acid was over 10 μmol/L and the concentration of caffeic acid was over 100 μmol/L,the accumulation of ROS increased rapidly with the increasing of concentration.ROS was induced and accumulated in lettuce seedlings under the stress of cinnamic acid and caffeic acid,which leaded to the reduction of cell viability and finally affected the growth and development of lettuce seedlings.Furthermore,the inhibition effect of cinnamic acid was significantly stronger than that of caffeic acid.
Key words:cinnamic acid;caffeic acid;lettuce;allelopathic effect;mode of action
中图分类号:Q942.5;Q945.7
文献标志码:A
作者简介:郭凯(1990-),男,硕士研究生,主要从事植物活性物质的分离分析及作用机理研究。E-mail:guokaidts@163.com*通信作者:秦波,研究员,主要从事植物化学生态学基础与应用研究。E-mail:bqin@licp.cas.cn
基金项目:国家自然科学基金(31070386,21302195,31300290);中国科学院兰州分院甘肃省院地合作项目;甘肃省农业生物技术研究与应用开发项目(GNSW-2015-25)
收稿日期:2015-08-11;修改稿收到日期:2015-10-07
文章编号:1000-4025(2016)01-0093-07
doi:10.7606/j.issn.1000-4025.2016.01.0093
