外源Spd预处理对甜瓜白粉病抗性及其内源多胺的诱导分析
2016-03-23刘长命杨瑞平莫言玲王永琦郑俊鶱
刘长命,杨瑞平,莫言玲,王永琦,郑俊鶱,张 显*
(1 商洛学院,陕西商洛 726000;2 西北农林科技大学 园艺学院,陕西杨陵 712100)
外源Spd预处理对甜瓜白粉病抗性及其内源多胺的诱导分析
刘长命1,杨瑞平2,莫言玲2,王永琦2,郑俊鶱2,张显2*
(1 商洛学院,陕西商洛 726000;2 西北农林科技大学 园艺学院,陕西杨陵 712100)
摘要:以甜瓜感病品种‘0544’为试材,测定外源亚精胺(Spd)预处理和白粉病菌接种后甜瓜幼苗的光合参数、抗氧化酶活性、内源多胺含量及多胺合成与代谢相关基因表达等的变化,探讨外源Spd处理对甜瓜幼苗白粉病抗性的诱导作用机制。结果显示:(1)1.0 mmol·L-1外源Spd处理可显著降低甜瓜幼苗的白粉病病情指数,缓解植株发病症状;(2)外源Spd处理可诱导甜瓜幼苗的多胺合成以及代谢相关基因(SAMDC、ADC、ODC、Spd、Spm、PAO)显著上调表达;(3)外源Spd处理可诱导甜瓜幼苗腐胺(Put)和Spd含量显著增加,而外源Spd并接种白粉病菌处理对甜瓜幼苗精胺(Spm)含量积累的诱导更加显著;(4)接种白粉病菌诱导了甜瓜幼苗的多酚氧化酶 (PPO)、过氧化物酶(POD)和超氧化物歧化酶(SOD)的活性,外源Spd预处理后再接种白粉病的诱导作用更大,同时外源Spd处理还诱导了甜瓜幼苗过氧化氢(H2O2)含量的升高;(5)在观测期(120 h)内,接种白粉病菌对甜瓜叶片的光合作用抑制较小,而外源Spd预处理并接种白粉病菌共同诱导了甜瓜幼苗的光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)的显著升高。研究认为,在外源Spd预处理甜瓜幼苗后再接种白粉病菌,甜瓜幼苗可以通过多胺的快速积累及代谢产生的H2O2来启动响应机制,进而通过增强防御酶活性等途径来提高对白粉病的抗性。
关键词:亚精胺;病情指数;防御酶活性;光合参数;基因表达
白粉病作为甜瓜(Cucumismelo)一种世界性真菌病害,可造成植株光合能力下降、早衰,甚至死亡,给世界各国的甜瓜生产造成了重大损失。同时,大量农药的滥用易导致病菌产生耐药性,对环境也会造成严重污染。利用诱抗剂诱导植物产生系统获得抗性(systemic acquired resistance,SAR)来防治病害,具有抗病谱广、有效期长和不易产生耐药性等特点,是一种具有较大潜力的植物病害防治方法。
多胺(PAs)是一类广泛存在于高等植物中的具有很强生理活性的含氮碱,与植物的生长发育和抗逆性密切相关。研究表明,在植物受胁迫前或胁迫中施用外源多胺,可以诱导植物体通过调控多种途径来缓解胁迫压力,如降低自由基和过氧化氢的含量、保护细胞膜的完整性、调控相关基因的表达、增加抗氧化酶的活性等[1-2]。亚精胺(Spd)属于多胺类化合物中的三胺,由腐胺经过加入氨丙基残基逐步形成。研究发现,Spd在植物响应非生物胁迫和生物胁迫中起着重要的作用。如在大麦感染叶锈病真菌(Pucciniahordei)后,多胺特别是Spd在被感染叶片中出现了快速的响应积聚[3];外源Spd不但能诱导黄瓜对盐胁迫和冷胁迫等非生物胁迫的抗性[4],还能提高黄瓜对灰霉病[5]和白粉病[6]等生物胁迫的抗性,有效降低其发病病情指数。作者课题组前期在对甜瓜幼苗进行外源Spd处理并接种白粉病菌的研究中也发现[7],外源Spd处理可以不同程度地诱导甜瓜幼苗对白粉病的抗性,并以1.0 mmol·L-1浓度效果最佳,且感病材料‘0544’的反应更敏感,但不同品种的抗病性强弱仍主要由遗传因素决定。同时还发现[8-9],在甜瓜与白粉病菌的互作中,多胺合成与代谢相关基因参与了白粉病的防御反应。然而,对甜瓜幼苗多胺含量变化与其抗病性的关系还不很清楚。因此,本研究以甜瓜感病品种‘0544’为试验材料,对其进行外源Spd处理并接种白粉病菌后的病情指数、光合特性、抗氧化酶活性以及多胺类基因表达和内源多胺含量变化等进行研究,以探讨多胺类物质在植物抵抗病原菌侵染中的作用机理,为甜瓜的白粉病防治提供理论依据。
1材料和方法
1.1试验材料
供试甜瓜栽培品种‘0544’[CucumismeloL.ssp.melo(Pang.) Greb]为白粉病感病品种;参试白粉病菌(Podosphaeraxanthii)采自田间甜瓜植株的自然感病叶片,经人工气候室扩繁而来。试剂Spd为Sigma公司产品,纯度≥99%,分子量145.25,为无色液体。
1.2材料培养与处理
1.2.1材料培养甜瓜种子经55 ℃消毒10 min后,室温下浸泡5 h,人工气候箱内催芽,培养环境条件为温度30 ℃/20 ℃(昼/夜)、光照16 h/8 h(光/暗)、相对湿度70%~85%。 待甜瓜幼苗第2片真叶完全展开时进行试验处理。
1.2.2外源Spd处理及接种试验共设喷水、喷水+接种、喷Spd、喷Spd+接种4个处理。待甜瓜幼苗第2片真叶完全展开时,于傍晚向叶面、叶背均匀喷施1.0 mmol·L-1浓度Spd溶液,布满叶片但不下滴为宜,每个处理用量50 mL(Spd浓度及用量为预实验筛选结果),对照植株叶片喷施等量蒸馏水,连续处理72 h后接种白粉病菌,4次重复。接种时,将白粉病菌孢子配成1×106孢子/L的悬浮液,加2%表面活性剂后进行喷雾接种,对照喷施等量蒸馏水,保湿24 h后,置相同生长环境管理。分别于接种后0、12、24、48、72和120 h取各处理第2片完全展开的真叶,液氮冷冻后-80 ℃保存备用。
1.3测定指标及方法
1.3.1病情指数分别于发病后第2天(接种后第8天)、第4天采用十字交叉法测量病斑的纵径、横径,取其平均值作为病斑的直径,病情分级标准同文献[7],病情指数按下式计算;同时于发病后第8天、第18天采用离体叶面积仪测定叶面积,病情指数按仪器采集病斑面积/叶片面积计算。
1.3.2光合气体交换参数利用便携式光合仪(Li-6400)于上午8:30~11:00进行光合气体交换参数测定,直接读出叶片净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)、蒸腾速率(Tr)等光合参数,水分利用效率(WUE)和气孔限制度(Ls)分别利用公式计算:WUE=Pn/Tr,Ls=1-Ci/Ca,Ca为空气CO2浓度。测定时使用红蓝LED光源,光强设定为800 μmol·m-2·s-1,每张叶片重复读数3次,3次重复。
1.3.3抗氧化酶活性和H2O2含量分别称取各处理叶片约0.5 g(分别计重),加入pH 7.8磷酸缓冲液(含1 mmol·L-1EDTA,2% PVP)8 mL研磨匀浆,4 ℃低温15 000 g离心30 min,上清液即为酶粗提液。H2O2含量以及过氧化氢酶CAT(EC1.11.1.6)、多酚氧化酶PPO(EC1.14.18.1)、过氧化物酶POD(EC1.11.1.7)和超氧化物歧化酶SOD(EC1.15.1.1)活性测定参照Kubis等[10]和李合生[11]的方法。
1.3.4多胺合成代谢相关基因表达分析总RNA提取参考OMEGA试剂盒(OMEGA,北京)的方法,260 nm下利用紫外分光光度计(V-550,JASCO,Japan)检测浓度,1%琼脂糖凝胶电泳检测RNA的完整性。取1 μg总RNA参考反转录试剂盒(MBI,USA)的方法合成第一链cDNA。实时定量表达分析利用qRT-PCR定量仪(Bio-Rad,USA)和SYBR®PremixExTaqTMⅡ(2×)试剂盒(日本,TAKARA),引物序列见表1。反应程序为:95 ℃预变性30 s;95 ℃变性20 s,60 ℃退火20 s,72 ℃延伸20 s,40个循环,以甜瓜Actin基因作为内参,3次重复。
1.3.5内源腐胺、亚精胺和精胺含量甜瓜叶片多胺含量测定参照Flores等[12]的方法,并稍做改进。称取约0.5 g叶片(单个计重),加入4 mL预冷的5%(V/V)高氯酸(PCA)冰上研磨匀浆;冰浴1 h后4 ℃低温15 000 g离心30 min,取500 μL上清液,加入1 mL NaOH(2 mol·L-1)和7 μL苯甲酰氯混匀,剧烈涡旋后37 ℃温浴30 min;然后向混合液里加入2 mL饱和NaCl溶液终止反应,再加入2 mL乙醚进行萃取,1 500 g离心5 min,取1 mL乙醚相蒸发干燥,溶于400 μL色谱级甲醇中待测。3种多胺(腐胺、亚精胺、精胺)的标样先配置成1.0 mmol·L-1的储存液,各取40 μL按样品相同的处理方法进行苯甲酰化。多胺测定利用高效液相色谱法(LC-2010AHT,Japan;C18反相柱,直径4.6 mm,长150 mm,粒径5 μm),进样10 μL,柱温25 ℃,流速0.7 mL·min-1,流动相为64%甲醇,在230 nm紫外下检测吸收峰值。做标准曲线时,以Sigma公司产品做标样,分别取苯甲酰化后的多胺标准液0.1、0.2、0.3、0.4 nmol·μL-1进样,以峰面积对进样量作曲线,计算相关性系数。
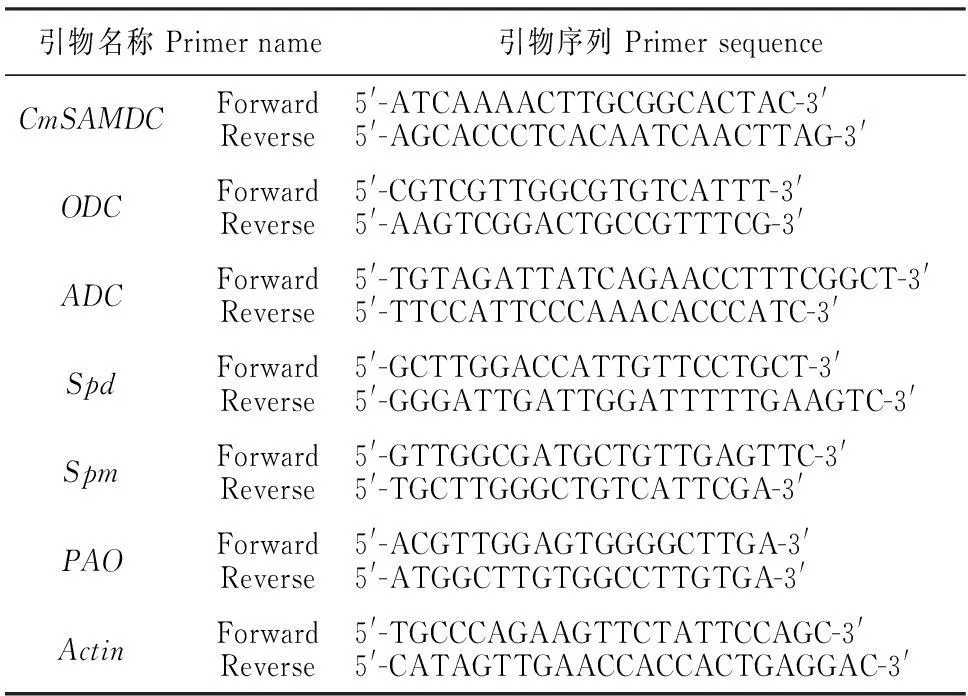
表1 实时定量PCR所用引物列表
1.4数据处理
运用SPSS 22.0软件进行数据处理分析,用Excel和Photoshop软件作图。
2结果与分析
2.1外源Spd处理对甜瓜植株白粉病发病的影响
图1显示,甜瓜感病品种‘0544’在喷施1.0 mmol·L-1Spd并接种白粉病菌后,其叶片病情指数在喷施Spd处理下比对照(喷水+接种白粉菌)显著降低,叶片白粉病斑数量也较对照明显减少。其中,在接种后第8天,喷水+接种处理植株下部第2片叶病情指数达0.25,为Spd处理+接种处理植株的近2倍,上部第2片叶的病情指数也明显高于Spd处理的植株(图1,A、B);在接种后第18天,喷水+接种处理植株的下部第2片叶的病情指数近0.9,上部第2片叶也达0.4,而Spd处理+接种植株相应叶片的病情指数则分别为0.7和0.3,病情指数分别比喷水对照降低了16%和10%(图1,B)。可见,喷施1.0 mmol·L-1外源Spd能显著诱导增强感病甜瓜品种幼苗对白粉病的抗性。
2.2外源Spd处理对接种甜瓜幼苗叶片光合气体交换参数的影响
从表2可知,单独Spd处理(Spd)或喷水后接种(H2O+PM)早期(120 h内)对甜瓜幼苗叶片净光合速率(Pn)影响不大,但喷施外源Spd并接种白粉病菌处理(Spd+PM)植株的Pn在接种后72 h时显著高于喷水后接种植株,并在接种后120 h时显著高于其余处理,而其余处理间无显著差异。
同时,气孔导度(Gs)的变化规律在喷亚精胺后接种和喷水后接种处理中与Pn相似,不同之处在于,喷水后接种的植株Gs除在处理24 h较对照(H2O)呈显著上升外,其他处理时间均与对照无显著差异。胞间CO2浓度(Ci)与Gs的变化趋势基本一致。另外,Spd处理后再接种能显著提高甜瓜幼苗的蒸腾速率(Tr),与各处理时间对照植株以及处理72和120 h喷水后接种的植株差异均达到了显著性水平,而其水分利用效率(WUE)与气孔限制值(Ls)却低于对照植株,并在接种后72 h内呈显著性差异水平。总之,单接种白粉病或Spd处理对感病甜瓜幼苗的光合参数影响较小,而在外源Spd处理和白粉病菌的共同作用下却能显著增强感病甜瓜幼苗的Pn、Gs和Tr。
2.3外源Spd处理对接种甜瓜幼苗叶片多胺类基因表达的影响
关于各处理植株叶片的多胺类基因表达分析发现(图2),各基因的表达水平均以单独外源Spd处理随处理时间的变化最为突出,其余处理变幅相对较小。
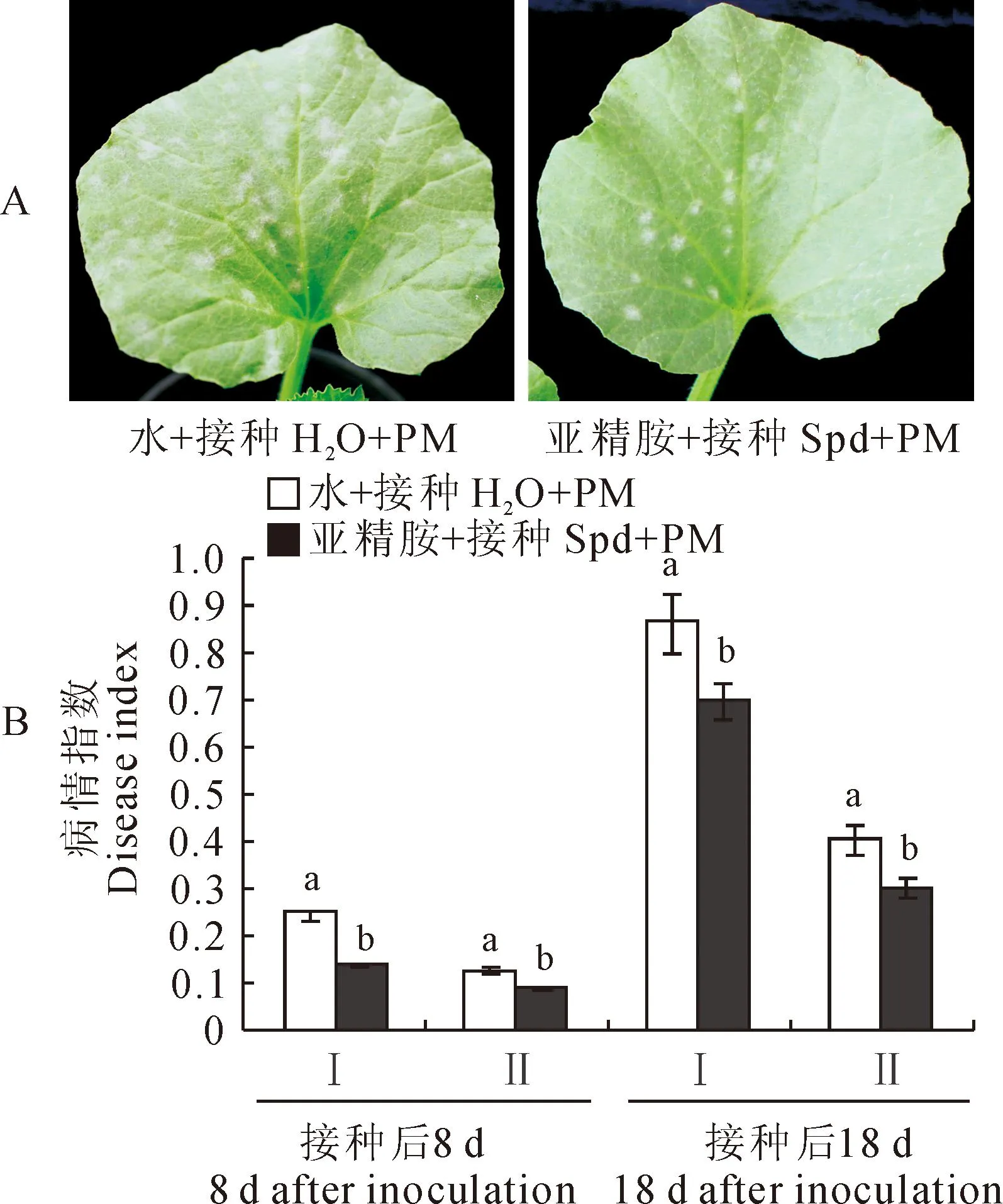
PM.白粉病菌接种,下同;A.接种后第8天的感病情况;
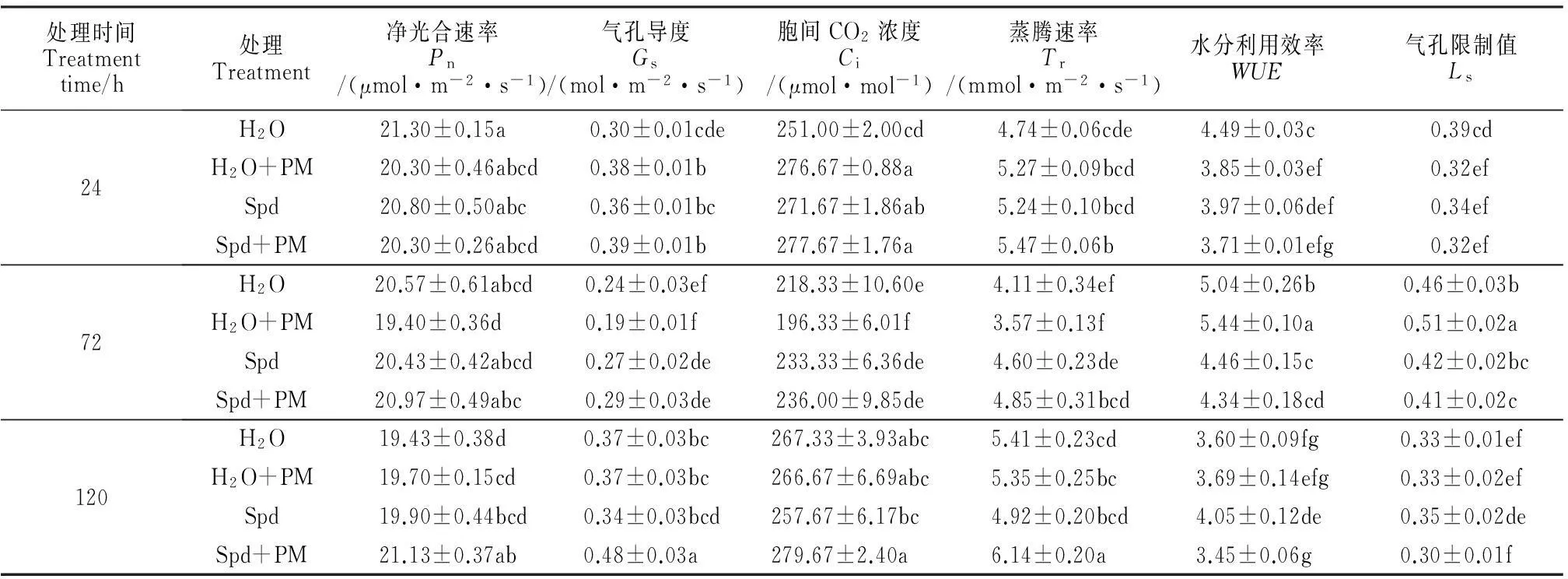
处理时间Treatmenttime/h处理Treatment净光合速率Pn/(μmol·m-2·s-1)气孔导度Gs/(mol·m-2·s-1)胞间CO2浓度Ci/(μmol·mol-1)蒸腾速率Tr/(mmol·m-2·s-1)水分利用效率WUE气孔限制值Ls24H2O21.30±0.15a 0.30±0.01cde251.00±2.00cd 4.74±0.06cde4.49±0.03c0.39cdH2O+PM20.30±0.46abcd0.38±0.01b276.67±0.88a5.27±0.09bcd3.85±0.03ef0.32efSpd20.80±0.50abc0.36±0.01bc271.67±1.86ab5.24±0.10bcd3.97±0.06def0.34efSpd+PM20.30±0.26abcd0.39±0.01b277.67±1.76a5.47±0.06b3.71±0.01efg0.32ef72H2O 20.57±0.61abcd0.24±0.03ef218.33±10.60e4.11±0.34ef5.04±0.26b0.46±0.03bH2O+PM19.40±0.36d0.19±0.01f196.33±6.01f3.57±0.13f5.44±0.10a0.51±0.02aSpd20.43±0.42abcd0.27±0.02de233.33±6.36de4.60±0.23de4.46±0.15c0.42±0.02bcSpd+PM20.97±0.49abc0.29±0.03de236.00±9.85de4.85±0.31bcd4.34±0.18cd0.41±0.02c120H2O19.43±0.38d0.37±0.03bc267.33±3.93abc5.41±0.23cd3.60±0.09fg0.33±0.01efH2O+PM19.70±0.15cd0.37±0.03bc266.67±6.69abc5.35±0.25bc3.69±0.14efg0.33±0.02efSpd19.90±0.44bcd0.34±0.03bcd257.67±6.17bc4.92±0.20bcd4.05±0.12de0.35±0.02deSpd+PM21.13±0.37ab0.48±0.03a279.67±2.40a6.14±0.20a3.45±0.06g0.30±0.01f
注:同列不同字母表示处理间在0.05水平存在显著性差异。
Note:The different normal letters in the same column indicate significant difference among treatments at 0.05 level.
就单独外源Spd处理而言,甜瓜SAMDC基因在处理24 h后迅速上调表达并达到峰值,达到喷水对照组的3倍多,随后在接种48 h快速下降后又呈上升趋势,在整个接种处理期间(120 h内)均呈高水平上调表达;其ADC基因表达情况与SAMDC基因类似,于处理24 h时明显上升到喷水对照的2.2倍,随后于处理120 h达到峰值,为喷水对照的3.7倍;而其ODC基因却在接种处理24 h时呈下调表达,并显著低于喷水对照,之后在处理48和120 h时出现2个高峰值,分别为喷水对照的4.3和4.4倍;其Spd合酶基因也于处理48和120 h时呈迅速上调表达,分别为喷水对照的4和8倍,而在处理24和72 h时下调表达;其Spm合酶基因在整个处理期均上调表达,于24 h达到峰值,为对照的12倍;其PAO基因在处理期间也呈不同程度上调表达,于处理24 h达到峰值,为对照的6倍多,且比其他处理都高,随后呈急剧下降趋势。同时,在喷施Spd并接种白粉病菌处理中,其叶片ADC和Spm合酶基因明显比喷水对照上调表达,均比喷水后接种处理表达水平要高;而其SAMDC和ODC基因表达水平在接种后72 h明显高于喷水后接种处理;其PAO基因除在24 h时比喷水后接种处理明显高外,之后表达量显著低于喷水后接种处理。此外,喷水后接种处理也在不同程度诱导了植株叶片多胺类基因的表达,但对代谢类基因的上调诱导比合成类基因更明显。总体上看,单独喷施外源Spd不同程度诱导了甜瓜幼苗叶片多胺合成与代谢相关基因的上调表达,而外源喷施Spd并接种白粉病菌促使植株维持较高的多胺合成类基因表达水平。
2.4外源Spd处理对接种甜瓜幼苗叶片3种多胺含量的影响
外源喷施Spd后增加了甜瓜幼苗叶片中3种内源多胺的含量,并以Put和Spd表现尤为明显(图3)。其中,图3,A显示甜瓜幼苗叶片内源Put含量在单独喷施Spd后48 h出现明显上升(为喷水对照的1.4倍),于72 h达到最高值,较喷水对照显著上升了67%;喷施Spd并接种条件下,接种白粉病菌抑制了外源Spd处理对叶片内源Put含量的促进效应,内源Put含量除在24 h时比其他处理高外,接种48 h后其含量总体低于其他处理;由图3,B可以看出,喷水后接种植株内源Put含量在接种24和120 h也表现出升高趋势。甜瓜幼苗叶片内源Spd含量在单独外源Spd处理后各时间点均出现了明显升高现象,接种72和120 h分别较喷水对照显著上升了44%和74%;而喷施外源Spd并接种处理植株的内源Spd含量在处理48 h之前显著高于其他处理,在48 h后低于或与其他处理持平;喷水后接种处理植株内源Spd含量只在处理72 h出现上升,其他时间点均无明显变化。图3,C显示,各处理甜瓜幼苗植株叶片内源Spm含量变化与前两者差异较大,其在单独外源喷施Spd处理下变化不显著,而在喷施Spd并接种白粉病处理植株中于接种48 h后呈显著升高,在喷水后接种处理的植株内于接种24、48和120 h后也都有显著性增加。以上结果表明,外源Spd处理可以显著诱导内源Put和Spd含量的累积,而内源Spm含量表现为在外源Spd处理并接种的双重诱导下上升更为明显。
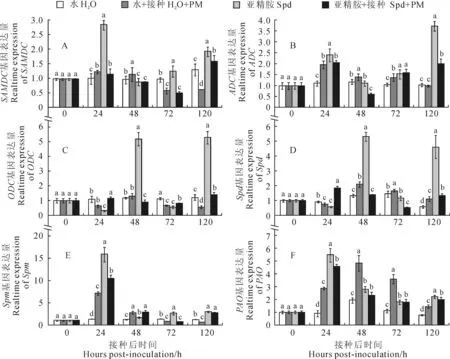
图2 外源亚精胺处理对甜瓜接种白粉病菌后多胺类基因表达的影响
2.5外源Spd处理对接种甜瓜幼苗叶片抗氧化酶活性及H2O2含量的影响
如图4所示,甜瓜幼苗叶片PPO活性在2个接种处理中均高于2个未接种处理,并且喷施Spd并接种处理引起了PPO活性升高的时间更早,于接种48 h即达到峰值,而喷水后接种植株则在接种72 h达最高值。幼苗叶片POD活性在未接种处理中随时间变化趋势相似,且均处于较低水平;其活性在喷水后接种处理中呈先下降后上升的趋势,而在喷Spd并接种处理的植株中一直维持较高的活性水平,在接种后期才逐渐趋于对照水平。幼苗叶片SOD活性在2个未接种处理中变化均不大,均呈缓慢下降趋势;在2个接种处理中均表现出上升→下降→再上升→再下降的趋势,并且在Spd处理并接种后24 h的SOD活性高于喷水后接种处理,在其他时间点2个接种处理的SOD活性基本接近。另外,幼苗叶片H2O2含量在喷水对照中相对稳定,其在喷水后接种处理植株中于整个接种期也均无明显峰值,但始终高于喷水对照。但2个外源Spd处理叶片H2O2含量随处理时间变化幅度较大,它们后处理24 h即出现明显上升,于处理48 h稍下降后,又于处理72 h同时达到峰值,且单独外源Spd处理植株基本高于同期喷施外源Spd后接种处理植株。
以上结果表明外源Spd处理不仅促进了内源多胺的生物合成,还可能引起多胺的降解,从而产生了更多的H2O2。并且,在喷水处理或外源Spd处理后再接种白粉病菌,均不同程度诱导了抗氧化酶活性的升高,尤以外源Spd处理后再接种的植株上升更为明显。
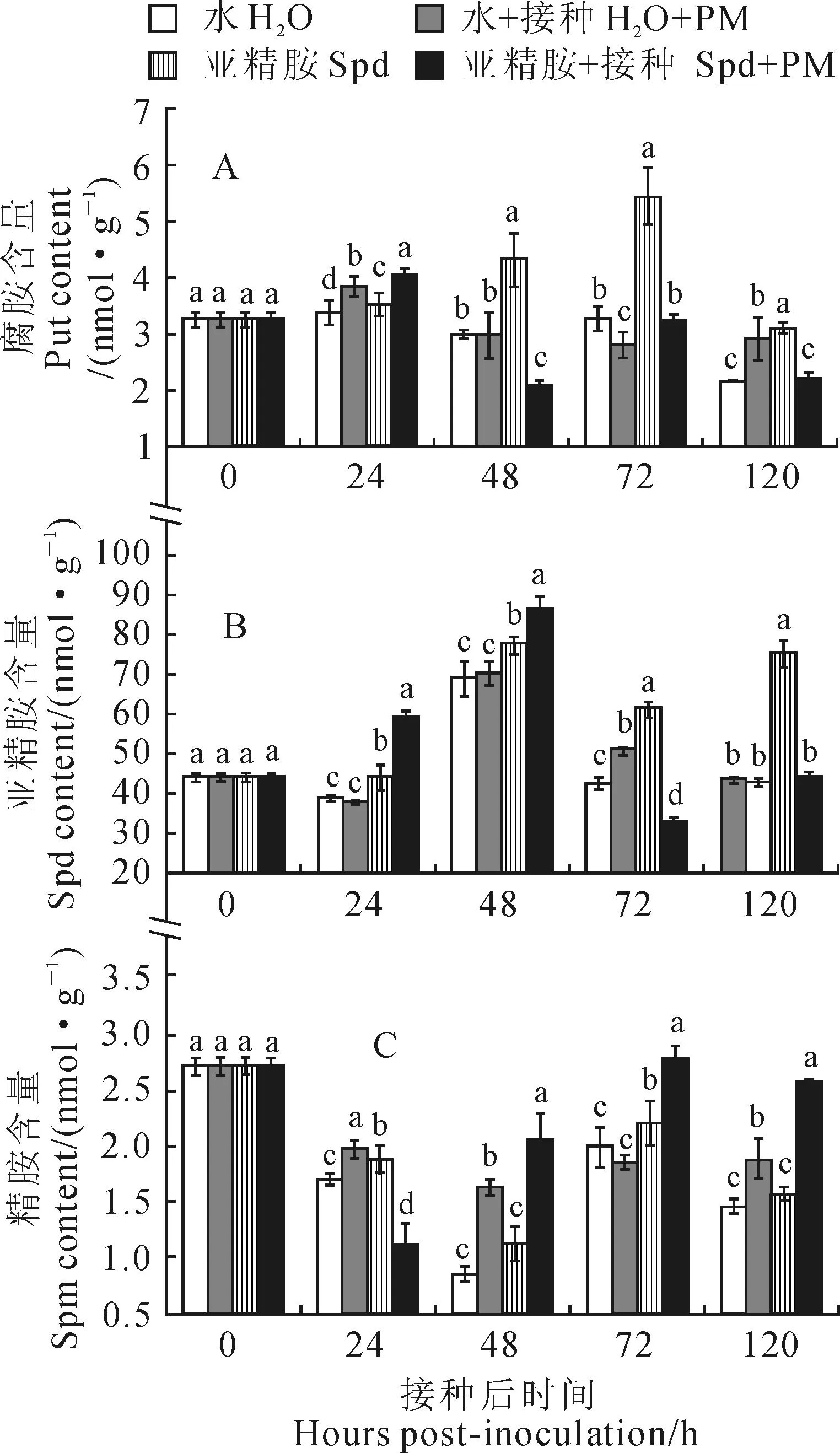
图3 外源亚精胺处理对甜瓜‘0544’接种
3讨论
通过外源化学制剂诱导植物抗病基因的表达,进而产生对病原菌的抵抗力,不仅可以解决由病原菌不断变异引起的抗性遗失,还可以解决农药滥用导致的环境污染问题。大量研究表明,多胺在植物抗逆中起着极其重要的作用,常被认为作为第二信使参与植物的抗逆反应过程[10,13-14]。然而,关于多胺在抵御病原菌侵染中的作用机理研究仅见到少量报道。Walters等研究白粉病菌(Blumeriagraminisf.sp.hordei)侵染大麦时发现,接种白粉病菌后引起大麦叶片中的多胺含量出现快速积累,而利用外源多胺,尤其是外源Spd能显著增强植物的抗性[15]。作者前期的研究也发现[9],抗性甜瓜品种在接种白粉病菌后48 h,一些抗性基因和多胺合成相关基因SAMDC出现了快速上调表达。本研究通过对感病甜瓜品种叶面喷施外源Spd处理表明,外源Spd处理诱导了甜瓜幼苗内源Put、Spd和Spm在基因表达水平和物质含量上的明显积累,尤其是Spd的含量及其基因表达量,并表现出感病叶片病情指数的显著降低,植株的发病症状得到了缓解。这与尚庆茂等[5]和于力等[6]在研究不同浓度外源Spd处理能显著增强黄瓜灰霉病及白粉病抗性的结果一致。本研究还发现,外源Spd处理后接种白粉病菌也诱导了多胺代谢相关基因PAO的显著上调表达,推测一方面与植物维持体内多胺合成与代谢平衡有关,分解体内过多的高级胺为二胺,另一方面可能通过多胺氧化酶活性的增加,分解多胺的同时积累大量H2O2,引起H2O2迸发,进而诱导早期的过敏反应。Yoda等[16]研究也表明,多胺氧化酶(PAO)在降解多胺时产生的H2O2参与了细胞壁大分子的交联和植物的过敏反应,诱导了植物的抗性基因表达。
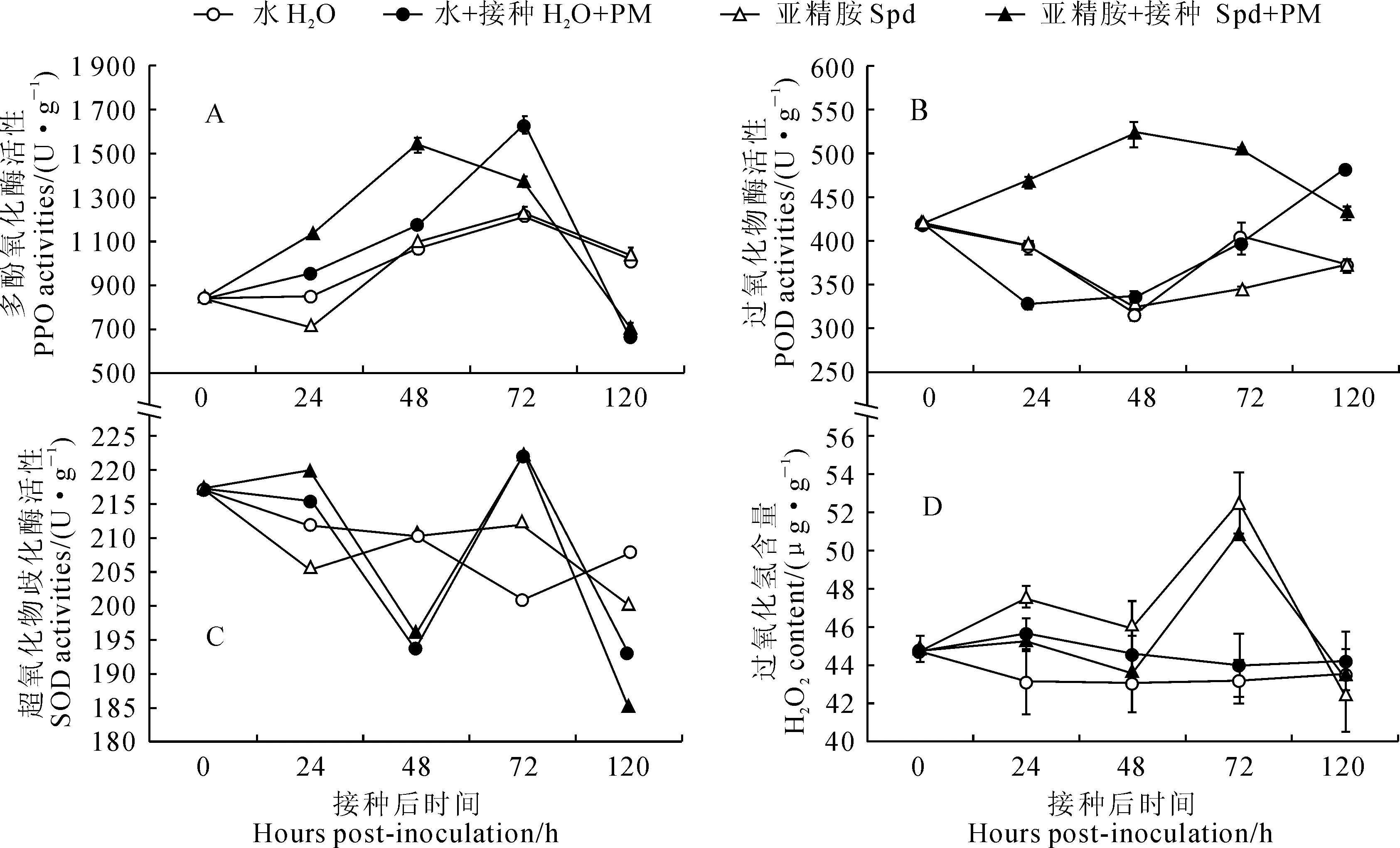
图4 外源亚精胺处理对甜瓜‘0544’接种白粉病菌后叶片抗氧化系统的影响
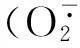
参考文献:
[1]YIU J C,JUANG L D,FANG D Y T,etal.Exogenous putrescine reduces flooding-induced oxidative damage by increasing the antioxidant properties of Welsh onion[J].ScientiaHorticulturae,2009,120:306-314.
[2]ZHANG W,JIANG B,LI W,etal.Polyamines enhance chilling tolerance of cucumber (CucumissativusL.) through modulating antioxidative system[J].ScientiaHorticulturae,2009,122:200-208.
[3]GREENLAND A J,LEWIS D H.Amines in barley leaves infected with brown rust and their possible relevance to formation of ‘green islands’[J].NewPhytologist,1984,96:283-291.
[4]尹璐璐,杨秀华,李坤,等.亚精胺预处理对黄瓜幼苗抗冷性的影响[J].园艺学报,2007,34(5):1 309-1 312.
YIN L L,YANG X H,LI K,etal.Effect of spermidine on chilling-tolerance in cucumber seedlings[J].ActaHorticulturaeSinica,2007,34(5):1 309-1 312.
[5]尚庆茂,张志刚.亚精胺对黄瓜幼苗灰霉病的诱抗作用[J].应用生态学报,2008,19(4):825-830.
SHANG Q M,ZHANG Z G.Roles of spermidine in induced resistance of cucumber seedlings toBitrytiscinereapers[J].ChineseJournalofAppliedEcology,2008,19(4):825-830.
[6]于力,郭世荣,阎君,等.亚精胺诱导黄瓜幼苗对白粉病抗性的研究[J].西北植物学报,2012,32(7):1 384-1 389.
YU L,GUO S R,YAN J,etal.Induction resistance to powdery mildew by spermidine in cucumber seedlings[J].ActaBot.Boreal.-Occident.Sin.,2012,32(7):1 384-1 389.
[7]咸丰.野生甜瓜[sp.Agrestis(Naud.) Greb.]抗白粉病的遗传机制和激素变化及其cDNA-AFLP分析[D].陕西杨陵:西北农林科技大学,2012.
[8]刘长命,咸丰,田治国,等.野生甜瓜‘云甜-930’与白粉病菌互作的基因表达特征[J].植物病理学报,2013,44(1):65-73.
LIU C M,XIAN F,TIAN Z G,etal.Analysis of gene expression profiling in the incompatible interaction between Chinese wild melon ‘Yuntian 930’ andPodosphaeraxanthii[J].ActaPhytopathologicaSinica,2013,44(1):65-73.
[9]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:1-20.
[10]FLORES H E,GALSTON A W.Analysis of polyamines in higher plants by high performance liquid chromatography[J].PlantPhysiology,1982,69(3):701-706.
[11]KUBIS J.Exogenous spermidine differentially alters activities of some scavenging system enzymes,H2O2and superoxide radical levels in water-stressed cucumber leaves[J].JournalofPlantPhysiology,2008,165(4):397-406.
[12]YAMAGUCHI K,TAKAHASHI Y,BERBERICH T,etal.Protective role for the polyamine spermine against drought stress inArabidopsis[J].BiochemicalandBiophysicalResearchCommunications,2007,35(2):486-490.
[13]YODA H,YAMAGUCHI Y,SANO H.Inductionof hypersensitive cell death by hydrogen peroxide produced through polyamine degradationin tobacco plants[J].PlantPhysiology,2003,132:1 973-1 981.
[14]WALTERS D R,WYLIE M A.Polyamines in discrete regions of barley leaves infected with the powdery mildew fungusErysiphegraminis[J].PhysiologiaPlantarum,1986,67:630-633.
[15]SHEN W Y,NADA K,TACHIBANA S.Involvement of polyamines in the chilling tolerance of cucumber cultivars[J].PlantPhysiology,2000,124(1):431-439.
[16]宋士清.化学物质对温室黄瓜幼苗盐胁迫、灰霉病逆境的诱抗作用及其机理研究[D].南京:南京农业大学,2006.
[17]YODA H,HIROI Y,SANO H.Polyamine oxidase is one of the key elements for oxidative burst to induce programmed cell death in tobacco cultured cells[J].PlantPhysiology,2006,142:193-206.
[18]裴斌,张光灿,张淑勇,等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J].生态学报,2013,33(5):1 386-1 396.
PEI B,ZHANG G C,ZHANG S Y,etal.Effects of soil drought stress on photosynthetic characteristics and antioxdant enzyme activities inHippophaerhamnoidesLinn.seedlings[J].ActaEcologicalSinica,2013,33(5):1 386-1 396.
[19]李伟,曹坤芳.干旱胁迫对不同光环境下的三叶漆幼苗光合特性和叶绿素荧光参数的影响[J].西北植物学报,2006,26(2):266-275.
LI W,CAO K F.Effects of drought stress on photosynthetic characteristics and chlorophyll fluorescence parameters in seedlings of terminthia paniculata grown under different light level[J].ActaBot.Boreal.-Occident.Sin.,2006,26(2):266-275.
[20]WU H,DONG H F,XU Y B.Studies on photosynthetic characteristics of tomato leaves after inoculation with tomato powdery mildew (Oidiumneolycopersici)[J].PlantDiseasesandPests,2011,2(2):9-11.
(编辑:裴阿卫)
Induction of Endogenous Polyamine Contents and Powdery Mildew Resistance by Exogenous Spermidine in Melon Seedlings
LIU Changming1,YANG Ruiping2,MO Yanling2,WANG Yongqi2,ZHENG Junxian2,ZHANG Xian2*
(1 Shangluo University,Shangluo,Shaanxi 726000,China;2 College of Horticulture,Northwest A&F University,Yangling,Shaanxi 712100,China)
Abstract:The effect of exogenous spermidine(Spd) on inducing resistance of Cucumis melo L.to powdery mildew was conducted with the susceptible cultivars ‘0544’,and the photosynthetic parameters,activities of antioxidant enzymes,contents of endogenous polyamines and the genes expression of polyamine synthesis and metabolism were tested in melon seedlings after pretreated with Spd then inoculated with powdery mildew.The results showed that:(1)1.0 mmol·L-1exogenous Spd could significantly reduce the disease index in melon seedlings resistance to powdery mildew and relieve the symptoms;(2)the genes related to polyamine syntheses and metabolism(SAMDC,ADC,ODC,Spd,Spm,PAO) were significantly induced by the exogenous Spd treatment during the seedling stage;(3)the contents of putrescine (Put) and spermine (Spd) were induced more significantly by the exogenous Spd while the spermine (Spm) content accumulated more by both the exogenous Spd treatment and powdery mildew inoculation;(4)the defense enzymes of melon seedlings such as polyphenol oxidase(PPO),peroxidase (POD) and superoxide dismutase(SOD) activities were induced after powdery mildew inoculation,with both the exogenous Spd treatment and powdery mildew inoculation.Meanwhile,the H2O2contents increased as well after the exogenous Spd treatment;(5)during the period of observation(120 h),the photosynthetic parameters were less affected after the powdery mildew inoculation.However,the photosynthetic rate(Pn),stomatal conductance(Gs) and transpiration rate (Tr) increased significantly by both the exogenous Spd treatment and powdery mildew inoculation.This study suggested that pretreatment melon seedlings with the exogenous Spd before powdery mildew inoculation could obviously improve the resistance of melon to powdery mildew,which might via rapid accumulation of PAs and H2O2contents metabolized form polymine,and then induced the activities of defense enzymes.
Key words:spermidine;disease index;defense enzyme activities;photosynthetic characteristics;gene expression
中图分类号:Q945.78
文献标志码:A
作者简介:刘长命(1980-),男,博士,讲师,主要从事园艺植物抗性育种研究。E-mail:liujie2061@163.com*通信作者:张显,教授,博士生导师,主要从事西甜瓜育种研究。E-mail:zhangxian098@126.com
基金项目:国家自然科学基金(K305021310);商洛学院博士启动项目(15SKY026)
收稿日期:2015-08-19;修改稿收到日期:2015-11-26
文章编号:1000-4025(2016)01-0085-08
doi:10.7606/j.issn.1000-4025.2016.01.0085
