转双价抗虫基因大白菜新种质的获得及其抗虫性分析
2016-03-23兰创业贾晓军
兰创业,刘 钊,贾晓军,周 进
(1 山西省农业科学院 蔬菜研究所,太原 030031;2 新疆建设兵团 第六师农业科学研究所,新疆五家渠市 831300)
转双价抗虫基因大白菜新种质的获得及其抗虫性分析
兰创业1,刘钊1,贾晓军2,周进2
(1 山西省农业科学院 蔬菜研究所,太原 030031;2 新疆建设兵团 第六师农业科学研究所,新疆五家渠市 831300)
摘要:采用超声波辅助花粉介导方法,将双价抗虫基因BmkIT-Chitinase导入早熟型大白菜自交系20-19-3,最终获得了5个转基因大白菜优良自交系纯合株系Z1-5、Z2-7、Z9-6、Z11-6和Z20-13;以转基因大白菜株系和非转基因对照植株为材料,对BmkIT-Chitinase基因在大白菜中的遗传规律、基因表达及抗虫性进行进一步分析。结果显示:(1)转化株后代多代(T1~T4) PCR、Southern blotting等分子跟踪检测表明,目的基因已成功导入受体植株,且能够稳定遗传;用该转基因方法对大白菜进行基因转化所获得的转基因植株分析显示,外源基因多数以多拷贝形式整合于核基因组,少部分外源基因以单拷贝形式整合。(2)Elisa 分析结果证明,所导入的外源基因可高效表达,T4代株系新鲜叶片中表达产物量最高达到0.069 μg·g-1左右。(3)转基因株系田间抗虫性统计分析表明,转化株系与对照在抗虫性方面有显著差异,其对小菜蛾及菜青虫抗性普遍提高2~3级。研究认为,转BmkIT-Chitinase基因大白菜中BmkIT-Chitinase基因的表达可有效提高大白菜的抗虫性。
关键词:大白菜;花粉介导;BmkIT基因;Chitinase基因;双价抗虫基因
大白菜(BrassicacampestrisL.ssp.pekinensis)起源于中国,又称结球白菜、白菜等,是中国乃至亚洲重要的栽培食用蔬菜之一。由于其富含维生素、糖、矿物质等营养成分,深受广大消费者喜食。但在大白菜的栽培过程中,虫害一直是影响其高产、稳产及品质的重要制约因素,其中,菜青虫(PierisrapaeL.)、菜螟(Hellulaundalis)和小菜蛾(Plutellaxylostella)等鳞翅目昆虫对其危害尤为严重[1]。由于白菜类蔬菜作物中缺乏有效的抗虫资源,无法通过常规手段培育出抗虫白菜类蔬菜作物品种[2]。因此通过生物技术手段对其进行抗虫基因转化及改造成为大白菜转基因育种研究的重要内容。
近年来,通过农杆菌介导等转基因方法,已经相继获得了转雪花莲凝集素基因[3]、马铃薯蛋白酶抑制剂基因[4]、豇豆胰蛋白酶抑制剂基因[5-6]、慈姑胰蛋白酶抑制基因[6]和苏云金芽孢杆菌基因[7]等抗虫大白菜新种质,但国内外最主要的、应用最广泛还是源自苏云金芽胞杆菌基因的转Bt杀虫晶体蛋白基因cry1Ab和cry1Ac白菜[7]。尽管如此,转基因抗虫大白菜与其它转基因抗虫作物(转Bt杀虫晶体蛋白基因玉米、棉花等)相比,其抗虫性普遍较差,这可能与抗虫目的基因在白菜类蔬菜作物中的表达水平偏低有关[1];另外,单抗虫基因的转化,抗虫谱较窄,它只对某几种或一小类害虫具有毒杀作用,易使害虫产生耐受性。因此,开发培育新型抗虫基因,联合使用2种或2种以上不同杀虫机制的抗虫基因对大白菜转化是极其重要的。
昆虫特异性蝎神经毒素是来源于东亚钳蝎神经毒素中的一种富含生物活性的多肽物质,其对昆虫有专一性麻痹致死作用,而对哺乳动物无害或毒性很小,因而被广泛应用于生物杀虫剂和抗虫转基因植物的研究[8]。在转蝎神经毒素基因抗虫植物研究方面,Barton等[9]首先将昆虫蝎毒素基因AaIT、BeIT1和BeIT2等转入烟草,表明了其对棉铃虫幼虫有较强的致死性。姚斌等[10]将蝎毒素基因AaIT基因转入烟草,监测到杀虫活性。Wu等[11]也将昆虫蝎毒素基因AaHIT基因转入棉花中,使其对棉铃虫的致死率到44%~98%。而对于鳞翅目昆虫而言,几丁质是其消化道内壁和身体表皮的重要组成部分,昆虫在蜕皮时分泌几丁质酶以分解几丁质,并蜕掉旧皮。如果将昆虫几丁质酶导入植物,使其在植物中持续表达,就会阻止入侵害虫的正常发育,从而起到保护植物的作用。在转昆虫几丁质基因抗虫植物研究方面,Gopalakrishnan等[12]首次将烟草天蛾几丁质酶基因插入苜蓿丫纹夜蛾核型多角体病毒中,使其对草地贪夜蛾半致死时间大大下降。Ding等[13]也将烟草天蛾几丁质酶基因通过农杆菌Ti质粒介导转化到烟草中,获得了抗烟蚜转基因植株,但对烟草天蛾幼虫抗虫性不明显。郝曜山等[14]将烟草夜蛾几丁质酶基因与东亚钳蝎神经毒素基因双价基因导入玉米中,所获得的转基因玉米植株对玉米螟表现出明显抗虫性。在转基因植物安全性日益受到重视的情况下,对这2种基因转化进行研究并完善,将会有良好的应用前景。
本研究通过自己发明的超声波辅助花粉介导的方法,将克隆构建的含有东亚钳蝎昆虫特异性神经毒素基因BmkIT[7]与具有广谱杀虫作用的烟草夜蛾几丁质酶基因Chitinase[7]的双价抗虫基因,导入早熟型大白菜自交系20-19-3中,获得了包含BmkIT和Chitinase基因的转基因植株,通过对转化株后代进行多代的PCR、Southern blotting等分子跟踪检测及田间抗虫性鉴定和观察,最终获得了稳定遗传的转BmkIT-Chitinase双价抗虫基因大白菜。并证实了转基因植株及其后代对2种鳞翅目昆虫的抗性作用,丰富了转基因大白菜抗虫材料。
1材料和方法
1.1试验材料
本研究所用受体材料为早熟型大白菜自交系20-19-3,株高40 cm,开展度35 cm×35 cm,生育期50 d,外叶绿色,叶肋成白色,黄心,在太原地区周年可以种植。由山西省农业科学院蔬菜研究所培育。
研究使用的农杆菌菌株为LBA4404,重组质粒pBI101-BmkIT-chi携有东亚钳蝎昆虫特异性神经毒素基因(BmKIT)、烟草夜蛾几丁质酶基因(Chitinase)及nptⅡ抗性基因等,载体所用的启动子为花椰菜花叶病毒的CaMV-35s启动子,终止子为Ti质粒中胭脂碱合成酶基因的终止序列nos,该菌株质粒由山西省农业科学院生物技术研究中心提供(图1)。
1.2转化和筛选
将经过低温春化处理的大白菜自交系20-19-3幼苗,于春天移栽入专用实验田,在其开花期每日上午10:00~11:00采集新鲜花粉,置于200 g/L蔗糖缓冲溶液中进行超声波预处理,超声波预处理参数为功率100 W,工作时间5 s,间隔15 s,工作5次。加入质粒DNA后,再次对花粉悬浮液进行超声波处理,处理功率150 W,其他参数同前。将处理好的花粉滴加100 mg/L硼酸和200 mg/L硝酸钙后快速涂抹于待转化柱头上,以促进其花粉萌发。授粉后用防虫网袋隔离并标记。
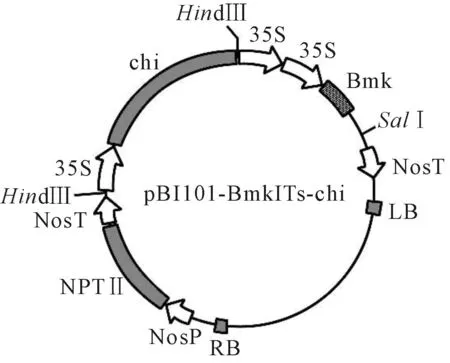
图1 质粒pBI101-BmkIT-Chitinase
将收获的T0代种子用70%酒精灭菌后播于铺有浸湿滤纸的培养皿中,卡那霉素发芽筛选浓度为150 mg /L,28 ℃下光照培养,3~4 d后根据其出芽情况,子叶及真叶颜色变化,初步筛选确定卡那霉素抗性苗,并将其移到营养钵中继续培养,待苗壮后于4℃下低温春化处理 1月,转到大盆并置于温室栽培,准备进行分子检测并通过蕾期授粉以收获种子得到自交后代。
1.3转化株DNA提取及PCR检测
取其嫩叶提取总DNA,提取DNA方法采用本单位改良的CTAB 法[15](提取缓冲液中加入0.5%乙基黄原酸钾,将NaCI的浓度提高至2.5 mol/L,可使大白菜提取的DNA浓度及质量大大提高)。使用提取的卡那霉素抗性植株DNA模板进行PCR 扩增,扩增过程中以未转化大白菜基因组DNA 为阴性对照,无菌水为空白对照,质粒为阳性对照。
Chitinase基因上游引物(5′-ATGCGAGCGA-CACTGG-3′)和下游引物(5′-TTGACATTCGCG-AGC-3′),扩增片段大小为1 800 bp。扩增采用20 μL体系,PCR扩增程序为95 ℃预变性5 min,94 ℃变性30 s,55 ℃退火1 min,72 ℃延伸2 min,35个循环,72 ℃终延伸10 min。PCR 产物4 ℃保存,1.0%琼脂糖凝胶电泳检测分析。
BmkIT基因上游引物(5′-ATGAAATTTTTC-CTTATA-3′)和下游引物(5′-TTAACCAATTAT-TTGGAC-3′),扩增片段大小为280 bp。扩增时采用20 μL体系,PCR扩增程序为95 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,35个循环,72 ℃终延伸10 min。保存PCR产物,经1.0%琼脂糖凝胶电泳检测分析。
将重复均扩增出2个外源基因阳性条带的植株确定为转化株。引物合成是由上海生工生物工程公司完成。
1.4转基因植株Southern blotting检测
将PCR 检测T2代呈阳性株的大白菜提取总DNA为待测样品,以非转基因大白菜DNA为阴性对照,阳性对照质粒DNA,用HindⅢ酶对待检测样品进行酶切,将酶切产物于1.2%琼脂糖凝胶上电泳分离,进行Southern blotting杂交检测。试验中,DNA探针分别使用外源基因Chi基因1 800 bp和Bmk基因280 bp的全长基因。Southern blotting试验按照Roche公司的DIG DNA Labeling and Detection Kit试剂盒的说明书进行。具体实验如DNA 变性、转移及杂交方法,杂交后用X-光片自显影曝光参照《分子克隆》[16]。
1.5转BmkIT-Chitinase基因白菜的Elisa检测
为对外源双价抗虫基因在受体内表达水平进行定量分析,选取Chitinase标准样品按每孔100 ng(1/10)n,n=1~10的标准稀释10个浓度梯度,作为阳性对照,以水为空白;以非转化大白菜蛋白为阴性对照,制作标准曲线。所有样品的405 nm光吸收值均取3次重复测定结果的平均值[17]。
1.6转化大白菜抗虫鉴定
(1)田间网室抗虫鉴定选取3代以上稳定遗传的转BmkIT-Chitinase基因白菜于专用温室内鉴定。材料于2014年4月播种育苗,待幼苗4叶1心后将其移栽入温室中,和非转基因对照白菜单行种植,每份材料种植重复3次。取羽化历期基本一致的小菜蛾成虫(雌雄各半)按虫苗比1∶10接虫。2~3周后对叶片危害情况进行调查。
(2)田间抗虫鉴定选取3代以上稳定遗传的转BmkIT-Chitinase基因白菜与非转基因大白菜,在实验田内双行相间种植,全生育期少打或不打农药防治,在春秋两季菜青虫高发期进行田间统计观察分析。
(3)实验室菜青虫饲喂实验选取3代以上稳定遗传的转BmkIT-Chitinase基因白菜与非转基因大白菜,在实验室培养皿内进行菜青虫饲喂实验。菜青虫为田内人工抓取,每培养皿接虫10条,放大小基本相同叶片饲喂12 h后拍照观察并分析统计。
以上鉴定方法均根据叶片的咬食情况分级,抗性分级参考王欣[18]的抗性调查方法和分级标准。咬食级:网室田间鉴定危害情况;0级无虫:全部叶片生长正常;1级有虫:叶片有轻微危害症状,有小孔,但小孔不相连;3级有虫:叶片危害症状较严重,叶片小孔相连,但叶片完整;5级有虫:叶片危害症状严重,叶片有大洞,但叶片基本完整或有大量叶片残余;7级有虫:叶片危害症状极为严重,叶片仅剩叶脉及不完整叶片。
2结果与分析
2.1转基因大白菜T0代种子的获得及其卡那霉素抗性初步筛选
将超声波处理过的含有外源基因双价抗虫基因表达构件pBI101-BmkIT-Chi的大白菜花粉,人工涂抹于待转化花序(蕾期)上。共处理大白菜30株,由于处理后的花粉萌发率较低,最终获得T0代种子6 000余粒。
转化获得的转BmkIT-Chitinase基因大白菜应同时被赋予卡那霉素抗性,本试验对T0代种子进行了卡那霉素抗性筛选。首先,分别将非转基因大白菜种子在铺有浸湿滤纸的培养皿中培养,浸湿滤纸附加卡那霉素浓度分别为0、50、100、150、200、250、300 mg/L[19],最终可以看到150 mg/L浓度正好可抑制全部非转基因大白菜的种子正常生长萌动后子叶发黄以至死亡(图2,A),因此,以浓度150 mg/L定为导入后代的卡那霉素抗性筛选浓度。最终在该浓度下T0代种子培养共获得T1代抗性苗57株。
2.2转基因大白菜PCR检测
将初步获得的卡那霉素抗性苗继续培养并移栽到温室。待苗壮后全部取样并提取总DNA进行PCR检测。重复3次。结果表明,T1代植株扩增出约为1 800 bpChitinase基因特异条带的阳性植株有26株,扩增出约280 bpBmkIT基因特异条带的阳性植株有31株,双基因同时被检测到的阳性植株为25株。PCR结果条带清晰,少有杂带,和阳性对照大小一致;阴性对照、水对照均未扩增出目的条带,双基因同时检出重合率较高,表明操作过程中无污染,结果可靠。图3为部分转基因株系的检测结果。
T1代双抗虫基因检测为阳性植株经蕾期人工自交授粉获得后代种子,经低温春化后继续种植获得T2代转基因大白菜,对其进行PCR检测,检测阳性植株继续种植,连续3代PCR跟踪(表1只列出了部分典型材料统计数据结果)。
从表1中可以看到,利用超声波辅助花粉介导法转化所获得的T1代株系在其后代多代PCR分子检测时,如果把所获得的目的性状外源基因作为显性性状的话,按照孟德尔分离规律理论,其T2、T3和T4代检测阳性比率在后代整个群体中性状分离比率应为3∶1、5∶1与9∶1,但在实际检验时其分离比率出现3种情况,如表1中Z1-5、Z2-7转化事件中,其检测结果后代分离比率与预期比率是基本拟合的,符合孟德尔遗传分离规律,但这部分材料只占所获得转化事件1/5;另一情况材料在所获得转化事件中占大多数,如Z2-3、Z5-1检测结果显示,其T2代似乎就已经高度纯合,检测结果阳性率远高于理论值,不符合孟德尔遗传,考虑到所使用的转基因方法,推测这些转化事件中,外源基因并不是以单拷贝存在,而是多拷贝,多整合位点存在;第三种情况只在个别转化事件中发现,如Z7-3。T2代材料检测中只表现出极低的阳性率,将阳性植株再种植到T3代时未能检测出阳性植株。

A.非转基因种子在150 mg/L浓度卡那霉素水溶液培养(CK1);B.T0代转化种子在150 mg/L浓度

转化事件No.ofsamplesT2(预期阳性率75%)T2generation(expectableratio75%)阳性率Requencyofpositiveresult/%χ2PT3(预期阳性率83%)T3generation(expectableratio83%)阳性率Requencyofpositiveresult/%χ2PT4(预期阳性率90%)T4generation(expectableratio90%)阳性率Requencyofpositiveresult/%χ2PZ1-580.41.30.25187.61.00.31393.51.00.301Z2-395.721.8097.212.80.00399.59.00.002Z2-765.24.60.03082.60.10.95088.50.10.738Z5-189.210.00.00187.50.90.32593.20.80.368Z7-310.5218.000--0--Z9-655.619.1075.43.90.04685.20.91.171

M.DL2000;P.阳性对照;B.空白水对照;N.阴性对照;(A)1~18、(B)1~15.转基因植株
2.3转基因大白菜Southern检测
对T2代PCR检测仍呈阳性的植株进行了Southern blotting杂交检测。检测结果表明(图4),PCR检测的25个转化事件中,有19个转化事件的后代检测到双基因特异性杂交信号。初步证明外源抗虫基因已经成功整合到了大白菜自交系基因组中。同时,Southern blotting杂交检测结果呈阴性,PCR检测结果呈阳性的几个转化事件在T3代PCR检测也均表现为阴性结果,再次证明了转化过程中存在少部分假阳性事件。而对Southern blotting杂交检测结果进行分析表明,用该转化方法对大白菜进行基因转化时,大部分转化事件为多拷贝、多位点整合到大白菜基因组中。
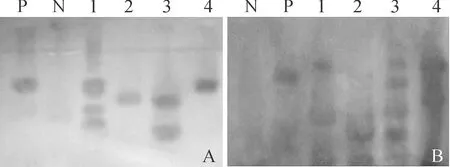
A.几丁质酶基因;B.蝎毒基因;P.质粒;
2.4转双价抗虫基因大白菜的Elisa检测
对T4代PCR及Southern blotting杂交双基因均呈阳性反应的转基因植株进行Elisa分析。基于导入的外源基因为双价抗虫基因,本研究只对导入的Chitinase基因进行了蛋白表达浓度测定。首先,用酶联免疫检测仪测定chi标准样品405 nm光吸收值,以蛋白质量浓度为横坐标,以405 nm光吸收值为纵坐标,应用SigmaPlot软件制作Elisa检测标准曲线[17],相关性分析表明,标准蛋白相关系数为0.992,线性回归方程为y=0.705x+0.004,之后,利用酶联免疫检测方法,分别对各转化事件后代纯合材料和阴性对照进行405 nm光吸收值测定,并根据标准曲线计算各被检样品的Chitinase蛋白浓度,部分结果如图5。
检测结果显示,来源于Z1-5转化事件中的 Z1-5-3株系,外源基因表达的几丁质酶表达量最高,鲜叶片含量达到0.069 μg·g-1。而在转化事件中占大多数的多拷贝、多整合位点的转化株(如表中Z2-3、Z5-1等)在该检测中表达量反而远低于单拷贝的转化株系(如Z1-5、Z2-7等),这也与后期虫试结果基本吻合。
2.5转双价抗虫基因大白菜抗虫性网室及田间观察鉴定
对所获得的经各代分子检测均为阳性,严格经过蕾期人工授粉所获得的转基因大白菜自交系T4代进行网室及田间抗虫性观察鉴定(图6)。统计分析显示(表2),各转化事件T4代植株抗虫性与对照相比有显著差异,其对小菜蛾及菜青虫抗性普遍提高2~3级,并且抗虫性能够稳定遗传。
从表2可以看到,各转化事件不仅与对照受体间在抗虫性方面差异达5%显著性水平,其相互之间也存在差异,如Z1-5、Z2-7和其他转化事件如Z9-6、Z19-1等相比,在抗虫性上也表现出很高的优势。图6可以直观看到部分转基因大白菜与对照在田间与实验室人工饲喂的结果差异显著。产生这种差异的原因和外源基因的插入位点、拷贝数的多少及外源基因在宿主细胞内表达量的多少相关。田间抗性结果与前期的分子检测结果基本吻合。
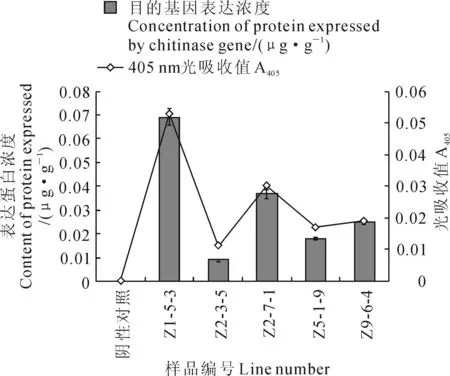
图5 部分转基因大白菜株系目的基因的Elisa检测结果
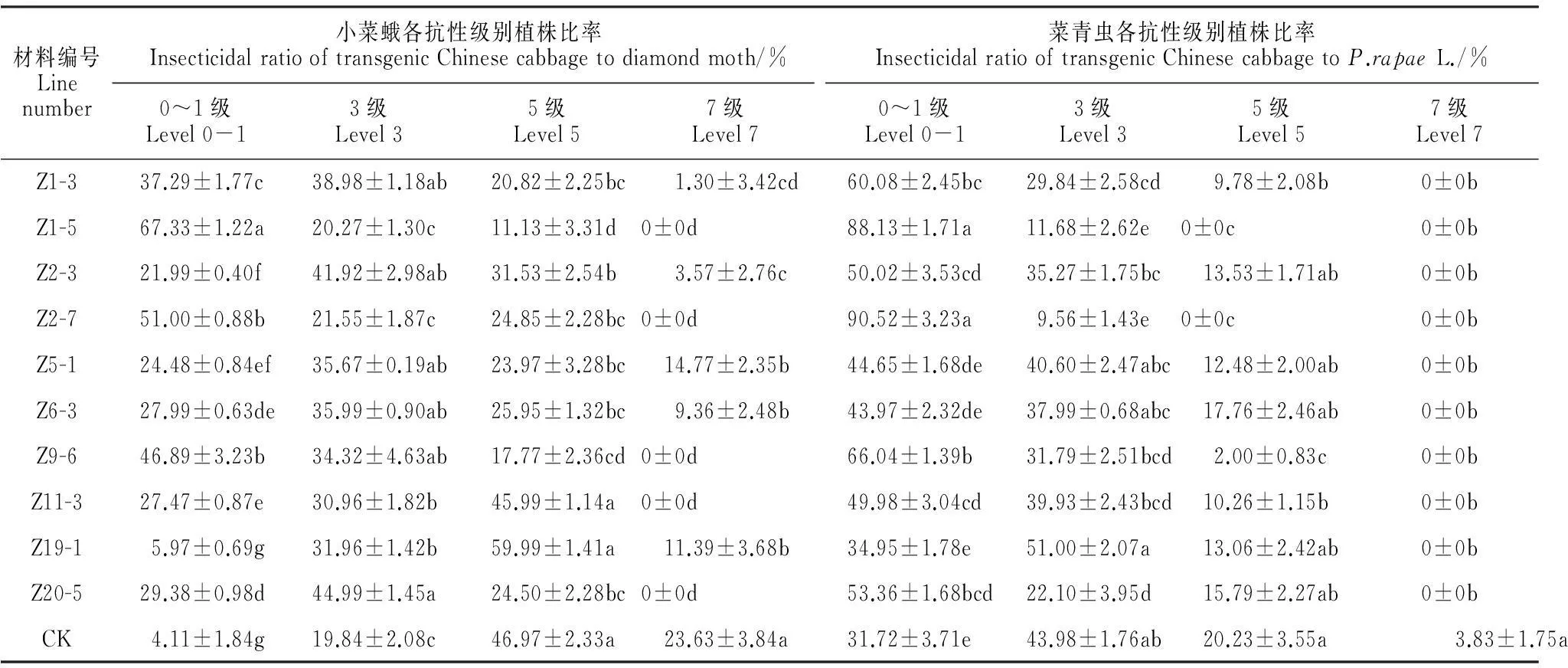
材料编号Linenumber小菜蛾各抗性级别植株比率InsecticidalratiooftransgenicChinesecabbagetodiamondmoth/%0~1级Level0-13级Level35级Level57级Level7菜青虫各抗性级别植株比率InsecticidalratiooftransgenicChinesecabbagetoP.rapaeL./%0~1级Level0-13级Level35级Level57级Level7Z1-337.29±1.77c38.98±1.18ab20.82±2.25bc1.30±3.42cd60.08±2.45bc29.84±2.58cd9.78±2.08b0±0bZ1-567.33±1.22a20.27±1.30c11.13±3.31d0±0d88.13±1.71a11.68±2.62e0±0c0±0bZ2-321.99±0.40f41.92±2.98ab31.53±2.54b3.57±2.76c50.02±3.53cd35.27±1.75bc13.53±1.71ab0±0bZ2-751.00±0.88b21.55±1.87c24.85±2.28bc0±0d90.52±3.23a9.56±1.43e0±0c0±0bZ5-124.48±0.84ef35.67±0.19ab23.97±3.28bc14.77±2.35b44.65±1.68de40.60±2.47abc12.48±2.00ab0±0bZ6-327.99±0.63de35.99±0.90ab25.95±1.32bc9.36±2.48b43.97±2.32de37.99±0.68abc17.76±2.46ab0±0bZ9-646.89±3.23b34.32±4.63ab17.77±2.36cd0±0d66.04±1.39b31.79±2.51bcd2.00±0.83c0±0bZ11-327.47±0.87e30.96±1.82b45.99±1.14a0±0d49.98±3.04cd39.93±2.43bcd10.26±1.15b0±0bZ19-15.97±0.69g31.96±1.42b59.99±1.41a11.39±3.68b34.95±1.78e51.00±2.07a13.06±2.42ab0±0bZ20-529.38±0.98d44.99±1.45a24.50±2.28bc0±0d53.36±1.68bcd22.10±3.95d15.79±2.27ab0±0bCK4.11±1.84g19.84±2.08c46.97±2.33a23.63±3.84a31.72±3.71e43.98±1.76ab20.23±3.55a3.83±1.75a
注:不同小写字母表示转基因株系与对照受体间抗虫性差异达到0.05显著性水平。
Note:The different letters indicate statistic result of insect resistance between the different transgenic lines and control plant at the 0.05 level.

a.非转基因对照;b~f.部分转基因大白菜:b.z1-5;c.z2-7;d.z19-1;e.z9-6;f.z20-13
3讨论
本研究首次实现了利用超声波辅助花粉介导法对大白菜自交系的转化,尽管在所获得的6 000余粒种子中通过初筛及分子检测最终只得到25个转化事件,转化效率仅为0.4%。但使用该方法不经过组织培养,当代就可以获得种子,有效地避免了组织培养基因型限制、周期长等问题,其操作简单、费用低廉,不失为一种优秀的白菜转化基因方法。在研究过程中也发现,该方法在大白菜所获得的转化事件中外源基因在宿主基因组中以多拷贝、多位点整合方式存在较多,这与杜建中等[20]在玉米、王景雪等[21]在芥菜等作物上转化结果不同,在一定程度上降低了其转化效率。在转化过程中也发现转化事件中存在一定的假阳性事件,也存在双基因只检测出一个基因,而另一个基因检测不到的情况,证明该方法在转化过程中只有部分基因导入的现象,这可能与前期超声波处理质粒结构破损有关,这与郝曜山等[14]在玉米上结果是相同的。
本研究所获得转基因大白菜新品系在温室及田间的抗虫性鉴定结果证明了双价抗虫基因BmkIT-Chitinase编码的2种杀虫蛋白对鳞翅目害虫有较好的抗性。2种抗虫基因在大白菜中同时表达,可以有效地避免该种蔬菜大面积种植时田间害虫对该基因表达的蛋白产生抗性及耐受性。鉴于其与商业上广泛采用的Bt杀虫晶体蛋白完全不同的杀虫机理,及其专一作用于昆虫体内特殊靶标位点而对哺乳动物无害的特性,认为对该新品系的研发一方面丰富了大白菜的抗虫基因材料,另一方面也可以有效解决鳞翅目害虫抗性风险。
对所获得的转化事件从T1代到T4代进行了PCR、Southern blotting杂交和外源基因表达的蛋白等分子检测,并以此结果为依据对大白菜自交系进行了选择,最终获得了较纯合的转BmkIT-Chitinase基因大白菜新品系。在此过程中,双价抗虫基因BmkIT-Chitinase在大部分材料中能够随白菜核DNA稳定遗传,且其蛋白表达检测与田间抗虫鉴定结果表现出较高的一致性。但在各代跟踪检测调查中,也发现了很多外源基因在各代遗传中并没有符合现有的遗传规律,如材料z2-1、z5-1等在T2代的PCR检测中似乎就表现出很高的纯合率,后来的Southern blot杂交检测证明了该转化事件中外源基因是以多拷贝的形式存的,结合该材料的分离情况,我们推测此事件中外源基因不仅存在多个拷贝,而且其整位点应该处于多条染色体上。研究中还发现了小部分材料,如Z7-3等,其在T1和T2代材料中PCR检测呈阳性,且其阳性率较低,而在T3代材料后均检测不到阳性植株,Southern blotting杂交检测结果为阴性,排除了污染等实验室人为情况,此假阳性事件是如何继续到T2代的,推测是否存在伴随母体的细胞质遗传,在这些方面我们将会进一步深入研究。
在转BmkIT-Chitinase基因大白菜遗传稳定的株系中,尽管经分子检测选择抗虫基因已基本纯合,其田间抗虫性与对照表现出明显差异,但不同株系间抗虫性程度也存在明显差异,研究表明,外源基因的拷贝数与外源基因的表达及田间抗虫性相关。高拷贝数基因表达及田间表现反而低于低拷贝数的转化事件,这与郭美锦等[22]和 Hohenblum H等[23]在毕赤酵母上的外源基因表达研究结论是相似的。同时也发现,同样为单拷贝的转化事件在田间抗虫程度方面也存在较大的差异,这可能和外源基因的插入位点及方式也有一定的相关性。因此,在选育转双价抗虫基因大白菜新品系时,还结合了田间调查,与常规育种技术相结合逐代选留了具有较高抗虫性的单株、自交留种和单株播种方法,最终获得了5个转BmkIT-Chitinase双价抗虫基因大白菜优良自交系,这些自交系所导入的外源基因可高效表达,在田间抗虫性表现与对照有显著差异,抗性普遍提高了2~3级。
参考文献:
[1]王忠华.抗虫转基因白菜类蔬菜作物培育研究进展[J] .上海农业学报,2004,20(4):53-56.
WANG Z H.Advances in development of insect-resistant transgenic Chinese cabbage group[J].ActaAgriculturaeShanghai,2004,20(4):53-56.
[2]陈泠先,崔丽洁,钱忠英,等.普通白菜遗传转化研究进展[J].中国蔬菜,2012,24(12):1-6.
CHEN L X,CUI L J,QIAN Z Y,etal.Research progress in genetic transformation ofBrassicacampestrisL.ssp.chinensis(L.) Makino var.communisTsen et Lee[J].ChinaVegetables,2012,24(12):1-6.
[3]杨广东,朱祯,李燕娥,等.雪花莲外源凝集素基因在大白菜中的表达和抗蚜性遗传分析[J].园艺学报,2003,30(3):341-342.
YANG G D,ZHU Z,LI Y E,etal.Expression and inheritance of snowdrop lectin gene (gna) in Chinese cabbage[J].ActaHorticulturaeSinica,2003,30(3):341-342.
[4]张军杰,刘凡,罗晨,等.大白菜的马铃薯蛋白酶抑制剂基因转化及抗菜青虫性的鉴定[J].园艺学报,2004,31(2):193-198.
ZHANG J J,LIU F,LUO C,etal.Genetic transformation of Chinese cabbage with a inducible potatopinⅡ gene and the bioassay forPierisrapaeL.resistance[J].ActaHorticulturaeSinica,2004,31(2):193-198.
[5]杨广东,朱祯,李燕娥,等.大白菜转修饰豇豆胰蛋白酶抑制剂基因获得抗虫植株[J].园艺学报,2002,29(3):224-228.
YANG G D,ZHU Z,LI Y E,etal.Obtaining transgenic plants of Chinese cabbage resistant toPierisrapaeL.with modifiedCpTIgene (sck)[J].ActaHorticulturaeSinica,2002,29(3):224-228.
[6]赵军良,梁爱华,徐鸿林,等.豇豆胰蛋白酶抑制基因改良大白菜抗虫性的研究[J].西北植物学报,2006,26(5):878-885.
ZHAO J L,LIANG A H,XU H L,etal.Insect resistance ofCpTIgene-improved Chinese cabbage[J].ActaBot.Boreal.-Occident.Sin.,2006,26(5):878-885.
[7]CHO H S,CAO J,REN J P,etal.Control of Lepidopteran insect pests in transgenic Chinese cabbage (Brassicarapassp.pekinensis) transformed with a syntheticBacillusthuringiensiscry1Cgene[J].PlantCellReports,2001,20(1) :1-7.
[8]张志云,张虎生,孙毅,等.双价抗虫基因植物表达载体的构建[J].西北植物学报,2004,24(8):1 402-1 408.
ZHANG Z Y,ZHANG H S,SUN Y,etal.Construction of plant expression vectors containing two anti-insect genes[J].ActaBot.Boreal.-Occident.Sin.,2004,24(8):1 402-1 408.
[9]BARTON K A,WHITELEY H R,YANG N S.Bacillusthuringiensis-endotoxin expressed in transgenicNicotianatabacumprovides resistance to Lepidopteran insects[J].PlantPhysiology,1988,85(4):1 103-11 09.
[10]姚斌,范云六,曾勤,等.表达昆虫特异性神经毒素AaIT基因的转基因烟草的抗虫性[J].生物工程学报,1996,12(2) :67-72.
YAO B,FAN Y L,ZENG Q,etal.Insect-resistant tobacco plants expressing insect-specific neurotoxinAaIT[J].ChineseJournalofBiotechnology,1996,12(2) :67-72.
[11]WU J,LUO X,WANG Z,etal.Transgenic cotton expressing synthesized scorpion insect toxinAaHITgene confers enhanced resistance to cotton bollworm (Heliothisarmigera) larvae[J].BiotechnologyLetters,2008,30(3):547-554.
[12]GOPALAKRISHNAN B,MUTHRKRISHNAN S,KRAMER K J.Baculovirus-mediated expression of aManducasextachitinase gene,properties of the recombinant protein[J].InsectBiochemistryandMolecularBiology,1995,25(2):255-265.
[13]DING X,GOPALAKRISHNAN B,JOHNSON L B,etal.Insect resistance of transgenic tobacco expressing an insect chitinase gene[J].TransgenicResearch,1998,7(2):77-84.
[14]郝曜山,孙毅,杜建中,等.转双价抗虫基因BmkIT-Chitinase玉米株系的获得[J].分子植物育种,2012,10(2):147-154.
HAO Y S,SUN Y,DU J Z,etal.Acquirement of transgenic maize lines with binary insect resistantBmkIT-Chitinase[J].MolecularPlantBreeding,2012,10(2):147-154.
[15]王关林,方宏筠.植物基因工程(第2版)[M].北京:科学出版社,2005:742-744.
[16]萨姆布鲁克 J,拉塞尔 D W.分子克隆实验指南(第3版)[M].黄培堂,王恒樑,周晓巍,等译.北京:科学出版社,2002:212-219.
[17]金晓霞,高亚,于丽杰.转IL- 4基因大白菜后代的分子检测及遗传分析[J].中国生物工程杂志,2013,33(6):131-137.
JIN X X,GAO Y,YU L J.Molecular detection and genetic analysis of Chinese cabbage progeny with theIL- 4[J].ChinaBiotechnology,2013,33(6):131-137.
[18]王欣.白菜对小菜蛾抗性的评价方法及抗虫机理研究[D].北京:中国农业科学院,2007.
[19]狄红梅,王学府,曹秋芬,等.超声波处理对大白菜花粉管通道法转基因的影响[J].安徽农业科学,2012,40(3):1 304-1 306.
DI H M,WANG X F,CAO Q F,etal.Influence of ultrasonic treatment of Chinese cabbage gene transformation through the pollen tube pathway[J].JournalofAnhuiAgri.Sci.,2012,40(3):1 304-1 306.
[20]杜建中,孙毅,王景雪,等.转基因玉米中目的基因的遗传表达及其抗病性研究[J].西北植物学报,2007,27(9):1 720-1 727.
DU J Z,SUN Y,WANG J X,etal.Stable inheritance and expression of chitinase gene in the transgenic maize plants and their head smut-resistant activity[J].ActaBot.Boreal.-Occident.Sin.,2007,27(9):1 720-1 727.
[21]WANG J X,LI Y H,LIANG CH.Recovery of transgenic plants by pollen-mediated transformation inBrassicajuncea[J].TransgenicResearch,2008,17(3):417-424.
[22]郭美锦,朱泰承,张明,等.重组毕赤酵母甲醇利用表型与基因拷贝数对外源基因表达的影响[J].中国生物工程杂志,2007,27(7):7-11.
GUO M J,ZHU T C,ZHANG M,etal.Influences of methanol utilization phenotype and gene dosage on heterologous protein in expression in recombinantPichiapastoris[J].ChinaBiotechnology,2007,27(7):7-11.
[23]HOHENBLUM H,GASSER B,MAURER M,etal.Effects of gene dosage,promoters ,and substrates on unfolded protein stress of recombinantPichiapastoris[J].Biotechnology&Bioengineering,2004,85(4):367-375.
(编辑:宋亚珍)
Acquirement of Transgenic Chinese Cabbage withBmkIT-ChitinaseGene and Their Insect -resistant Bioassay
LAN Chuangye1,LIU Zhao1,JIA Xiaojun2,ZHOU Jin2
(1 Shanxi Academy of Agriculture Sciences Vegetables Research Institute,Taiyuan 030031,China;2 Institute of Agricultural Research,6th Branch of XPCG,Wujiaqu,Xinjiang 831300,China)
Abstract:At the present study,the binary insect-resistant BmkIT-Chitinase gene was successfully transformed into the Chinese cabbage inbred line 20-19-3 via pollen mediated transformation approach assisted by supersonic.Five transgenic Chinese cabbage inbred lines Z1-5,Z2-7,Z9-6,Z11-6 and Z20-13 were obtained.The genetic rules,transgenic expression and insect resistance of above transgenic materials were compared with untransformed control.The PCR amplification and Southern blot hybridization detection on transgenic plants and their progeny showed that:(1)BmkIT-Chitinase gene has been transformed into the genome of receptors and the transgenics can inherit stably.Most transgenics exist in multi-copy form and single copy transgenics appeared in few translines.(2)ELISA assay verified the expression of foreign gene and the expression product of BmkIT-Chitinase gene in T4transgenic plants were high to 0.069 μg·g-1fresh leaves.(3)Field insect-resistant bioassay showed that there are significant differences on insect resistance between transformed inbred lines and their control groups.The level of insect resistance activities of Pieris rapae Linnaenus and Plutella xylostella Linnaenus enhanced 2-3 degree.
Key words:Chinese cabbage;pollen mediated transformation;BmkIT gene;Chitinase gene;binary insect-resistant gene
中图分类号:Q785;Q786
文献标志码:A
作者简介:兰创业(1980-),男,硕士,助理研究员,主要从事大白菜种质资源创新研究。E-mail:1424054138@qq.com
基金项目:科技援疆项目(2014072008)
收稿日期:2015-08-06;修改稿收到日期:2015-12-25
文章编号:1000-4025(2016)01-0008-09
doi:10.7606/j.issn.1000-4025.2016.01.0008
