铁皮石斛DORCA基因的克隆及表达分析
2016-03-23王洁琼宋彩霞袁秀云
崔 波,王洁琼,宋彩霞,袁秀云,
蒋素华1,梁 芳1,刘 佳2,叶永忠2*
(1 郑州师范学院,郑州 450044;2 河南农业大学 生命科学学院,郑州 450002)
铁皮石斛DORCA基因的克隆及表达分析
崔波1,2,王洁琼2,宋彩霞2,袁秀云1,
蒋素华1,梁芳1,刘佳2,叶永忠2*
(1 郑州师范学院,郑州 450044;2 河南农业大学 生命科学学院,郑州 450002)
摘要:为了研究铁皮石斛的光合特性,根据Rubisco活化酶(RCA)基因的保守序列设计兼并引物,采用RT-PCR和RACE方法从铁皮石斛叶中分离到一个RCA基因,命名为DORCA(GenBank登录号KT205841)。DORCA基因cDNA全长为1 724 bp,包含1 317 bp开放阅读框(ORF),编码438个氨基酸。系统进化分析显示,DORCA与马蹄莲ZaRCA(AAK25801.1)亲缘关系最近。生物信息学分析表明,DORCA与其他植物的RCA蛋白具有较高一致性,属于RCA的β亚基。DORCA蛋白具有定位于叶绿体的N端转运肽,2个保守的ATP结合结构域和多个磷酸化位点。实时荧光定量PCR(qRT-PCR)分析表明,DORCA基因在茎、叶中表达;在自然光周期条件下,DORCA基因在8:30时表达量最高,20:30时表达量最低,具有明显的光诱导表达特性。
关键词:铁皮石斛;Rubisco活化酶;分子特征;表达特性
铁皮石斛(DendrobiumofficinaleKimura et Migo)为兰科(Orchidaceae)多年生附生草本植物,是石斛属(Dendrobium)药用植物中珍稀名贵的品种,在中国主要分布在浙江、云南、四川、福建、广西、安徽等地。铁皮石斛富含多糖、生物碱、菲类化合物等药用成分,在提高人体免疫力、抗衰老、抗肿瘤、降血糖等方面具有显著的功效。
近年来,光合机理研究日益受到研究者的重视,其中Rubisco(核酮糖1,5-二磷酸羧化酶/加氧酶)活性的调节机制是一个重要的研究领域。Rubisco是所有光合生物进行光合碳同化的关键酶,它能催化RuBP(1,5-二磷酸核酮糖)的羧化和加氧反应,并调节二者之间的关系,这2个反应的比值决定了植物的碳同化效率[1]。已有研究表明,虽然Rubisco含量占叶片可溶性蛋白的一半,但它的效率却很低[2]。Rubisco只有处于活化态时,才能催化CO2固定。因此,提高Rubisco利用效率和活力是提高光合作用的重要途径[3]。在植物体中Rubisco活性受Rubisco活化酶(rubisco activase,RCA)的调节和控制,RCA是一种核编码的可溶性叶绿体蛋白,广泛存在于光合生物中,具有ATPase活性,属于AAA+蛋白家族成员[4]。RCA的主要功能是活化Rubisco,在适温条件下,RCA利用光合磷酸化产生的ATP使Rubisco迅速与生理浓度CO2和Mg2+结合形成ECM复合体(酶-CO2-Mg)而达到最大的活化程度,解除磷酸糖对Rubisco活性的抑制作用,完成对Rubisco的活化[5]。
目前关于RCA的研究主要集中在粮食作物如水稻[6]、小麦[7]、玉米[8]和观赏性园艺植物如彩叶草[9]、羽衣甘蓝[10]等。铁皮石斛作为名贵中草药,因独特的保健功能使其市场需求逐年增加,但是生长却比较缓慢。因此,促进铁皮石斛的生长,提高生产效率,是目前铁皮石斛产业发展的当务之急。为了更好地研究铁皮石斛的光合特性,本研究采用RACE法克隆了RCA基因,并对其分子特性和表达模式进行了分析,为进一步研究铁皮石斛的光合作用奠定了基础。
1材料和方法
1.1植物材料
实验材料为1年生铁皮石斛(Dendrobiumofficinale),来源于郑州师范学院兰花工程技术研究中心。选取生长一致的幼苗,从当晚20:30开始每隔4 h取样1次,到次日20:30结束,且采相同部位的叶片,保存于-80 ℃冰箱,用于RNA提取。
1.2方法
1.2.1RNA提取和cDNA合成采用多糖多酚植物总RNA提取试剂盒(Tiangen公司)提取实验材料总RNA,用1%琼脂糖凝胶电泳鉴定RNA完整性;用DU800核酸蛋白分析仪(美国Beckman)测定其A260、A280值,计算RNA浓度和纯度。用M-MLV反转录酶(TaKaRa公司)以提取的总RNA为模板,合成单链cDNA,具体方法参照试剂盒的说明书。
1.2.2铁皮石斛RCA基因全长cDNA克隆利用生物软件DNAMAN和Primer 5.0,根据已有植物RCA序列的保守区,设计1对简并引物,上游引物RCA-F1(5′-GAYGACCAGCAGGACATAACCA-3′)和下游引物RCA-R1(5′-TTGTTGACGGTGTACTGGGTG-3′),以叶cDNA为模板,扩增铁皮石斛RCA基因的保守片段。PCR反应体系为20 μL,包含10×PCR缓冲液2.0 μL,dNTP Mix 2.0 μL,上下游引物(10 μmol/L)各1.0 μL,cDNA模板 1.0 μL,rTaq酶(5 U/μL)0.2 μL,加灭菌双蒸水至总体积20 μL。反应程序为94 ℃预变性4 min;94 ℃变性40 s,56 ℃复性40 s,72 ℃延伸40 min,35个循环;最后72 ℃延伸20 min。PCR产物经1%琼脂糖凝胶电泳检测后利用凝胶试剂盒(Tiangen公司)回收目的片段,连接pGEM-T Easy载体,转化E.coliDH5α挑选阳性克隆送至上海英骏生物技术公司测序。
根据上步所得的RCA基因片段序列,设计1对3′端特异引物GSP1(5′-TGTGCTGCCTCTTCATCAATG-3′)和GSP2(5′-ACCACCCAGTACACCGTCAA-3′),1对5′端特异引物GPS3(5′-ATACTGACGAAGACCTTGGCTGAT-3′)和GPS4(5′-CACCCTTTCCTCTGGTTATGTCCT-3′),按Clontech公司SMARTer RACE cDNA Amplification Kit操作说明进行反应,回收扩增产物,连接到pGEM-T Easy载体上,转入大肠杆菌 DH5α菌株,鉴定后进行测序。
1.2.3铁皮石斛RCA基因生物信息学分析用DNAMAN软件分析拼接cDNA测序序列,得到正确的铁皮石斛RCA基因序列。铁皮石斛RCA蛋白的分子特征主要采用生物信息学方法进行分析。Blast搜索分析、ORF finding、核苷酸翻译以及蛋白保守结构域均在NCBI(http://www.ncbi.nlm.nih.gov/)网站上进行;不同RCA蛋白序列的多重比对利用ClustalX和DNAMAN软件生成比对结果,再利用MEGA 5.0进行系统进化树构建;应用ExPASy、SMART、Net Phos.2.0 server、TMPRED、TargetP 1.1 server等综合软件分析包预测RCA蛋白的基本性质、结构特点、磷酸化位点、跨膜结构域和亚细胞定位等。
1.2.4铁皮石斛RCA基因表达分析利用Primer 5.0设计铁皮石斛RCA基因实时荧光定量PCR引物qRT-RCAF(5′-TGTCAACCGAGTTCCACTTACC-3′)和qRT-RCAR(5′-TCGAGGTCAGCAGCCAAGA-3′)。以铁皮石斛的EF1α作为内参基因[11],引物为EF1αF(5′-TCAGGCTGACTGTGCTGTCCT-3′)和EF1αR(5′-GTGGTGGCGTCCATCTTGTT-3′)。分别提取铁皮石斛不同组织部位,不同时间点的总RNA,使用PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa)反转录合成单链cDNA。实时荧光定量PCR反应体系和程序参照宝生物工程(大连)有限公司SYBR PremixExTaqTMⅡ(Tli RNaseH Plus)试剂盒说明书。反应体系为20 μL,所用仪器为Eppendorf Mastercycler ep realplex 2。反应程序为95 ℃预变性15 s,58 ℃变性15 s,72 ℃退火15 s,40个循环。每样品重复3次,采用公式2-ΔΔCt法计算基因相对表达量。
2结果与分析
2.1铁皮石斛RCA基因全长cDNA克隆
以铁皮石斛叶片cDNA为模板,扩增出1条长度为503 bp的特异保守片段(图1),测序并在NCBI上Blast分析,该片段与多种植物的RCA序列有较高一致性(80%以上),证明该片段为RCA片段。根据该片段设计RACE引物,利用3′端引物GSP1和GSP2扩增得到3′端目的片段,用5′端引物GPS3和GPS4扩增得到5′端目的片段(图2)。将特异保守片段、3′-RACE和5′-RACE序列拼接获得铁皮石斛RCA的cDNA,命名为DORCA,全长为1 724 bp,利用NCBI在线工具ORF finder确定该基因的ORF长1 317 bp,编码438个氨基酸,包含起始密码子和终止密码子。5′端非编码区为81 bp,3′端非编码区为325 bp。
2.2DORCA蛋白序列的理化性质
DORCA基因编码一个438 aa的前体蛋白,蛋白的分子量为48.25 kD,理论等电位点为6.19。应用在线分析软件TargetP 1.1 Server对DORCA氨基酸序列进一步分析发现,此氨基酸序列的前57个氨基酸残基为叶绿体转运肽(图3),因此成熟蛋白分子量为41.1 kD,推测以β(41~43 kD)亚基存在。TMPRED对氨基酸序列进行跨膜结构预测表明在N端区域内(第17~33位aa)具有跨膜结构。NetPhos 2.0 Server预测表明,DORCA蛋白有8个Ser磷酸化位点,4个Thr磷酸化位点和5个Tyr磷酸化位点,这表明蛋白翻译后修饰对DORCA蛋白功能的实现起重要作用。SMART和CDS保守结构域搜索表明,DORCA蛋白含有一个ATP酶的高度保守的P-loop NTPase Superfamily结构域(图3),其中在162~309 aa位点范围内包含AAA+蛋白家族折叠区,含有2个保守的ATP结合基序(motif),分别为“WGGKGQGKS”(A区)和“GKMCCLFINDLD”(B区)。

M.Marker;1.PCR产物
M.Marker;1.5′-RACE;2.3′-RACE
2.3不同植物RCA基因系统进化分析
用NCBI上的Blastp程序和DNAMAN多序列对比分析表明,DORCA蛋白序列与许多植物的RCA具有较高的一致性,其中与油棕(Elaeisguineensis)的一致性最高,达87%。将DORCA基因氨基酸序列与GenBank蛋白质数据库进行氨基酸序列同源性比对,发现具有较高一致性的植物包括:海枣(Phoenixdactylifera)、荷花(Nelumbonu-cifera)、葡萄(Vitisvinifera)、可可(Theobromacacao)、麦冬(Ophiopogonjaponicus)、马蹄莲(Zantedeschiaaethiopics)和大豆(Glycinemax)等,与这些基因的一致性都在80%以上。在MEGA 5.0软件上运用Custal X对这些氨基酸序列进行系统进化树构建(图4),结果表明,DORCA与单子叶植物马蹄莲(Zantedeschiaaethiopics)的亲缘关系最近。多序列比对也表明DORCA蛋白的C末端没有受硫氧化蛋白f (Trx-f)的氧化还原作用所调节的2个Cys残基(图5),表明DORCA蛋白属于β亚基,这与DORCA蛋白分子量为41.1 kD属于β亚基的分析一致。
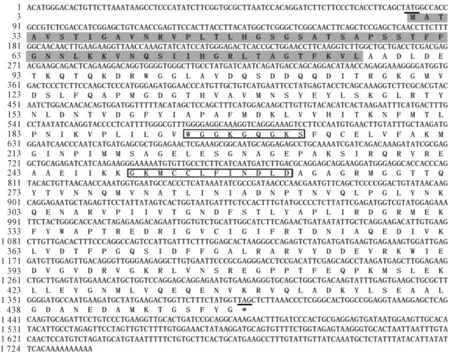
起始密码子ATG用下划线表示,终止子TAG用星号和下划线表示;灰色背景表示定位于

方框代表本研究的DORCA在系统进化树中的位置;图中分支上的数字表示Bootstrap验证中

α亚基C末端的特异C-extension结构用方框表示;2个推测的ATP结合位点P-环序列用方框A、B表示;
2.4DORCA表达模式分析
为了研究DORCA基因在铁皮石斛组织中的表达模式,采用实时荧光定量RT-PCR对铁皮石斛的根、茎、叶进行分析,结果显示,DORCA主要在绿色组织中表达,其中叶片中的表达量最高,在茎中相对表达量较少,而在根中几乎检测不到(图6)。本研究得出的结论与玉米[8]、水稻[6]等RCA只在绿色组织中特异性表达相一致。研究表明,大量光合作用相关基因受光照和生物钟节律的调控,为了检测DORCA是否受光调节,选取生长在每天12 h自然光照(6:00~18:00)和12 h黑暗条件(18:00~6:00)下的铁皮石斛幼苗,提取相应时间点的叶RNA,进行qRT-PCR表达分析。结果显示(图6),在自然光周期条件下,DORCA表达量变化呈现出明显的生物钟特性。黑暗周期过程中,DORCA的相对表达量逐渐增加,至上午8:30时达到最大值,随后逐渐降低,到晚上20:30降至最低。另外结果还显示,DORCA基因表达水平较高的时间段主要集中在4:30~12:30。DORCA受光调节的特点与玉米[8]、苹果[11]等多种植物RCA受光调节并具有昼夜节奏的表达特性相同。
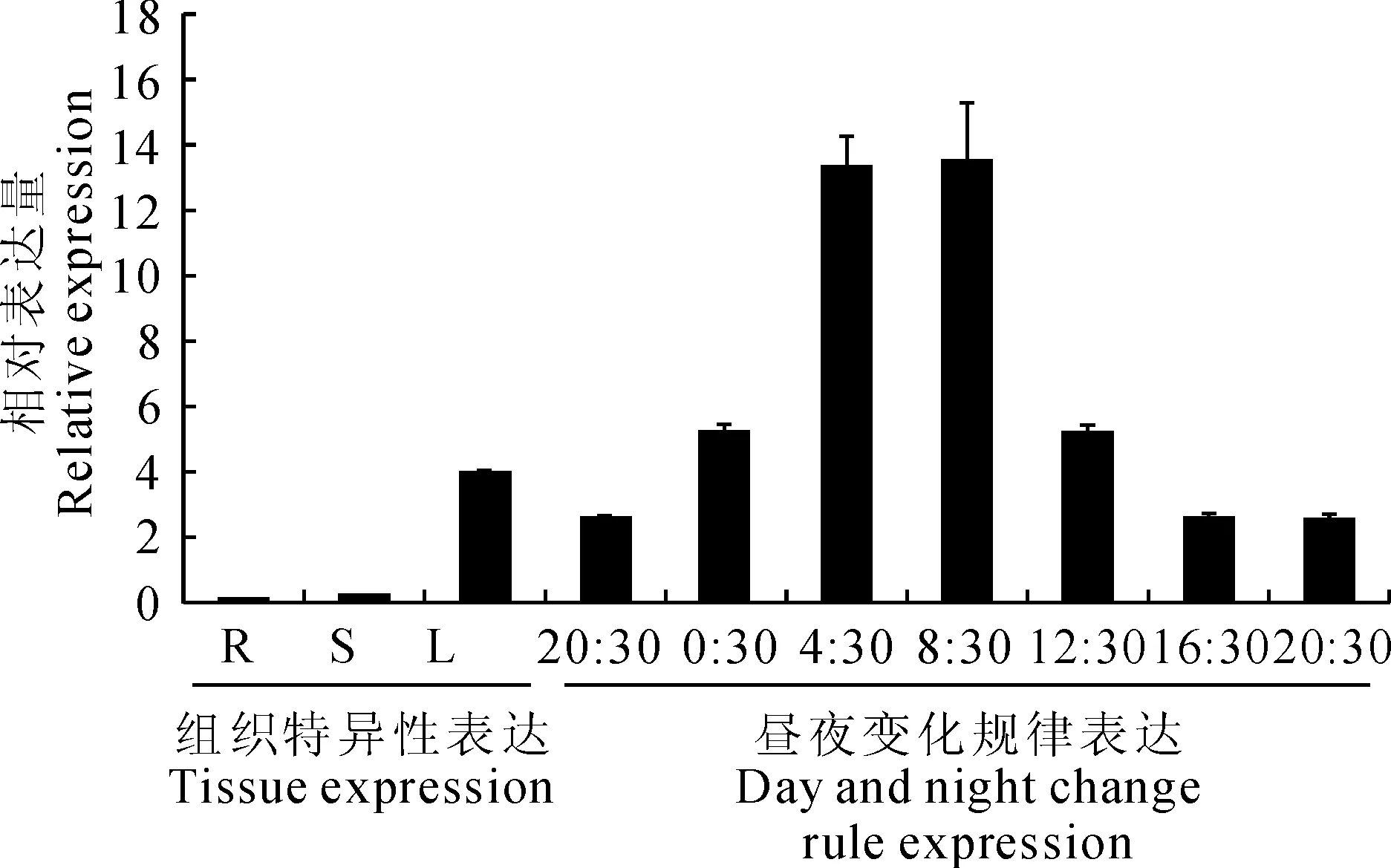
R、S和L分别代表根、茎、叶
3讨论
在植物光合作用的研究中,关于 Rubisco活化酶活性调节机制一直是一个重要的研究领域。Rubisco活化酶是维持和调节Rubisco活性所必需的,在植物体中只有Rubisco活化酶存在时Rubisco才能保持较高的催化活性[12]。在本研究中利用RT-PCR和RACE技术从铁皮石斛中扩增出了一个RCA基因的全长cDNA序列DORCA(GenBank登录号KT205841)。并利用生物信息学方法对DORCA蛋白的分子特征进行分析和预测。结果表明DORCA基因cDNA全长1 724 bp,编码438个氨基酸的前体蛋白,N端具有57个氨基酸的叶绿体转运肽,是核基因编码的叶绿体蛋白。DORCA编码的成熟蛋白具有RCA蛋白都含有的2个保守的ATP结合基序,属于AAA+蛋白家族。系统进化树显示DORCA基因的氨基酸序列与其他已知植物RCA具有高度一致性,且与马蹄莲亲缘关系最近属于同一支。
大量研究表明,植物RCA基因具有组织表达特异性。Liu等[13]研究发现拟南芥RCA基因只在绿色组织如叶、茎、角果中表达。Watillon等[14]研究发现苹果RCA基因同样在叶片中能大量检测到,但在根和茎中几乎检测不到。本研究利用实时荧光定量RT-PCR方法得出的检测结果与前人结果相似[13-14],且与Rubisco仅在绿色组织中特异表达相一致。同时多数植物RCA基因的表达还受到光的诱导及生物钟的调控[15-16],本研究中同样发现铁皮石斛RCA基因昼夜表达变化节奏性,开始时表达水平最低,然后表达量逐渐增加,至上午8:30时表达量达到最大值,随后逐渐降低,表现出了生物钟特性。
不同植物RCA亚基的种类和数量是不同的,如小麦[7]、水稻[6]、拟南芥[17]、大豆[18]、菠菜[17]、棉花[19]等植物均含有α和β亚基,而有些植物如黄瓜[20]、玉米[8]、烟草[15]等却只表达β亚基。植物RCA的α亚基大小范围在45~47 kD,而且只有α亚基的C末端具有调节硫氧还蛋白f (Trx-f)的2个Cys残基,β亚基的大小为41~44 kD,C末端没有保守结构[16]。DORCA蛋白经多重序列对比表明,其C端没有α亚基所具有的2个Cys残基,并且成熟蛋白大小为41.1 kD,说明属于β亚基形式。研究表明无论何种形式的亚基,来源于同种或是不同种的植物抗体之间都有可能发生交叉反应[18]。另外,RCA基因的表达方式也各不相同,有的是由一个RCA基因通过选择性剪接编码2个亚基,有的是不同基因编码同一个亚基[21]。因此,在铁皮石斛中是否还具有α亚基形式,以及其β亚基是否是由一个或者多个基因编码的,还需要利用Southern blotting及Western blotting等技术进一步进行分析确定。
苏文华等[22]研究表明,铁皮石斛叶片具有兼性CAM植物的特点,晴天呈CAM途径、阴雨天呈C3途径,多云天气在上述两种途径之间变化。本试验关于DORCA基因的分子克隆与表达特性的研究,为进一步研究铁皮石斛复杂的光合作用奠定了基础。目前正在构建DORCA基因的超表达载体进行遗传转化,试图进一步解释其调控的分子机制。
参考文献:
[1]MAKINO A,MAE T,OHIRA K.Purification and storage of ribulose 1,5-bisphosphate carboxylase from rice leaves[J].PlantandCellPhysiology,1983,24(6):1 169-1 173.
[2]MANN C C.Genetic engineers aim to soup up crop photosynthesis[J].Science,1999,283(5 400):314-316.
[3]PORTIS J R A R.Rubisco activase-Rubisco’s catalytic chaperone[J].PhotosynthesisResearch,2003,75(1):11-27.
[4]张国,王玮,邹琦.Rubisco活化酶的分子生物学[J].植物生理学通讯,2004,40(5):633-637.
ZHANG G,WANG W,ZOU Q.Molecular biology of Rubisco activase[J].PlantPhysio.Commu.,2004,40(5):633-637.
[5]LILLEY R M,PORTIS A R J R.Activation of ribulose-1,5-bisphosphate carboxylase/oxygenase(rubisco) by rubisco activase[J].PlantPhysiol.,1990,94:245-247.
[6]TO K Y,SUEN D F,CHEN S C G.Molecular characterization of ribulose-1,5-bisphosphate carboxylase/oxygenase activase in rice leaves[J].Planta,1999,209(1):66-76.
[7]LAW R D,CRAFTS-BRANDNER S J.High temperature stress increases the expression of wheat leaf ribulose-1,5-bisphosphate carboxylase/oxygenase activase protein[J].ArchivesofBiochemistryandBiophysics,2001,386(2):261-267.
[8]AYALA-OCHOA A,VARGAS-SUAREZ M,LOZA-TAVERA H,etal.In maize,two distinct ribulose 1,5-bisphosphate carboxylase/oxygenase activase transcripts have different day/night patterns of expression[J].Biochimie,2004,86(7):439-449.
[9]祝钦泷,谢先荣,眭顺照,等.彩叶草Rubisco活化酶基因SsRCA的分子特征及其表达模式[J].西北植物学报,2011,31(6):1 097-1 104.
ZHU Q L,XIE X R,GUI X ZH,etal.Molecular characteristics and expression patterns of a novel Rubisco activase gene,SsRCA,fromSolenostemonscutellarioides(L.) Codd[J].ActaBot.Boreal.-Occident.Sin.,2011,31(6):1 097-1 104.
[10]朱明库,陈国平,周爽,等.羽衣甘蓝Rubisco活化酶基因BoRCA的克隆,生物信息学及表达分析[J].云南大学学报(自然科学版),2013,35(6):857-865.
ZHU M K,CHEN G P,ZHOU SH,etal.Cloning,bioinformatics and expression analysis of Rubisco activase geneBoRCAfromBrassicaoleracea[J].JournalofYunanUniversity(Nat.Sci.Edi.),2013,35(6):857-865.
[11]RUNDLE S J,ZIELINSKI R E.Organization and expression of two tandemly oriented genes encoding ribulosebisphosphate carboxylase/oxygenase activase in barley[J].JournalofBiologicalChemistry,1991,266(8):4 677-4 685.
[12]张岗,赵明明,张大为,等.铁皮石斛实时定量PCR内参基因的筛选[J].中国药学杂志,2013,19:15.
ZHANG G,ZHAO M M,ZHANG D W,etal.Reference gene selection for real-time quantitative PCR analysis ofDendrobiumofficinale[J].Chin.Pharm.J.,2013,48(19):1 664-1 668.
[13]LIU Z,TAUB C C,MCCLUNG C R.Identification of anArabidopsisthalianaribulose-1,5-bisphosphate carboxylase/oxygenase activase (RCA) minimal promoter regulated by light and the circadian clock[J].PlantPhysiology,1996,112(1):43-51.
[14]WATILLON B,KETTMANN R,BOXUS P,etal.Developmental and circadian pattern of rubisco activase mRNA accumulation in apple plants[J].PlantMolecularBiology,1993,23(3):501-509.
[15]QIAN J.,RODERMEL S.R.Ribulose-l,5-bisphosphate carboxylase/oxygenase activase cDNAs fromNicotianatabacum[J].PlantPhysiol.,1993,102:683-684.
[16]ROESLER K R,OGREN W L.Primary structure ofChlamydomonasreinhardtiiribulose 1,5-bisphosphate carboxylase/oxygenase activase and evidence for a single polypeptide[J].PlantPhysiology,1990,94(4):1 837-1 841.
[17]WERNEKE J M,CHATFIELD J M,OGREN W L.Alternative mRNA splicing generates the two ribulosebisphosphate carboxylase/oxygenase activase polypeptides in spinach andArabidopsis[J].ThePlantCell,1989,1(8):815-825.
[18]YIN Z,MENG F,SONG H,etal.Expression quantitative trait loci analysis of two genes encoding rubisco activase in soybean[J].PlantPhysiology,2010,152(3):1 625-1 637.
[19]SALVUCCI M E,VAN DE LOO F J,STECHER D.Two isoforms of Rubisco activase in cotton,the products of separate genes not alternative splicing[J].Planta,2003,216(5):736-744.
[20]ZHANG N,KALLIS R P,EWY R G,etal.Light modulation of Rubisco inArabidopsisrequires a capacity for redox regulation of the larger Rubisco activase isoform[J].ProceedingsoftheNationalAcademyofSciences,2002,99(5):3 330-3 334.
[21]李海霞,王真梅,曾汉来.植物 Rubisco 活化酶的研究进展[J].植物生理学报,2010,46(11):1 092-1 100.
LI H X,WANG Z M,ZENG H L.The research progresses in Rubisco activase in plant[J].PlantPhysio.Commu.,2010,46(11):1 092-1 100.
[22]苏文华,张光飞.铁皮石斛叶片光合作用的碳代谢途径[J].植物生态学报,2003,27(5):631-637.
SU W H,ZHANG G F.The photosynthesis pathway in leaves ofDendrobiumofficinale[J].ActaPhytoecologicaSinica,2003,27(5):631-637.
(编辑:宋亚珍)
Cloning and Expression Analysis ofDORCAGene fromDendrobiumofficinale
CUI Bo1,2,WANG Jieqiong2,SONG Caixia2,YUAN Xiuyun1,JIANG Suhua1,LIANG Fang1,LIU Jia2,YE Yongzhong2*
(1 Zhengzhou Normal College,Zhengzhou 450044,China;2 College of Life Sciences,Henan Agricultural University,Zhengzhou 450002,China)
Abstract:To study the photosynthesis of Dendrobium officinale,we isolated a full-length cDNA of Rubisco activase DORCA(Accession No.KT205841) from this plant by the method of RT-PCR and RACE using degenerate primers designed according to the conserved region of RCA.The full-length cDNA of DORCA was 1 724 bp,with an ORF of 1 317 bp encoding 438 putative amino acids.Phylogenetic analysis showed that DORCA closed to ZaRCA(AAK25801.1).Bioinformatics analysis showed that DORCA belonged to β isoform of RCA protein and had high identities with other plant RCAs.The DORCA contained a predicted N-terminal transit peptide to chloroplast,two high conserved ATP-binding domains and multiple phosphorylation sites.The real-time quantitative PCR(qRT-PCR) results showed that DORCA was only detected in green tissues.In the 12 h dark and 12 h natural light photoperiods,maximal and minimal DORCA mRNA expression levels were detected at 8:30 and 20:30,respectively,which indicated that DORCA has the obvious characteristics of light-induced expression.
Key words:Dendrobium officinale;Rubisco activase;molecular characteristics;expression patterns
中图分类号:Q785;Q786
文献标志码:A
作者简介:崔波(1962-),男,博士,教授,主要从事花卉分子生物学研究。E-mail:laocuibo@163.com*通信作者:叶永忠,教授,博士生导师,主要从事植物生态学研究。E-mail:yeyzh@163.com
基金项目:河南省科技攻关项目(092102110128);郑州市科技攻关项目(141PPTGG420)
收稿日期:2015-09-25;修改稿收到日期:2015-12-08
文章编号:1000-4025(2016)01-0023-07
doi:10.7606/j.issn.1000-4025.2016.01.0023
