卵巢癌患者腹水及外周血CD4+ CD25+调节性T细胞含量及抑制功能的研究
2016-03-15孙洁杨素芬白图门李梅董迅陈小萍
孙洁 杨素芬 白图门 李梅 董迅 陈小萍
【摘要】目的:分析并探讨卵巢癌患者腹水及外周血CD4+CD25+调节性T细胞含量及抑制功能。方法:选取2012年2月至2015年2月期间在我院和宁波市鄞州第二医院接受治疗的卵巢癌患者56例,采集腹水标本56例,外周血标本56例。使用流式细胞术检测CD4+CD25+调节性T细胞(Treg)的表达。采用15μmol/L的羧基荧光素二醋酸盐琥珀酰亚胺脂(CFSE)标记CD4+CD25- T细胞,观察CFSE标记效果,计算抑制率。结果:研究结果显示,56例腹水患者CD4+CD25+ T cells/CD4+T cell为(2834±1327)%,56例外周血标本CD4+CD25+ T cells/CD4+ T cell为(1456±436)%。腹水和外周血标本CD4+CD25+ T cells/CD4+ T cell含量有显著差异(P<005)。腹水Treg抑制功能比外周血Treg强,经统计学检验,差异具有统计学意义(P<005)。结论:腹水Treg含量及抑制功能比外周血Treg强,提示卵巢癌腹腔内相对容易发生免疫逃逸,而Treg升高可能参与促进肿瘤复发。
【关键词】卵巢癌;腹水;外周血;CD4+CD25+调节性T细胞
【中图分类号】R73731【文献标志码】A
卵巢癌是一种女性常见妇科恶性肿瘤,是女性致死率最高的肿瘤类型,已严重威胁其患者的生命健康[1]。临床中未见肿瘤初期的敏感诊断方式,这将导致一经确诊基本为中晚期,延误最佳治疗时机[2]。近年来,针对卵巢癌的免疫学机制研究逐渐成为热点,对肿瘤微环境的免疫学机制变化深入了解,有助于提高未来卵巢癌早期诊断及后期治疗的成功率[3]。在本次研究中,选取卵巢癌患者56例,分析并探讨卵巢癌患者腹水及外周血CD4+CD25+调节性T细胞含量及抑制功能。
1资料与方法
11一般资料
选取2012年2月至2015年5月期间在我院和宁波市鄞州第二医院接受治疗的卵巢癌患者56例,采集腹水标本56例,外周血标本56例。纳入标准:(1)经病理检查和细胞学检查均被确诊为卵巢癌;(2)签署知情同意。排除标准:(1)感染性疾病患者;(2)非自愿参加者。该研究得到伦理学会的批准,且在采集标本前得到了患者的许可,允许进行后续实验。
12实验方法
在卵巢癌患者腹腔穿刺术后采集腹水标本,并使用无菌的引流袋将其安置于冰中保存用于后续实验分析。外周血标本则在清晨空腹后采集静脉血获得,加入EDTA抗凝处理[4]。
使用流式细胞术检测CD4+CD25+调节性T细胞(Treg)的表达[5]。使用CD4+Multisort kit获得CD4+ T细胞,然后使用CD25的磁珠阳性分选得到CD4+CD25+ T细胞和CD4+CD25- T细胞。经检测,CD4+CD25+ T细胞浓度在90%以上。
分选得到CD4+CD25+ T细胞和CD4+CD25- T细胞,采用15μmol/L的羧基荧光素二醋酸盐琥珀酰亚胺脂(CFSE)标记CD4+CD25- T细胞,观察CFSE标记效果[6]。CD4+CD25+ T细胞和CFSE标记的CD4+CD25- T细胞按0:1、1:1、1:2及1:4比例在10%的胎牛血清-RPMI-1640培养体系内进行共培养,加入人淋巴细胞CD3单克隆抗体、人淋巴细胞CD28单克隆抗体以及人重组IL-2作为激活因子。5d后使用流式细胞仪检测CFSE表达,计算抑制率。
13统计学分析
对观测结果使用统计学软件SPSS 190分析,计量资料采取t检验,率的比较采取卡方检验,以P<005为差异有统计学意义的判断标准。
2结果
21卵巢癌腹水及外周血中CD4+CD25+ T细胞的检测结果分析研究结果显示,56例腹水患者CD4+CD25+ T cells/CD4+ T cell为(2834±1327)%,56例外周血标本CD4+CD25+ T cells/CD4+ T cell为(1456±436)%。腹水和外周血标本CD4+CD25+ T cells/CD4+ T cell含量有显著差异,经统计学检验,差异具有统计学意义(P<005)。
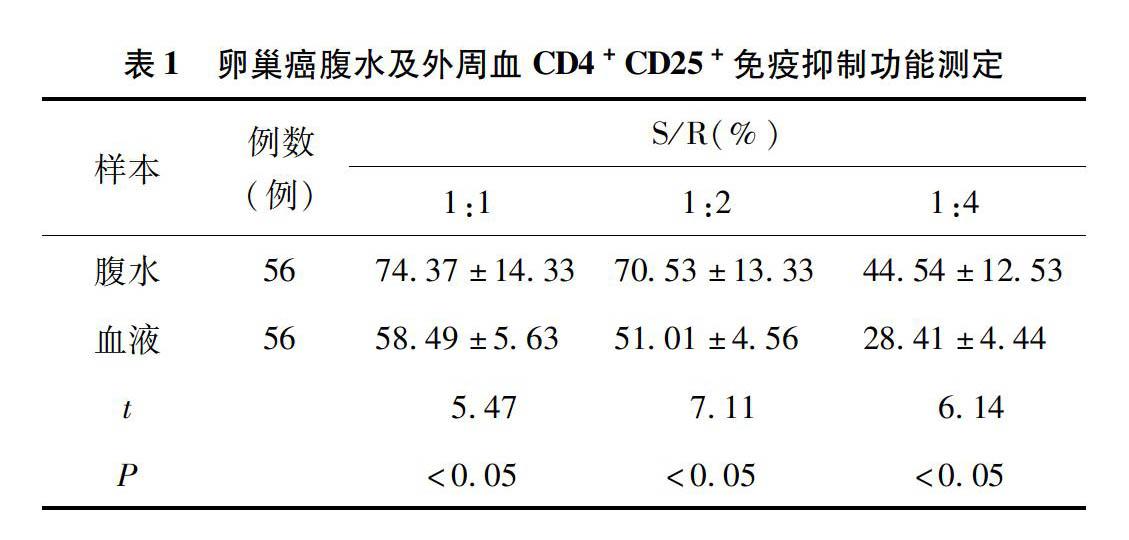
22卵巢癌腹水及外周血CD4+CD25+免疫抑制功能测定结果分析腹水Treg抑制功能比外周血Treg强,经统计学检验,差异具有统计学意义(P<005)。见表1。表1卵巢癌腹水及外周血CD4+CD25+免疫抑制功能测定样本例数
(例)S/R(%)1:11:21:4腹水567437±14337053±13334454±1253血液565849±5635101±4562841±444t547711614P<005<005<005
3讨论
随着近年来肿瘤研究逐渐深入,许多文献证实部分肿瘤抗原与自身抗原相似甚至相同,免疫细胞对外来抗原发挥识别、清除功能,但因部分肿瘤抗原与自身抗原相同,未成功识别,从而使肿瘤继续生长蔓延[7]。研究表明,CD4+CD25+调节性T细胞具有抑制自身T细胞表达及识别的能力,可以进一步帮助肿瘤细胞在免疫系统监控下逃脱[8]。基于上述理论,近年来针对CD4+CD25+调节性T细胞与肿瘤免疫微环境的关系研究逐渐增多,对肿瘤微环境的免疫学机制变化深入了解,有助于提高未来卵巢癌早期诊断及后期治疗的成功率。
有研究证实,在肝癌、乳腺癌及结肠癌患者血清中发现CD4+CD25+调节性T细胞数量有所增多,且在肿瘤病灶处结果亦然[9]。随后,有人报道发现在卵巢癌患者中发现CD4+CD25+调节性T细胞也有所增加,并且随着癌症的发展,增加的愈发明显。增加的越明显,该疾病的预后表现越差[10]。肿瘤病灶甚至全血内存在一定免疫抑制,这种抑制可能是通过CD4+CD25+调节性T细胞介导的,同时有报道证实,这种介导并非由活化T细胞刺激而来[11]。动物实验表明,通过体外注射抑制CD4+CD25+调节性T细胞活性药物,可有效减轻小鼠体内免疫抑制情况[12]。针对上述现象,目前主要有两种可能假设:肿瘤发生后,刺激CD4+CD25+调节性T细胞增殖,继而引起免疫抑制;肿瘤表面抗原使CD4+CD25+调节性T细胞发生常规增殖[13]。
为了进一步分析并探讨卵巢癌患者腹水及外周血CD4+CD25+调节性T细胞含量及抑制功能,进行本次调查研究,结果发现,56例腹水患者CD4+CD25+ T cells/CD4+ T cell为(2834±1327)%,56例外周血标本CD4+CD25+ T cells/CD4+ T cell为(1456±436)%。腹水和外周血标本CD4+CD25+ T cells/CD4+ T cell指数有显著差异,经统计学检验,差异具有统计学意义(P<005)。有报道指出,CD4+CD25+调节性T细胞并不能用来研究其抑制功能,但因腹腔转移是卵巢癌患者主要转移途径,且部分研究报道中确实提出腹水内该调节性T细胞能在一定程度上预测疾病进展[14]。同时,本次研究中显示腹水Treg抑制功能比外周血Treg强,经统计学检验,差异具有统计学意义(P<005)。这可能说明CD4+CD25+调节性T细胞对肿瘤趋化、募集有一定作用,通过作用于趋化因子等诱导细胞迁移[15]。
综上所述,腹水Treg含量及抑制功能比外周血Treg强,提示卵巢癌腹腔内相对容易发生免疫逃逸,而Treg升高可能参与促进肿瘤复发。
参考文献
[1]温岩,孙晓艳,何津,等.卵巢癌患者外周血CD4+CD25+调节性T细胞的检测及其临床意义.中国实验诊断学,2010,14(9):1402-1405.
[2]冯勤梅,狄文,吴霞,等.卵巢癌患者一线化疗后CD8+T细胞和NK细胞数量及功能动态变化的研究.中国免疫学杂志,2010,26(1):23-28.
[3]于渊,李岩,荣风年,等.自体CIK细胞治疗对卵巢癌调节性T细胞的影响.山东大学学报(医学版),2010,48(5):101-104.
[4]王英丽,张阳,刘力华,等.手术前后卵巢癌患者外周血T细胞亚群及CD4+CD25+调节性T细胞表达及临床意义.中国妇幼保健,2010,25(30):4363-4364.
[5]荆结线,乔丽娟,郭爱芝,等.卵巢癌患者外周血CD4+ CD25hi CD127lo调节性T细胞格局变化及临床意义.中国免疫学杂志,2012,28(1):49-53.
[6]Hu JL, Yang Z, Tang JR, et al. Effects of gastric cancer cells on the differentiation ofTreg cells. Asian Pacific Journal of Cancer Prevention, 2013, 14(8): 4607-4610.
[7]罗微,温茜,周明乾,等.抗人卵巢癌/抗人CD3单链双特异性抗体介导的αβ T细胞CDR3谱系漂移.南方医科大学学报,2012,32(7):919-923.
[8]于晓伟,张松灵,何津,等.CD4+CD25+调节性T细胞与卵巢癌的相关性研究.中国妇幼保健,2010,25(18):2553-2556.
[9]Odunsi K, Matsuzaki J, Karbach J, et al. Efficacy of vaccination with recombinant vaccinia and fowlpox vectors expressing NY-ESO-1 antigen in ovarian cancer and melanoma patients. Proc Natl Acad Sci USA, 2012, 109(15): 5797-5802.
[10]邱君君.雌激素、辅助性T细胞/调节性T细胞与卵巢癌相关性研究进展.国际妇产科学杂志,2013,40(1):57-60.
[11]沈玮,田庚.CD4+CD25+Treg细胞、TGF-β1和IL-10在上皮性卵巢癌中的变化.中国老年学杂志,2011,31(24):4776-4778.
[12]郎巍,汪君,王雪野,等.卵巢癌患者外周血CD4+CD25(high)调节性T细胞及FOXp3的检测及临床意义.中国妇幼保健,2011,26(19):2981-2983.
[13]曾杰,张荣玲,杨星梅,等.Treg阻滞与免疫抑制调节-卵巢癌治疗的新策略.中国现代药物应用,2010,4(19):231-233.
[14]左建中,夏姿芳,钟永,等.上皮性卵巢癌患者外周血CD4+CD25high调节性T细胞分析.实用预防医学,2010,17(6):1083-1086.
[15]施展,曾晓颖.CD4+CD25+调节性T细胞与肿瘤免疫研究进展.老年医学与保健,2011,17(6):386-389.
