可见光下掺N附Ag纳米TiO2的光催化降解甲基橙
2016-03-09张鹏飞李晓维伍兴科
张鹏飞,李晓维,伍兴科
可见光下掺N附Ag纳米TiO2的光催化降解甲基橙
张鹏飞,李晓维,伍兴科
(中南大学化学化工学院,长沙410083)
采用溶胶–凝胶法制备纯TiO2和掺氮TiO2纳米颗粒(N-TiO2),然后通过光催化还原在其表面附Ag,得到表面附Ag 的纳米TiO2(即Ag/TiO2)和掺N附Ag纳米TiO2(即Ag/N-TiO2),利用X射线衍射(XRD)、场发射扫描电镜(FE-SEM)、光致发光光谱仪(photoluminescence spectroscopy, PL)、X射线光电子能谱(XPS)以及紫外可见漫反射光谱分析(UV-VIS DRS)对TiO2及其掺杂改性后的组成和结构、光吸收性能以及可见光下对甲基橙溶液的光催化活性等进行表征。结果表明,所有样品均为锐钛矿型,Ag/TiO2的平均晶粒度为20.4 nm;N以替代型N-Ti-O、间隙型Ti-O-N(或氧化态Ti-O-N-O)的形式存在于晶格中,银以Ag0形式附着在TiO2表面;N掺杂抑制TiO2晶粒的生长,并抑制光生电子与空穴的复合,从而促进TiO2对可见光的吸收;表面附Ag对TiO2晶格没有明显影响,但在450~580 nm可见光区产生强烈的表面等离子吸收带并延长至近红外区。TiO2及其掺杂改性后对甲基橙的光催化效果为Ag/N-TiO2>Ag/TiO2>N-TiO2>TiO2(或Degussa P25), Ag/N-TiO2在可见光下对甲基橙(pH=3)进行光催化降解,150 min时降解率达到95%。
N掺杂;Ag沉积;纳米TiO2;可见光;甲基橙;光催化降解
能源与环境问题一直都受到重视。光催化技术能够同时解决能源与环境问题,并且不会产生二次污染。TiO2由于无毒、价格低廉、光催化效率高及其物化性质稳定,被认为是1种具有广阔应用前景的光催化剂。但由于TiO2的带隙宽度(3.2 eV)较宽,并且光生电子与空穴容易复合,从而导致TiO2只能在波长<380nm的紫外光区(约占太阳光区的5%)才被激发,且光量子效率较低[1]。为克服这一缺陷,研究人员采用包括贵金属(Pa,Pt,Au,Ag等)沉积、非金属掺杂、过渡金属掺杂、半导体复合、染料敏化等方法单独或共同对TiO2结构进行改变,使得TiO2在可见光区能够响应。其中,非金属如N,C,S,F,I等掺杂能有效促进TiO2对可见光区的吸收,并抑制光生电子与空穴复合[2−4],其中尤以N掺杂较实用和有效[2, 5]。沉积在TiO2表面的Ag不仅能与TiO2界面形成Schottky能垒而促进电子和空穴的分离[6−7],而且在可见光区产生强等离子体吸收带而促进TiO2对可见光的吸收[8]。另外,沉积在TiO2表面的纳米Ag0有利于TiO2对溶解氧和有机污染物的吸附[9−11]。本研究采用溶胶–凝胶法制备掺N的TiO2纳米颗粒(N-TiO2),然后通过光催化还原在其表面附Ag,制备掺N附Ag纳米TiO2(即Ag/N- TiO2),对Ag/N- TiO2的结构与光学性能进行分析,检测电子空穴对的复合情况,并以甲基橙作为燃料模型化合物,在可见光下进行光催化降解实验,研究Ag/N-TiO2的光催化活性,以期通过掺氮和表面附银的协同改性,进一步提高纳米TiO2的光催化活性,对于进一步扩大TiO2光催化剂的应用具有重要意义。
1 实验
1.1 主要试剂
实验用主要试剂的名称与生产厂家如下:钛酸正丁酯,国药集团化学试剂有限公司;无水乙醇,西陇化工股份有限公司;乙酰丙酮,天津市光复精细化工研究所;三乙胺;硝酸银,天津市光复精细化工研究所;甲基橙,西陇化工股份有限公司;乙二胺四乙酸二钠,国药集团化学试剂有限公司;盐酸,株洲市石英化玻有限公司;德国Degussa公司生产的纳米TiO2(Degussa P25)。
1.2催化剂制备
采用溶胶–凝胶法制备N掺杂纳米TiO2。制备过程如下:在80 mL无水乙醇中加入30 mL钛酸正丁酯与3 mL螯合剂乙酰丙酮,35 ℃下搅拌30 min后,按照N与Ti的优化配比(N)/(Ti)=4%加入三乙胺作为N源,持续搅拌1 h得到溶液A;在持续搅拌条件下将4.5 mL蒸馏水加入到40 mL无水乙醇中,用5 mol/L浓度的HCl调节pH值为1.5,得到溶液B;在剧烈搅拌下,将溶液B缓慢滴加到溶液A中,滴加完毕继续搅拌2 h,得到均匀透明黄色的溶胶。溶胶于40 ℃下陈化24 h,然后80 ℃下干燥24 h,得到无定型干凝胶。将干凝胶在玛瑙研钵中研磨后,在450 ℃下焙烧3 h,得到N掺杂纳米TiO2,记为N-TiO2。采用相同的工艺,不加入三乙胺,得到纯纳米TiO2。
通过光催化还原在N掺杂纳米TiO2表面沉积金属银。称量2 g N-TiO2加入到400 mL乙醇水溶液((CH3CH2OH):(H2O)=19:1),超声分散30 min,按照Ag与Ti的优化配比(Ag)/(Ti)=0.5%加入浓度为0.1 mol/L的AgNO3溶液,避光搅拌10 min,再加入EDTA-2Na作为Ag+的络合剂,避光搅拌30 min。最后转移到500 W的高压汞灯下照射20 min,抽滤洗涤后,在60 ℃下避光真空干燥12 h,即得到掺N附Ag纳米TiO2样品,记为Ag/N-TiO2。采用同样方法制备附Ag纳米TiO2,记为Ag/TiO2。
1.3 性能表征
用辽宁丹东方圆仪器有限公司生产的DX−2700型X射线衍射仪(XRD)对TiO2及其掺杂改性后的物相组成和结构进行分析;催化剂的形貌特征采用美国FEI公司生产的NanoSEM 230型场发射扫描电镜(FE- SEM)进行观察与分析。用日本岛津公司的U− 4100型带积分球的紫外可见漫反射分光光度计(UV-Vis DRS)测试样品的光吸收性能;用美国Thermal Fisher Scientific公司生产的VG-Multilab2000型X射线光电子能谱仪(XPS)测定样品中各元素的价态;用美国Welltech Enterprises公司的Hitachi F−4500型光致发光光谱仪(PL)检测电子空穴对的复合情况。
1.4 光催化性能测试
可见光下TiO2对甲基橙(methyl orange,MO)的光催化实验在北京畅拓科技有限公司生产的容量为1000 mL,内部装有500 W高压汞灯的光催化反应器中进行。MO是1种较难降解的偶氮有色染料,主要结构分为偶氮型(碱性条件下)和醌式型(酸性条件下)2种。因此,以其作为染料模型化合物具有一定的代表性。称取0.4 g催化剂样品加入到100 mL质量浓度为20 mg/L的甲基橙溶液中,用浓度均为1 mol/L 的HCl与NaOH调节甲基橙溶液的pH值为3[12−13],避光搅拌30 min后转移到光催化反应器中进行光催化降解实验。每间隔一定时间吸取降解液进行离心分离,取上清液测定吸光度或扫描UV-Visible吸收光谱。根据朗伯−比尔定理,降解液中甲基橙的浓度与降解液的吸光度成正比,则甲基橙的降解率为[(0−A)/0]× 100%。0与A分别为催化降解前与降解时间后的甲基橙溶液的吸光度。
2 结果与讨论
2.1 XRD分析
图1所示为纯纳米TiO2,Ag/TiO2,N-TiO2和Ag/N-TiO2的XRD谱。由图可见所有样品均为锐钛矿型(JCPDS21-1272),位于25.258°,37.766°,47.985°,53.849°,55.040°及62.687°处的衍射峰分别对应(101),(004),(200),(105),(211)及(204)晶面。N-TiO2的衍射峰比TiO2的宽,说明N掺杂可抑制TiO2晶粒的生长。没有发现任何N化合物的衍射峰,表明N进入TiO2晶格并取代晶格中的O,或以其它形式存在于TiO2晶格中。Ag/TiO2和Ag/N-TiO2的XRD谱中都没有出现Ag及Ag的氧化物衍射峰,分别与TiO2及N-TiO2的XRD谱相似,这表明Ag0均匀地高度分散于TiO2表面,对TiO2晶粒大小未产生显著影响。

图1 TiO2及其改性后的XRD谱
采用Rietveld法可精确获取TiO2的晶胞参 数[14−15]。因此,借助DBWS的计算程序,采用Rietveld法对XRD谱进行精修,获得晶胞参数。各样品的平均晶粒尺寸()用式(1)所示Scherrer半经验方程进行计算[16]:
=0.9/cos(1)
式中:为X射线的波长,=0.154 nm;为(1 0 1)晶面衍射峰的半高宽(FWHM);为布拉格衍射角度。表1所列为TiO2及其改性后的晶胞参数与平均晶粒尺寸。从表1可知:N掺杂进入TiO2晶格,使TiO2晶格产生畸变,从而抑制晶粒的生长,导致TiO2晶粒尺寸减小;TiO2表面附Ag0对TiO2晶格及粒径都没有显著影响。

表 1 TiO2及其改性后的晶格参数、粒径、吸收边和禁带宽度
2.2 FE-SEM分析
图2所示为纯TiO2和Ag/N-TiO2的SEM形貌,从图中可看到这2个样品均呈球形。与纯TiO2相比,Ag/N-TiO2颗粒分布更加均匀,粒径变小,因此能够与溶液中更多的水和氧接触,产生更多具有强氧化性的羟基自由基,从而提高催化剂的光催化活性[17]。

图 2 纯TiO2与Ag/N-TiO2的SEM形貌
2.3 UV-Vis DRS分析
图3所示为TiO2, N-TiO2,Ag/TiO2和Ag/N-TiO2的紫外可见漫反射光谱(UV-Vis DRS光谱)。总体上看,改性后TiO2的吸收边都产生明显的红移,在可见光区(400~800 nm范围内)均有不同程度的吸收。从图3可知 TiO2,N-TiO2,Ag/TiO2和Ag/N-TiO2的吸收边分别为391,431,413及493 nm,对应的带隙宽度由下式进行计算[15]:

图3 TiO2及其改性后的紫外可见漫散射吸收光谱
式中:g与m分别表示催化剂的带隙宽度和吸收边,计算结果列于表1。纯TiO2的带隙宽度为3.17 eV,略小于标准值(3.20 eV)[16]。N-TiO2的吸收边扩展至413 nm,带隙宽度为3.00 eV,说明N掺杂使得TiO2禁带变窄,在可见光区产生吸收。N-TiO2的带隙窄化是由于N取代晶格中的O而使得N2p位于价带O2p的顶端,N2p与O2p相互杂化,从而在价带顶端引入一个局部的杂质能级;可见光下电子能够从杂质能级激发到导带,使得N-TiO2具有光催化活性[18−19]。此外,N掺杂过程伴随产生O空位及顺磁性的Nb·体相中心,这是N-TiO2具有强可见光吸收的另一重要原因[20−21]。Ag/TiO2与Ag/N-TiO2的吸收边不仅产生更大的红移,并在450~580 nm可见光区产生强烈的表面等离子体吸收带,尾部延长至近红外区,与典型的表面等离子体吸收峰(≈400 nm)相比,产生了红移与宽化现象[22]。根据KAMAT[23]的观点,N与表面纳米Ag单质间存在的电荷平衡(导致两者复合体的费米能级向更负的电势方向移动)是导致Ag/N-TiO2催化剂吸收边产生红移的主要原因。
2.4 XPS分析
图4所示是Ag/N-TiO2(其中(N)/(Ti)=4%;(Ag)/(Ti)=0.5%)的Ti2p,O1s,N1s和Ag3d的XPS图谱。图4(a)中结合能为458.12 eV和464.12 eV处的峰为TiO2晶格中Ti4+的特征峰,分别对应Ti2p3/2和Ti2p1/2.。Ti2p3/2的结合能(458.12 eV)比标准值(458.60 eV)[23]低0.48 eV,是由于N掺杂后产生Ti3+(结合能457.40 eV)所致[24−25]。图4(b)中的3个峰分别位于529.83,531.11和532.60 eV。529.83 eV处的峰归属为Ti-O[26−28]。531.11 eV和532.60 eV处的特征峰,有可能是亚化学计量氧化物、氮氧化物或吸附的 水[28−29]。TiO2与吸附H2O可发生H2O+Ti-O-Ti→2Ti- OH的反应,同时热处理后残留有微量含C-O的残余物[30]。因此,将531.11 eV和532.60 eV处的峰分别归属为Ti-OH和C-O。有学者把这2个峰归结为间隙式Ti-O-N[5,26]。从图4(c)可知,N1s的XPS图谱是一个从397 eV到403 eV的宽谱,2个峰分别位于399.85 eV和401.42 eV。由于制备方法及条件不同,N1s峰出现在396,400和402 eV这几个位置,常把396 eV峰归属于N−Ti[29, 31],但图4(c)中并没有与之对应的峰。由于O的电负性比N的电负性大,当N替代TiO2晶格中的O时,N周围的电子云密度降低,使得N1s的结合能向比较正的方向移动。VALENTIN等[19]通过实验及理论计算提出:对于N掺杂的TiO2,同时存在替代型N和间隙型N。由于O的电负性比N的电负性大,当N替代TiO2晶格中的O时,N周围的电子云密度降低,使得N1s的结合能向较正的方向移动。因此,很多学者[5, 27, 32]把略低于400 eV的峰归为N替代TiO2晶格中O形成的N—Ti—O键,把400∼403 eV的峰归结为间隙式的Ti-O-N或氧化态的Ti-O-N-O。有部分学者[28, 33−34]认为400∼403 eV的峰是吸附在TiO2表面的N2或NH3。此外,由于N3−与O2−间电荷不平衡,当N替代TiO2晶格中的O时,部分Ti4+被还原为Ti3+[25]。而N3−被氧化为N−存在于N—Ti—O键中[5]。即存在以下反应:
N3−−2e→N−(3)
2Ti4++2e→2Ti3+(4)

图4 Ag/N-TiO2的X射线光电子能谱
2.5 PL分析
光致友光光谱(PL)可以揭示光生电子与空穴的复合情况:电子与空穴复合率与发射光谱的强度成正 比[6]。图5所示为TiO2, N-TiO2,Ag/TiO2和 Ag/N-TiO2的PL光谱图。PL光谱图清晰地表明,4个样品的光生电子空穴对复合率从高到低依次为:TiO2,N-TiO2,Ag/TiO2和Ag/N-TiO2,这说明N掺杂及表面附Ag能有效抑制电子空穴对的复合,从而提高TiO2的光催化效率。N掺杂可在TiO2中形成能捕获光剩电子的杂质能级,表面Ag0与TiO2界面形成Schottky能垒,这2者均可促进电子和空穴分离,从而提高光催化效 率[6−7, 37]。
2.5 光催化降解甲基橙
图6所示为分别用纯TiO2,N-TiO2,Ag/TiO2和Ag/N-TiO2作催化剂,在可见光下甲基橙(pH=3)的降解率随时间的变化。图6表明德国生产的纳米TiO2(P25)及本研究制备的纳米TiO2在可见光下对甲基橙都没有降解作用;降解150 min时,用Ag/N-TiO2作催化剂的甲基橙降解率达到95%,Ag/TiO2作催化剂的降解率达到46%,N-TiO2作催化剂的降解率达到32%。图7所示为用Ag/N-TiO2催化剂降解不同时间后甲基橙溶液的紫外可见吸收光谱,图7进一步表明甲基橙在150 min内几乎完全降解,降解速率随时间延长不断减小。

图5 TiO2,N-TiO2,Ag/TiO2和Ag/N-TiO2的PL图谱
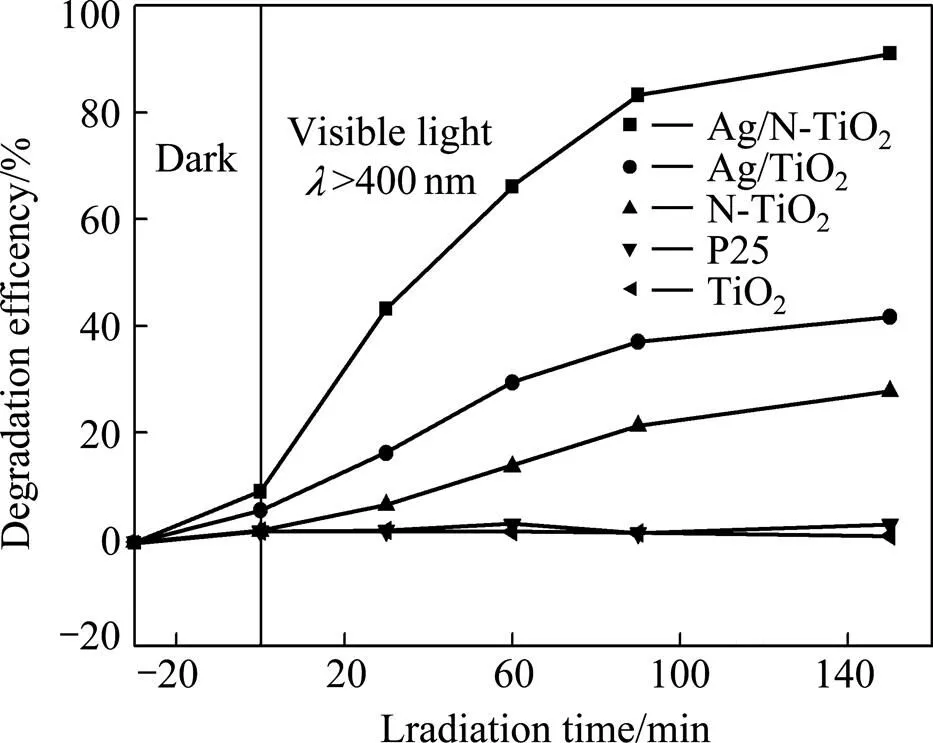
图6 可见光下各催化剂对甲基橙的降解率随降解时间的变化

图7 用Ag/N-TiO2催化剂降解不同时间后甲基橙溶液的UV-Visible吸收光谱
图6表明改性后的TiO2在可见光下均有催化活性,只是催化效率不同。可见光下,150 min内N-TiO2对MO的降解效率为35%。这主要是N掺杂后,在TiO2能带中形成能够有效捕获光生电子的杂质能级,从而抑制电子空穴的复合,提高催化效率。另外,也与N掺杂形成的一些中间活性物质,形成顺磁性的Nb·体相中心有关[20, 39]。可见光下,Ag/TiO2在150 min内对MO降解效果比N-TiO2好,达到46%。这是因为:1) 沉积在TiO2表面的纳米Ag与纳米TiO2的界面形成Schottky能垒,使得光生电子向Ag颗粒上不断迁移并富集,促进电子和空穴的分离,从而提高光催化活性[6−7];2) TiO2表面的纳米Ag使得TiO2表面的电子云密度下降,有利于锐钛矿TiO2的(101)晶面吸附O2,使得光生电子与更多的O2反应生成·,·HO2,H2O2以及·OH等活性物质,从而进一步提高催化剂的催化活性[9−10];3) 经过Ag修饰以后的TiO2对含N,S功能团的有机化合物(如MO)具有强烈的吸附作用,富氧(来自锐钛矿TiO2(101)晶面的O2吸附)状态下MO与TiO2之间以S—O键的形式连接[10−11];4) 从UV-Vis分析结果可知,纳米Ag单质在可见光下的等离子吸收也有助于催化剂活性的提高。相同时间内,Ag/N- TiO2具有高催化效果,15 min内降解率达到95%,这是N和Ag协同作用的结果,并且Ag对催化效果的贡献更明显。
3 结论
1) 采用溶胶−凝胶与光催化还原法可制备平均晶粒度为20.4 nm的锐钛矿型纳米Ag/N-TiO2催化剂。
2) N以替代型N-Ti-O和间隙型Ti-O-N(或氧化态Ti-O-N-O)的形式存在于晶格中,抑制TiO2晶粒的生长,阻止光生电子空穴的复合,促进TiO2对可见光的吸收。银以Ag0形式附着在TiO2表面,对TiO2的晶格不会产生明显的影响,但在450~580 nm可见光区形成强烈的表面等离子体吸收带并延长至近红外区。这是掺N附Ag纳米TiO2在可见光下具有高光催化活性的主要原因。
3) 可见光(>400 nm)下,用掺N附Ag纳米TiO2作催化剂,15 min后甲基橙(pH=3)的降解率达到95%。
慕俄格酒店作为云南建投集团自主经营酒店的“先行者”,其成功的管理模式及经营理念也将为建投集团在酒店行业的发展提供大量借鉴经验。为实现酒店经营工作指标的顺利完成,酒店结合自身实际,与旅游公司洽谈合作方式,依托丰厚的旅游资源推出避暑游产品路线,接待包括香港、广州、深圳在内的旅游团队,实现“无淡季”经营。随着酒店入住率持续攀升,一房难求已经成为慕俄格酒店的常态。截止目前,酒店近半年入住率高达80%以上,比同区域酒店的70%高出许多。会务、旅游团队接待已经占酒店接待的三分之二。通过创新迎客方式,敬酒歌等特色服务,不断推动酒店良性发展。
[1] SUBRAMANIAN V, WOLF E, KAMAT P V. Semiconductor- metal composite nanostructures: To what extent do metal nanoparticales improve the photocatalytic activity of TiO2films[J]. Journal of Physical Chemistry B, 2001, 105(46): 11439−11446.
[2] ASAHI R, MORIKAWA T, OHWAKI T, et al. Visible-light photocatalysis in nitrogen-doped titanium oxides[J]. Science, 2001, 293(5528): 269−271.
[3] SHAHED U M K, MOFAREH A S, WILLIAM B, et al. Efficient photochemical water splitting by a chemically modified n-TiO2[J]. Science, 2002, 297(5590): 2243−2245.
[4] WANG X H, LI J G, KAMIYAMA H, et al. Wavelength- sensitive photocatalytic degradation of methyl orange in aqueous suspension over iron(iii)-doped TiO2[J]. The Journal of Physical Chemistry B, 2006, 110(13): 6804−6809.
[5] CONG Y, ZHANG J, CHEN F, et al. Synthesis and characterization of nitrogen-doped TiO2nanophotocatalyst with high visible light activity[J]. Journal of Physical Chemistry C, 2007, 111(19): 6976−6982.
[6] LINSEBIGLER G L, YATES J T. Photocatalysis on TiO2surface. Principles, mechanisms, and selected results[J]. Chemical Reviews, 1995, 95: 735−758.
[7] YOU X, CHEN F, ZHANG J, et al. A novel deposition precipitation method for preparation of Ag-loaded titanium dioxide[J]. Catalysis letters, 2005, 102(2/3): 247−252.
[8] CHEN Y, HUANG W, HE D, et al. Construction of heterostuctured g-C3N4/Ag/TiO2microspheres with enhanced photocatalysis performance under visible-light irradiation[J]. ACS Applied Materials & Interfaces. 2014, 6(16): 14405−14414.
[9] LI X Z, LI F B. Study of Au/Au3+-TiO2photocatalysts toward visible photo-oxidation for water and wastewater treatment[J]. Environmental Science & Technology, 2001, 35(11): 2381− 2387.
[10] GUO J, WATANABE S, JANIK, et al. Density functional theory study on adsorption of thiophene on TiO2anatase (001) surfaces[J]. Catalysis Today, 2010, 149(1/2): 218−223.
[11] HUSSAIN A H M S, MCKEE M L, HEINZEL J M, et al. Density functional theory study of organosulfur selective adsorption on Ag-TiO2[J]. The Journal of Physical Chemistry C, 2014, 118(27): 14938−14947.
[12] MANDAL S S, BHATTACHARYYA A J. Electrochemical sensing and photocatalysis using Ag-TiO2microwires[J]. Journal of Chemical Sciences, 2012, 124(5): 969−978.
[13] SUWARNKAR M B, DHABBE R S, KADAM A N, et al. Enhanced photocatalytic activity of Ag doped TiO2nanoparticles synthesized by a microwave assisted method[J]. Ceramics International, 2014, 40(4): 5489−5496.
[14] GU D, YANG B, HU Y. V and N co-doped nanocrystal anatase TiO2photocatalysts with enhanced photocatalytic activity under visible light irradiation[J]. Catalysis Communications, 2008, 9(6): 1472−1476.
[15] WU M M, H Y M X. A preliminary research on V/N – TiO2self-cleaning thin film by sol–gel method under the guidance of first principle method density functional theory (DFT)[J]. Applied Catalysis B: Environmental, 2013, 129(3): 351−366.
[16] SHIRKE B S, KORAKE P V, HANKARE P P, et al. Synthesis and characterization of pure anatase TiO2nanoparticles[J]. Journal of Materials Science: Materials in Electronics, 2011, 22(7): 821−824.
[17] BASTOW J T, WITHFIELD H J, Evolution of crystalline TiO2from the Gel statet[J]. Chemical Materials, 1999, 11: 3518−3520.
[18] IRIE H, WATANABE Y, HASHIMOTO K. Nitrogen- concentration dependence on photocatalytic activity of TiO2[J]. The Journal of Physical Chemistry B, 2003, 107(23): 5483−5486.
[19] VALENTIN C, PACCHIONI G, SELLONI A, et al. Characterization of paramagnetic species in N-doped TiO2[J]. The Journal of Physical Chemistry B, 2005, 109(23): 11414− 11419.
[20] IHARA T, MIYOSHI M, IRIYAMA Y, et al. Visible-light-active titanium oxide photocatalyst realized by an oxygen-deficient structure and by nitrogen doping[J]. Applied Catalysis B, Environmental, 2003, 2(4): 403−409.
[21] LIVRAGHI S, PAGANINI M C, GIAMELLO E, et al. Origin of photoactivity of nitrogen-doped titanium dioxide under visible light[J]. Journal of the American Chemical Society, 2006, 128(49): 15666−15671.
[22] HE J, ICHINOSE I, KUNITAKE T, et al. In situ synthesis of noble metal nanoparticles in ultrathin TiO2[J]. Langmuir, 2002, 18(25): 10005−10010.
[23] KAMAT P V. Photophysical, photochemical and photocatalytic aspects of metal nanoparticles[J]. The Journal of Physical Chemistry B, 2002, 106(32): 7729−7744.
[24] SANJINÉS R, TANG H, BERGER H, et al. Electronic structure of anatase TiO2oxide[J]. Journal of Applied Physics, 1994, 75(6): 2945.
[25] SATOSHI H, AKI M, TSUGUO S, et al. Alternation of Ti2p XPS spectrum for TiO2by Ar Ion bombardment[J]. Journal of Surface Analysis, 2003, 9(3): 459−462.
[26] NAKANO Y, MORIKAWA T, OHWAKI T, et al. Deep-level optical spectroscopy investigation of N-doped TiO2films[J]. Applied Physics Letters, 2005, 86(13): 132104.
[27] LIU H, LIU G, SHI X. N/Zr-codoped TiO2nanotube arrays: Fabrication, characterization, and enhanced photocatalytic activity[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects 2010, 363(1/3): 35−40.
[28] LIU J, HAN R, ZHAO Y, et al. Enhanced photoactivity of V−N co-doped TiO2[J]. The Journal of Physical Chemistry C, 2011, 115(11): 4507−4515.
[29] HORIKAWA T, KATOH M, TOMIDA T. Preparation and characterization of nitrogen-doped mesoporous titania with high specific surface area[J]. Microporous and Mesoporous Materials, 2008, 110(2/3): 397−404.
[30] SAHA N C, TOMPKINS H G. Titanium nitride oxidation chemistry: An X-ray photoelectron spectroscopy study[J]. Journal of applied physics, 1992, 72(7): 3072.
[31] YU J G, ZHAO X J. Effect of surface treatment on the photocatalytic activity and hydrophilic property of the sol-gel derived TiO2thin films[J]. Materials Research Bulletin, 2001, 36(1/2): 97−107.
[32] LI D, HUANG H, CHEN X, et al. New synthesis of excellent visible-light TiO2−xNphotocatalyst using a very simple method [J]. Journal of Solid State Chemistry, 2007, 180(9): 2630−2634.
[33] PENG F, CAI L, HUANG L, et al. Preparation of nitrogen-doped titanium dioxide with visible-light photocatalytic activity using a facile hydrothermal method[J]. Journal of Physics and Chemistry of Solids, 2008, 69(7): 1657−1664.
[34] XU J, DAI W, LI J, et al. Simple fabrication of thermally stable aperture N-doped TiO2microtubes as a highly efficient photocatalyst under visible light irradiation[J]. Catalysis Communications, 2008, 9(1): 146−152.
[35] LIU J, QIN W, ZUO S, et al. Solvothermal-induced phase transition and visible photocatalytic activity of nitrogen-doped titania[J]. Journal of Hazardous Materials, 2009, 163(1): 273−278.
[36] XIN B, JING L, REN Z, et al. Effects of simultaneously doped and deposited Ag on the photocatalytic activity and surface states of TiO2[J]. The Journal of Physical Chemistry B, 2005, 109(7): 2805−2809.
[37] ZHAO W, GUO Y, FAIZ Y, et al. Facile in-suit synthesis of Ag/AgVO3one-dimensional hybrid nanoribbons with enhanced performance of plasmonic visible-light photocatalysis[J]. Applied Catalysis B: Environmental, 2015, 163: 288−297.
[38] DHOLAM R, PATEL N, ADAMI M, et al. Hydrogen production by photocatalytic water–splitting using Cr- or Fe-doped TiO2composite thin films photocatalyst[J]. International Journal of Hydrogen Energy, 2009, 34(13): 5337−5346.
[39] TACHIKAWA T, TAKAI Y, TOJO S, et al. Visible light-induced degradation of ethylene glycol on nitrogen-doped TiO2powders[J]. The Journal of Physical Chemistry B, 2006, 110(26): 13158−13165.
(编辑 汤金芝)
Photocatalytic degradation of methyl orange by N-doped and Ag-loaded nano-TiO2under visible light
ZHANG Pengfei, LI Xiaowei, WU Xingke
(College of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China)
N-doped and Ag-loaded nano-TiO2(Ag/N-TiO2), N-doped nano-TiO2(N-TiO2), Ag-loaded nano-TiO2(Ag/TiO2) and pure nano-TiO2(TiO2) were synthesized via sol-gel and photocatalytic reduction route. The as-prepared samples were characterized by X-ray diffraction (XRD), field emission scanning electron microscope (FE-SEM), photoluminescence spectrum (PL), X-ray photoelectron spectroscope (XPS) and UV-visible diffuser reflectance spectroscopy (UV-Vis DRS). The results show that, all samples are pure anatase and the average grain size of Ag/NT is 20.4 nm. N existes in TiO2lattice in forms of substituted N-Ti-O and interstitial Ti-O-N (or oxidized Ti-O-N-O). Ag is loaded on TiO2surface in the form of Ag0. N-doping can restrain the growth of grain, prevent the recombination of photoinduced electron and hole, so that it can promote the visible absorbance of TiO2. Ag0loaded on TiO2barely affects lattice parameters of TiO2, but significantly results in a strong surface plasmon absorbance band in the visible region of 450−580 nm, which can extend to near infrared region. The degradation rate is in the order of Ag/N-TiO2>Ag/TiO2>N-TiO2>TiO2(or Degussa P25). The degradation rate of methyl orange (MO) can reach 95% after visible light irradiation over Ag/N-TiO2for 150 min.
N-doping; Ag-loading; nano-TiO2; visible light; methyl orange; photocatalytic degradation
TQ615.1
A
1673−0224(2016)05−775−08
2015−12−22;
2016−06−08
张鹏飞,副教授,博士。电话:13874998869;E-mail: zpf@csu.edu.cn
