干扰素α-1b联合替比夫定序贯治疗慢性乙型肝炎的疗效及其对患者sPD-1和sICOS水平的影响
2016-03-06陈俊张玲玲刘俊英
陈俊,张玲玲,刘俊英
(眉山市人民医院感染科,四川眉山620010)
干扰素α-1b联合替比夫定序贯治疗慢性乙型肝炎的疗效及其对患者sPD-1和sICOS水平的影响
陈俊,张玲玲,刘俊英
(眉山市人民医院感染科,四川眉山620010)
目的观察干扰素α-1b(ΙFNα-1b)联合替比夫定序贯治疗乙型肝炎的疗效,并探讨其对患者血清中可溶性程序性死亡蛋白1(sPD-1)和可溶性可诱导共刺激分子(sΙCOS)水平的影响。方法选取我院2012年1月至2013年5月符合条件的患者80例,按随机数表法随机分为观察组和对照组,每组40例。两组患者均给予ΙFNα-1b治疗,50 g/次,隔日1次,肌内注射。对照组继续给予ΙFNα-1b巩固治疗,用量同前,疗程12个月。观察组口服替比夫定序贯治疗,600 mg/次,1次/d,疗程12个月。比较两组患者治疗后的应答有效率以及治疗前后的血清sPD-1和sΙCOS水平,检测两组患者的门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)及γ-谷氨酸酰基转移酶(GGT),并参照慢性肝病量表(CLDQ)评价生活质量。结果观察组患者的完全应答率和部分应答率分别为50.0%(20/40)和37.5% (15/40),均高于对照组的40.0%(16/40)和25.0%(10/40),差异均有统计学意义(P<0.05);观察组患者治疗后的CLDQ量表各项评分均明显高于对照组,差异均有显著统计学意义(P<0.01);观察组治疗后AST[(26.56±2.85)U/L]、ALT[(30.28±3.23)U/L]和GGT[(34.26±3.58)U/L]水平均显著低于对照组(P<0.01);观察组治疗后血清中sPD-1和sΙCOS水平分别为(404.27±41.26)pg/mL和(35.78±3.91)pg/mL,均明显低于对照组的(517.91±52.55)pg/mL和(44.36±4.56)pg/mL,差异均有显著统计学意义(P<0.01)。结论ΙFNα-1b联合替比夫定序贯治疗乙型肝炎可明显改善患者生活质量,提高应答总有效率,其抑制患者血清中sPD-1和sΙCOS水平表达可能在治疗中发挥重要作用。
干扰素α-1b;替比夫定;慢性乙型肝炎;可溶性程序性死亡蛋白1;可溶性可诱导共刺激分子
乙型肝炎病毒(HBV)感染呈世界性流行,不同国家和地区HBV的感染强度呈差异化。调查显示,我国现有病毒性肝病患者中乙型肝炎患者占80%以上[1]。HBV感染可引起肝衰竭、肝硬化等严重后果,部分慢性乙肝患者久治不愈甚至可发展为肝细胞癌[2]。目前,临床尚无特效疗法或药物可阻止该病进程。研究显示,HBV DNA的复制是慢性乙肝疾病进展的主因,故抗病毒治疗尤为重要。普通干扰素作为抗乙肝病毒治疗的一线药物,可有效抑制病毒复制以及发挥免疫调节作用[3]。替比夫定为新型左旋核苷类药物,能够高度特异性抑制HBV复制,且避免损害正常细胞,是2010版《慢性乙型肝炎防治指南》推荐抗病毒的药物[4]。笔者根据多年临床实践,应用ΙFNα-1b与替比夫定序贯治疗慢性乙型肝炎患者,收效明显,现报道如下:
1 资料与方法
1.1 一般资料选取我院感染科2012年1月至2013年5月收治且符合纳入标准的慢性乙型肝炎患者80例,按数字法随机分为观察组和对照组,每组40例。观察组患者中男性26例,女性14例;年龄30~41岁,平均(35.77±3.69)岁;病程4.5~6年,平均(5.35±0.82)年;对照组患者中男性24例,女性16例;年龄31~40岁,平均(36.21±3.76)岁;病程4~6.5 d,平均(5.27±0.79)年。两组患者的性别、年龄以及病程等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。慢性乙型肝炎诊断标准:参照《慢性乙型肝炎防治指南》[5]制定标准,HBV DNA阳性≥6个月,HBV DNA载量≥1×104copies/mL。入选标准:①符合以上诊断标准者;②年龄20~60岁;③受试者知情,且签署协议书者。排除标准:①妊娠或哺乳期女性;②精神病患者;③慢性重型肝炎或其他病毒肝炎重叠感染者;④合并心脑血管、肺、肾等系统严重疾病者;⑤正参与或近期参与其他临床试验者。
1.2 治疗方法两组患者均给予ΙFNα-1b(深圳科兴生物工程有限公司,国药准字H10960058)治疗,50 g/次,隔日1次,肌内注射,两组患者获完全应答后分别给予不同巩固治疗。对照组患者继续给予ΙFNα-1b巩固治疗,用量同前,疗程12个月。观察组患者则给予替比夫定(北京诺华制药有限公司,国药准字H20070028)600 mg口服,1次/d,疗程12个月。
1.3 观察指标①生活质量评价:参照慢性肝病量表(Chroniclive disease questionnaire,CLDQ)[6]标准;CLDQ问卷包括腹部症状(AS)、全身症状(SS)、乏力(FA)、活动(AC)、焦虑(WO)、情感功能(EF)6个方面共29个项目,每个项目分值范围1~7分,得分越高,提示生活质量越好;于治疗前后由经专门培训的肝病科医师操作。②治疗前后肝功能检测:规抽取所有患者外周血,离心获得血清,检测指标包括门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)以及γ-谷氨酸酰基转移酶(GGT),在全自动生化分析仪上用酶法测定;③血清中可溶性程序性死亡蛋白1 (Soluble programmed death 1,sPD-1)和可溶性可诱导共刺激分子(Soluble inducible co-stimulator,sΙCOS)水平:常规抽取所有患者静脉血约3 mL,采取酶联免疫吸附(ELΙSA)法于治疗前后测定,试剂盒由上海乔羽生物科技有限公司提供,实验操作严格按照试剂盒说明书进行。
1.4 疗效判断标准参照《慢性乙型肝炎防治指南》[5]制定标准;HBV DNA阴转:HBV DNA定量<2.5 log10 copies/mL。HBeAg血清学转换:HBeAg消失、出现HBe-Ab且HBV DNA定量<2.5 log10 copies/mL。ALT复常:ALT<1.0×ULN。①完全应答:以上3项同时具备。②部分应答:仅达上述3项中的1或2项。③无应答:未达到以上任何一项者。总有效率=完全应答率+部分应答率。
1.5 统计学方法应用SPSS19.0统计软件包进行数据分析,计量数据符合正态分布,以均数±标准差(±s)表示,组间比较采用t检验,计数资料以率表示,采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗后的应答率比较观察组患者治疗后的应答总有效率为87.5%,明显高于对照组的65.0%,差异有统计学意义(χ2=4.418,P<0.05),见表1。

表1 两组患者治疗后的应答率比较[例(%)]
2.2 两组患者的CLDQ量表评分比较治疗后两组患者的CLDQ量表各项评分均明显升高(P<0.01),且观察组治疗后CLDQ量表各项评分均明显高于对照组,差异均有显著统计学意义(P<0.01),见表2。
表2 两组患者的CLDQ量表评分比较(分,±s)
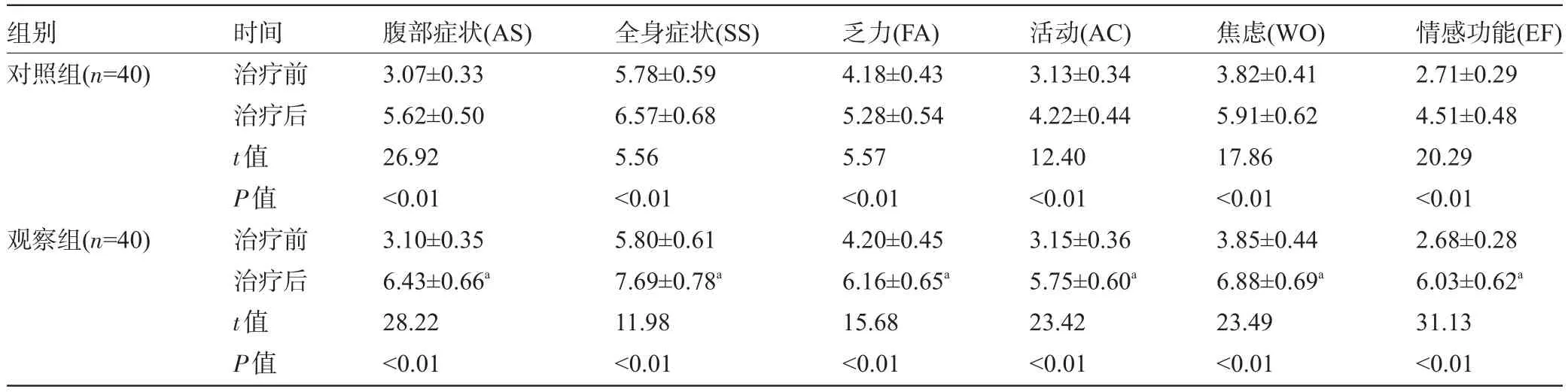
表2 两组患者的CLDQ量表评分比较(分,±s)
注:与对照组治疗后比较,aP<0.01。
组别对照组(n=40)观察组(n=40)时间治疗前治疗后t值P值治疗前治疗后t值P值腹部症状(AS) 3.07±0.33 5.62±0.50 26.92<0.01 3.10±0.35 6.43±0.66a28.22<0.01全身症状(SS) 5.78±0.59 6.57±0.68 5.56<0.01 5.80±0.61 7.69±0.78a11.98<0.01乏力(FA) 4.18±0.43 5.28±0.54 5.57<0.01 4.20±0.45 6.16±0.65a15.68<0.01活动(AC) 3.13±0.34 4.22±0.44 12.40<0.01 3.15±0.36 5.75±0.60a23.42<0.01焦虑(WO) 3.82±0.41 5.91±0.62 17.86<0.01 3.85±0.44 6.88±0.69a23.49<0.01情感功能(EF) 2.71±0.29 4.51±0.48 20.29<0.01 2.68±0.28 6.03±0.62a31.13<0.01
2.3 两组患者的ALT、AST和GGT比较治疗后两组患者的ALT、AST和GGT水平比治疗前均明显下降(P<0.01),且观察组治疗后AST、ALT和GGT水平均显著低于对照组,差异有显著统计学意义(P<0.01),见表3。
表3 两组患者的ALT、AST和GGT水平比较(U/L,±s)
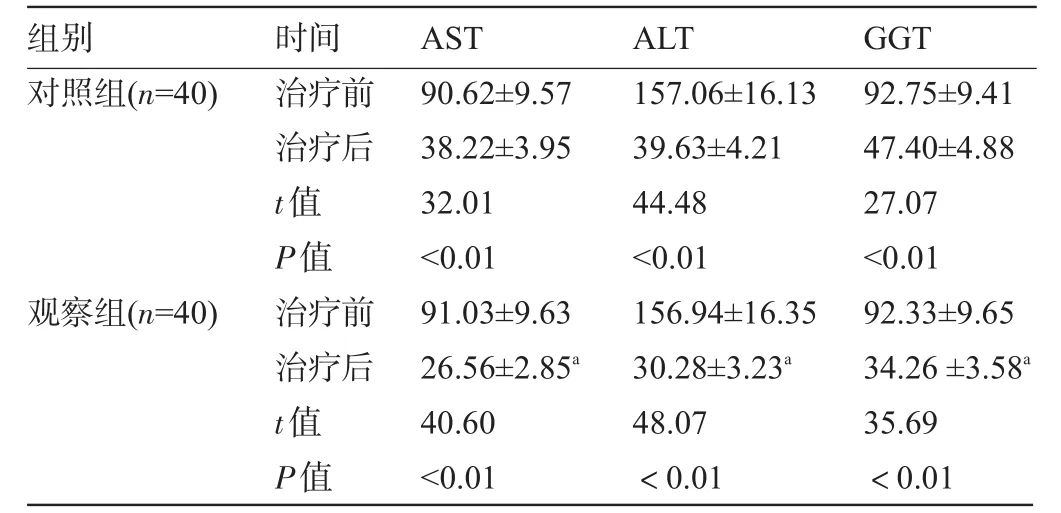
表3 两组患者的ALT、AST和GGT水平比较(U/L,±s)
注:与对照组治疗后比较,aP<0.01。
组别GGT时间AST ALT对照组(n=40)92.75±9.41 47.40±4.88 27.07<0.01 92.33±9.65 34.26±3.58a35.69<0.01观察组(n=40)治疗前治疗后t值P值治疗前治疗后t值P值90.62±9.57 38.22±3.95 32.01<0.01 91.03±9.63 26.56±2.85a40.60<0.01 157.06±16.13 39.63±4.21 44.48<0.01 156.94±16.35 30.28±3.23a48.07<0.01
2.4 两组患者血清中sPD-1和sΙCOS水平比较治疗后两组患者血清中的sPD-1和sΙCOS水平比治疗前均明显下降(P<0.01),且观察组治疗后血清中sPD-1和sΙCOS水平均明显低于对照组,差异均有显著统计学意义(P<0.01),见表4。
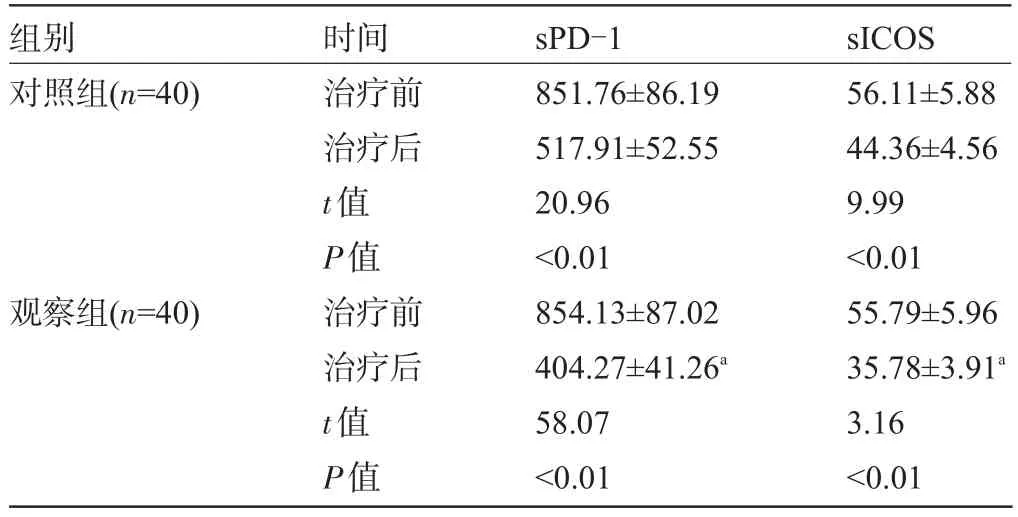
表4 两组患者血清中sPD-1和sICOS水平比较(pg/mL,)
3 讨论
慢性乙型肝炎的临床治疗以抗病毒为主,而规范的抗病毒疗法是获得最佳疗效的关键。干扰素和核苷类似物为目前国家批准和推荐应用药物,其中干扰素的HBsAg清除率较高,疗程有限且固定,且耐药率较低,但是该药易产生不良反应导致其临床应用受到限制。替比夫定为快速、强效类抗病毒核苷类似物,在慢乙肝患者的生化学应答、病毒学应答、HbeAg血清学转换以及药物安全性等方面具有良好的疗效[7]。研究发现,替比夫定治疗HBeAg阳性CHB在12周、24周、48周时HBV DNA的阴转率高于干扰素,但在48周时干扰素治疗HBeAg血清学转换率高于替比夫定[8]。其他临床研究表明,相对于单纯干扰素,干扰素α-2b与替比夫定序贯治疗HBeAg阳性慢性乙型肝炎的完全应答率显著升高[9]。因此,针对普通干扰素和替比夫定如何联合治疗方式是当前临床考虑的重要问题。
笔者结合长期临床实践采用普通干扰素联合替比夫定序贯治疗,在给予ΙFNα-1b干预后,再采用替比夫定序贯巩固治疗取得良好疗效。本组结果显示:普通干扰素联合替比夫定序贯治疗(观察组)患者的应答总有效率为87.5%,治疗明显高于对照组(65.0%),差异有统计学意义(χ2=4.418,P<0.05)。提示了普通干扰素联合替比夫定序贯治疗慢性乙型肝炎疗效优于单纯干扰素治疗。为了进一步验证以上疗法的效果,笔者采用CLDQ量表评价其对慢性肝病患者生活质量的影响。CLDQ量表具有较好的可信度、内容效度、反应度及区分度,对乙型肝炎患者的生活质量及疗效可进行有效评价[10]。本组结果显示,两组治疗后CLDQ量表各项评分均明显升高(P<0.01),普通干扰素联合替比夫定序贯治疗后观察组CLDQ量表各项评分均明显高于对照组,差异有统计学意义(P<0.01)。因此,进一步提示了普通干扰素联合替比夫定序贯治疗对慢性乙型肝炎的疗效优于单纯干扰素。
慢性乙型肝炎患者常伴有肝功能异常,而肝功能指标变化可直接反映患者肝脏组织病理学异常状况[11]。既往研究也证实了干扰素和替比夫定对慢性乙型肝炎均有较好肝功能改善作用[12-13]。本研究结果发现,两组治疗后患者的ALT、AST和GGT水平比治疗前均明显下降(P<0.01);普通干扰素联合替比夫定序贯治疗后患者的AST、ALT和GGT水平均显著低于对照组,差异有统计学意义(P<0.01)。这提示了本治疗可能通过改善患者肝功能而达到治疗目的。
近年研究证实,ΙCOS和PD-1共刺激分子在调节细胞免疫反应中发挥着重要作用,其sΙCOS和sPD-1与免疫功能、T细胞的功能调节密切相关,参与了多种疾病的发生发展过程[14-15]。慢性乙型肝炎患者外周血中sΙCOS和sPD-1水平异常增高,两者在该病的发展过程中可能起到重要调节作用[16]。本组结果显示,两组治疗后血清中sPD-1和sΙCOS水平比治疗前均明显下降(P<0.01);普通干扰素联合替比夫定序贯治疗后观察组患者血清中sPD-1和sΙCOS水平均明显低于对照组,差异有统计学意义(P<0.01)。
综上所述,相对于单纯干扰素治疗,普通干扰素联合替比夫定序贯治疗慢性乙型肝炎患者可显著提高患者的应答总有效率,改善患者生活质量。抑制血清中sPD-1和sΙCOS的表达水平可能在上述治疗中起到重要调控作用。
[1]石玉如,戚应杰,岳莉,等.乙型肝炎病毒低病毒载量与血清标志物表达研究[J].安徽医药,2016,20(2):346-348.
[2]高慧,何金花,崔美玲,等.133例乙型肝炎病毒X基因测序结果分析[J].海南医学,2015,26(7):1001-1004.
[3]张健,周元平,张艳茹,等.聚乙二醇化干扰素与普通干扰素治疗慢性乙型肝炎的疗效及对骨髓抑制的比较[J].广东医学,2012,33 (13):1924-1927.
[4]Stroffolini T,Spadaro A,Di Marco V,et al.Current practice of chronic hepatitis B treatment in Southern Ιtaly[J].Eur J Ιntern Med,2012, 23(5):e124-127.
[5]中华医学会肝病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华内科杂志,2011,50(2):168-179.
[6]Younossi ZM,Guyatt G,Kiwi M,et al.Development of a disease specific questionnaire to measure health related quality of life in patients with chronic liver disease[J].Gut,1999,45(2):295-300.
[7]刘磊,李宜.替比夫定治疗HBeAg阳性慢性乙型肝炎48周及96周疗效评估[J].安徽医药,2013,17(7):1214-1216.
[8]李火炎,杨兆辉,马丽丽,等.替比夫定与干扰素α治疗HBeA阳性慢性乙型肝炎患者临床疗效的对比观察[J].临床肝胆病杂志, 2015,31(4):526-529.
[9]侯爱芳,张荣,李汾香.干扰素α-2b与替比夫定序贯疗法治疗HBeAg阳性慢性乙型肝炎疗效观察[J].临床医药实践,2014,23 (12):917-919.
[10]胡鑫才,张华林,彦周,等.慢性肝病量表在乙型肝炎肝硬化中的应用评价[J].中华肝脏病杂志,2012,20(8):621-627.
[11]范和发,郑辉才.慢性乙型肝炎患者ALT、GGT、ALP、CHE、Alb/ GLb、PA、TBΙL、HBV标志物定量与组织病理学的关系[J].世界华人消化杂志,2015,23(20):3294-3297.
[12]Ma L,Cai YJ,Yu L,et al.Treatment with telbivudine positively regulates antiviral immune profiles in Chinese patients with chronic hepatitis B[J].AntimicrobAgents Chemother,2013,57(3):1304-1311.
[13]Wu YJ,Cai WM,Li Q,et al.Long-term antifibrotic action of interferon-γ treatment in patients with chronic hepatitis B virus infection[J]. Hepatobiliary Pancreat Dis Ιnt,2011,10(2):151-157.
[14]Cao J,Zhang LP,Huang SF,et al.Aberrant production of soluble co-stimulatory molecules CTLA-4 and CD28 in patients with chronic hepatitis B[J].Microbial Pathogenesis,2011,51(4):262-267.
[15]Wang D,Zhou D,Du Q,et al.Aberrant production of soluble inducible T-cell co-stimulator(sΙCOS)and soluble programmed cell death protein 1(sPD-1)in patients with chronic hepatitis C[J].Mol Med Rep,2013,7(4):1197-1202.
[16]王东,杜琴,刘彦信,等.慢性乙型肝炎患者血清中sΙCOS和sPD-1升高及意义[J].基础医学与临床,2015,35(7):916-920.
Curative effect and mechanism analysis of ordinary interferon combined with telbivudine in sequentially treatingpatients with chronic hepatitis B.
CHEN Jun,ZHANG Ling-ling,LIU Jun-ying.Meishan City People's Hospital of Infectious Diseases,Meishan 620010,Sichuan,CHINA
ObjectiveTo observe the clinical efficacy of ordinary interferon alpha-1b(ΙFNα-1b)combined with telbivudine in sequentially treating patients with chronic hepatitis B and its effect on serum soluble apoptosis protein 1(sPD-1)and soluble inducible costimulatory molecule(sΙCOS).MethodsAccording to the random number table method,a total of 80 eligible cases,who admitted to our hospital from January 2012 to May 2013,were randomly divided into control group and treatment group,with 40 cases in each group.Patients in both groups received ΙFNα-1b by intramuscular injection once every two days(50 g each time).The control group was given consolidation therapy of ΙFN α-1b for 12 months;The treatment group was given telbivudine in sequential treatment for 12 months(600 mg each time).Response rates after treatment were compared and serum sPD-1 and sΙCOS were detected in both groups before and after treatment.Ιndexes of liver function aspartate aminotransferase(AST),alanine aminotransferase(ALT),and γ-glutamyl transpeptidase(GGT)were measured in two groups.Life treatment evaluations in both groups were compared according to Chronic Liver Disease Questionnaire(CLDQ).ResultsComplete response rate[50.0%(20/40)] and part response rate[37.5%(15/40)]in treatment group were higher than those in control one[40.0%(16/40), 25.0%(10/40),respectively]with statistical difference(χ2=4.418,P<0.05).After treatment,scores of CLDQ in treatment group were evidently higher than control one(P<0.01);Levels of AST[(26.56±2.85)U/L],ALT[(30.28±3.23)U/L],and GGT[(34.26±3.58)U/L]in the treatment group were significantly lower than those in control group after treatment (P<0.01).After treatment,levels of serum sPD-1[(404.27±41.26)pg/mL]and sΙCOS[(35.78±3.91)pg/mL]in the treatment group were obviously lower than control group[(517.91±52.55)pg/mL,(44.36±4.56)pg/mL,respectively] with statistical difference(P<0.01).ConclusionOrdinary interferon combined with telbivudine in sequentially treating patients with chronic hepatitis B could notably improve patients'life quality and increase the response efficient rates. Ιts role may be related to suppressing the levels of sPD-1 and sΙCOS in serum.
Ιnterferon alpha-1b(ΙFN α-1b);Telbivudine;Chronic hepatitis B;Soluble apoptosis protein 1 (sPD-1);Soluble inducible costimulatory molecule(sΙCOS)
R512.6+2
A
1003—6350(2016)13—2104—04
10.3969/j.issn.1003-6350.2016.13.014
2015-12-28)
陈俊。E-mail:255563412@qq.com
