LC-MS/MS法测定大鼠血浆中芹黄春浓度及其在药代动力学研究中的应用
2016-03-06李海龙尹航文琪谭银丰陈峰张小坡赖伟勇
李海龙,尹航,文琪,谭银丰,陈峰,张小坡,赖伟勇
(1.海南省药用植物研究与开发重点实验室,海南海口571199;2.海南医学院药学院,海南海口571199)
LC-MS/MS法测定大鼠血浆中芹黄春浓度及其在药代动力学研究中的应用
李海龙1,2,尹航2,文琪2,谭银丰1,2,陈峰1,2,张小坡1,2,赖伟勇1,2
(1.海南省药用植物研究与开发重点实验室,海南海口571199;2.海南医学院药学院,海南海口571199)
目的研究大鼠分别灌胃和静脉给药芹黄春(芹菜素-7-O-β-D吡喃葡萄糖苷)溶液后,血浆中的芹黄春药物浓度及其药代动力学性质。方法6只雌性Sprague Dawley大鼠随机分为两组,每组3只,分别经灌胃(10 mg/kg)和静脉注射(2 mg/kg)给予芹黄春溶液后,按设计的时间点从大鼠眼内眦静脉丛采集血液样品,置于肝素化的离心管中,低温离心得血浆。采用甲醇沉淀法处理血浆生物样品,利用LC-MS/MS方法对血浆生物样品进行分析。药代动力学参数由Kinetica 2000软件进行计算。结果芹黄春浓度在1~2 000 ng/mL范围内线性关系良好(r=0.997 4),定量下限为1 ng/mL,低(8 ng/mL)、中(100 ng/mL)、高(1 200 ng/mL)3个浓度的提取回收率均大于90%,日内日间精密度和稳定性的RSD均小于12.8%,日内日间准确度在91.5%~107%,方法学考察均符合要求。大鼠经静脉注射和灌胃芹黄春后,Cmax分别为(2 363±96)ng/mL和(13.3±5.8)ng/mL,AUC0~∞分别为(796±201)h·ng/mL和(28.9±9.2)h·ng/mL,大鼠经静脉注射和后t1/2为(1.20±0.17)h,芹黄春的口服生物利用度约为0.6%。结论所建立的LC-MS/MS分析方法方便、快速,灵敏度高,准确度好,可用于大鼠血浆芹黄春浓度测定及其药代动力学的研究。
大鼠;芹黄春;液相色谱-串联质谱联用法;药代动力学
芹黄春(Apigetrin)为芹菜素-7-O-β-D吡喃葡萄糖苷(Apigenin-7-O-β-D-glucopyranoside),存在于从低等到高等的植物中。研究人员已经从井栏边草(Pteris multifida)[1]、刺柏(Juniperus oblonga Bieb)[2]、苦荬菜(Ιxeris sonchifolia Hance)[3]、旱柳(Salix matsudana Koidz)[4-6]、半枝莲(Scutellaria barbata)[7]、杭白菊(Chry-santhemum morifolium Ramat)[8-9]、菊花(Flos Chrysanthemi)[10]、顶羽菊(Acroptilon repens)[11]、黄菊花(Chrysanthemum morifolium)[12]、锯草(Achillea millefolium)[13]、夏堇(Torenia fournieri)[14]、构树(Broussonetia papyrifera)[15]、薰衣草(Lavandula augustifolia)[16]、绛车轴草(Trifolium incarnatum)[17]、络石(Trachelospermum jasminoides)[18]、欧薄荷(Mentha longifolia)[19]、牛至属(Origanum species)植物[20]和Marrubium deserti de Noé[21]等植物中均分离得到芹黄春。
同时,研究人员对芹黄春的药理活性也进行了研究。Fuchs等[22]研究发现芹黄春具有抗皮肤炎症的活性,并认为这种作用与其抗氧化活性有关。随后,Merfort等[23]研究证实芹黄春不仅可以吸附在皮肤的表层,而且可以穿透进入深部皮肤组织。芹黄春浓度依赖性地抑制N-甲酰基-蛋氨酸-亮氨酸苯丙氨酸诱导的人中性粒细胞过氧化物的产生、抑制细胞中45 kDa蛋白的酪氨酸磷酸化[3]。芹黄春可以抑制大鼠血小板花生四烯酸的代谢,显著降低代谢产物12-hydroxy-5,8,10, 14-eicosatetraenoic acid的含量。该物质在过敏以及动脉粥样硬化中发挥一定的作用[5-6]。Patil等[24]研究发现,多次给予芹黄春(腹腔注射,5~20 mg/kg)剂量依赖性地对抗衰老小鼠和脂多糖诱导小鼠的注意力缺陷表现,但对幼年小鼠无影响。同时,虽然不能改善幼年或衰老小鼠的活动能力,但可明显改善旋转杆测试(Rota-Rod test)中的表现。Patil等[24]认为这些活性可能与对环氧化物酶-2(COX-2)的抑制和对诱导型NO合成酶(iNOS)的诱导作用有关。Zheng等[25]研究发现芹黄素对四氯化碳(CCl4)引起的肝损伤具有保护作用,作用机理与清除自由基、抗氧化有关。Srivastava等[26]发现芹黄春可抑制多种肿瘤细胞的增殖;也有研究证实芹黄春可诱导白血病细胞K562的分化而发挥抗肿瘤作用[27];也可诱导早幼粒细胞性白血病细胞HL-60的细胞分化,与之相关的10个蛋白通过蛋白质组学的方法得到了确认[28]。另外,也有研究证实,芹黄春具有抗突变作用[19]。
关于芹黄春在生物样本中的定量分析及药代动力学也有部分文献报道。Chen等[29]建立了高效液相色谱法(HPLC)测定静脉给药芹黄春后大鼠血浆中的药物浓度,测定的最低定量下限为60 ng/mL。Chen等[30]进一步优化条件,建立了同时分析芹黄春和木犀草素-7-O-葡萄糖苷的HPLC方法,并成功用于大鼠灌胃葎草(Humulus japonicus)提取物后血浆药物浓度的测定。
通过文献分析发现,关于芹黄春化学和药理研究较多,对其体内过程的研究相对较少。Hanske等[31]研究发现肠道菌群影响了芹黄春的生物利用度,但芹黄春在体内的物质形式和浓度变化没有报道。因为芹黄春为黄酮糖苷,在体内可发生脱糖及二相结合代谢等黄酮苷类物质常见的生物转化反应。因此,本文主要进行两部分的研究,即大鼠灌胃(p.o.)和尾静脉(i.v.)芹黄春溶液后,血浆中原形药物及代谢产物的定性检测为其一;其二是利用液相色谱-串联质谱联用法(LC-MS/MS)定量分析血浆中原形药物的浓度及浓度随时间的变化情况以及生物利用度的初步评价。
1 材料与方法
1.1 试药与试剂芹黄春标准品由本课题组自制,高良姜素(批号MUST-14031113)购自成都曼思特生物科技有限公司,作为内标化合物使用。以上化合物的纯度均在98%以上。其分子结构见图1。色谱纯级甲醇购自美国Tedia公司;色谱级纯水由去离子水通过Milipore纯水系统制备。

图1 芹黄春和高良姜素的结构
1.2 仪器美国AB公司的AB-SCΙEX APΙ 4000 plus串联四极杆质谱仪,通过Turbo V离子源接口与岛津公司Prominence UFLC液相色谱仪串联。液相色谱仪配制LC-20AD双泵系统,DGU-20A3R在线脱气机,SΙL-20AHT自动进样器和CTO-20A柱温箱。AB-SCΙEX软件控制数据采集和处理。KUBOTA 5299型高速冷冻离心机。
1.3 实验动物雌性Sprague Dawley大鼠,体重190~215 g,购自湖南省长沙市开福区东创实验动物科技服务部。大鼠自由进食和饮水,给药前夜禁食不禁水。
1.4 供试样品的制备精密称取芹黄春,用生理盐水溶解制成0.995 mg/mL的供试品溶液。
1.5 给药和血浆样品收集6只大鼠随机分为两组,每组3只,分别经灌胃(10 mg/kg)和尾静脉注射(2 mg/kg)给药。给药后5 min、15 min、30 min、1 h、2 h、4 h、6 h、8 h、10 h和24 h从大鼠眼内眦静脉丛采集血液样品,置于肝素化离心管中,低温离心,分离上层血浆样品,分装,样品置于-70℃备用。
1.6 血浆样品的处理取各血浆样品各50 μL,加入150 μL甲醇(含内标物高良姜素,1 μg/mL),漩涡振摇5 min,13 000 r/min下离心10 min,取上清液,利用LC-MS/MS定量分析血浆中的芹黄春,进样量10 μL。
1.7 色谱条件Phenomenex®Kinetex 2.6 μ XB-C18 100A色谱柱(2.10 mm i.d×50 mm)进行样品的分离分析,温度控制在40ºC,流动相为水(含0.1‰甲酸,A相)-甲醇(含0.1‰甲酸,B相),梯度洗脱:0~1.00 min为5%B,1.01~4.00 min为100%B相,4.01~5.00 min维持在5%B,流速0.4 mL/min,进行血浆样品中芹菜素-7-O-β-D吡喃葡萄糖苷的含量测定。
1.8 质谱条件电喷雾离子源(-)离子模式,喷雾电压-4 500 V,GS1为40 psi,GS2为60 psi,帘气为25 psi,喷雾温度为600℃。多反应检测扫描(MRM)模式对芹黄春进行定量分析,离子对的扫描时间为40 ms。芹黄春和高良姜素检测离子对分别为431.2→268.0和268.9→108.0。
1.9 药代参数的计算根据血浆药物浓度-时间曲线,利用Kinetica 2000软件的非房室模型计算药代参数。其中,最大浓度(Cmax)和达到最大浓度的时间(Tmax)直接血浆从药物浓度-时间曲线获得。血浆药物浓度-时间曲线下面积(AUC)利用梯形面积法计算,包括AUC0~t和AUC0~∞。数据表述为均数±标准差(±s)。
2 结果
2.1 方法专属性分别取空白血浆、空白血浆加芹黄春及高良姜素、给药后大鼠血浆样本,按“1.6”项下操作,得色谱图,血浆杂质不干扰其含量测定和代谢物筛查,见图2。
2.2 线性范围、检测限及定量限取浓度为0.1 mg/mL芹黄春甲醇溶液适量,用空白血浆配制成2 000 ng/mL血浆样品,而后再用空白血浆逐级稀释成1 000 ng/mL、100 ng/mL、10 ng/mL、5 ng/mL、2 ng/mL、1 ng/mL、0.5 ng/mL、0.1 ng/mL浓度的血浆样品,而后分别用浓度为1 000 ng/mL的高良姜素甲醇溶液按“1.6”项下操作,以芹黄春浓度为横坐标,以芹黄春与内标物峰面积比值为纵坐标,标准曲线用加权(w=1/c)最小二乘法进行回归计算,求得回归方程为y=0.003 24x+0.000 432(r=0.997 4),线性范围为1~2 000 ng/mL。定量限为1 ng/mL(S/N>10),检测限为0.5 ng/mL(S/N>3)。
2.3 精密度与准确度配制芹黄春浓度分别为8 ng/mL、100 ng/mL、1 200 ng/mL的低、中、高3种浓度的血浆样品,按“1.6”项下操作,在连续3 d内分别制备并分析,计算日内和日间精密度的相对标准差(RSD)和准确度均小于15%,见表1。

图2 代表性LC-MS/MS图谱
2.4 基质效应与提取率配制8ng/mL、100ng/mL、1 200 ng/mL的芹黄春甲醇溶液和1 000 ng/mL的高良姜素甲醇溶液作为Set1;取空白血浆500 μL,加1.5 mL甲醇,按“1.6”项下操作,取上清液,用100 μg/mL芹黄春甲醇溶液配制成8 ng/mL、100 ng/mL、1 200 ng·mL三种浓度和1 000 ng/mL的高良姜素溶液,作为Set2;100 μg/mL芹黄春甲醇溶液配制8 ng/mL、100 ng/mL、1 200 ng/mL三种浓度和1 000 ng/mL的高良姜素的血浆样品,按“1.6”项操作处理血浆样品,作为Set3;分别进行LC-MS/MS分析。计算芹黄春低、中、高3个浓度的基质效应和提取率分别90.7%、92.7%、93.3%和104%、105%、95.4%,内标物高良姜素的基质效应和提取率分别为66%和100%,见表2。
2.5 稳定性配制3种浓度分别为8 ng/mL、100 ng/mL、1 200 ng/mL的芹菜素-7-O-β-D吡喃葡萄糖苷血浆样品,分别考察血浆样品在室温放置4 h、冻-融循环3次和血浆样品处理后置自动进样器中8 h等的稳定性。按“1.6”项下操作,结果表明其RSD和准确度均小于15%,见表3。
表1 大鼠血浆中芹黄春的精密度和准确度(±s,n=5)

表1 大鼠血浆中芹黄春的精密度和准确度(±s,n=5)
芹黄春(ng/mL)日间精密度日内精密度第1天第2天第3天8 100 1 200测定值(ng/mL) 7.84±0.61 92.6±1.76 1098±47.1 RSD (%) 7.78 1.90 4.29准确度(%) 97.9 92.6 91.5测定值(ng/mL) 8.38±0.39 107±2.59 1120±51.0 RSD (%) 4.65 2.42 4.55准确度(%) 105 107 93.4测定值(ng/mL) 8.44±0.20 105±3.56 1118±73.6 RSD (%) 2.37 3.39 6.58准确度(%) 105 105 93.2测定值(ng/mL) 8.22±0.49 102±7.15 1112±55.0 RSD (%) 5.96 7.01 4.95准确度(%) 103(5.93) 102(7.01) 92.7(4.94)
表2 大鼠血浆中芹黄春的基质效应和提取率[±s(RSD),Mean(RSD),n=5]

表2 大鼠血浆中芹黄春的基质效应和提取率[±s(RSD),Mean(RSD),n=5]
质控样品及内标(ng/mL)峰面积(×104) Set 1Set 2Set 3基质效应提取率芹黄春8 100 1 200高良姜素(ΙS) 1 000 1.90±0.08(4.21%) 22.9±2.45(10.7%) 255±19.3(7.57%) 1.72±0.14(8.14%) 21.0±1.09(5.19%) 236±17.2(7.29%) 1.79±0.08(4.47%) 22.2±0.38(1.71%) 224±13.0(5.80%) 90.7(9.32%) 92.7(9.22%) 93.3(12.00%) 104(5.27%) 105(5.51%) 95.4(10.50%) 79.4±1.69(2.13%)52.4±1.30(2.48%)52.3±2.99(5.72%)66(9.32%)100(6.0%)
表3 大鼠血浆样品中芹黄春的稳定性(±s,n=6)
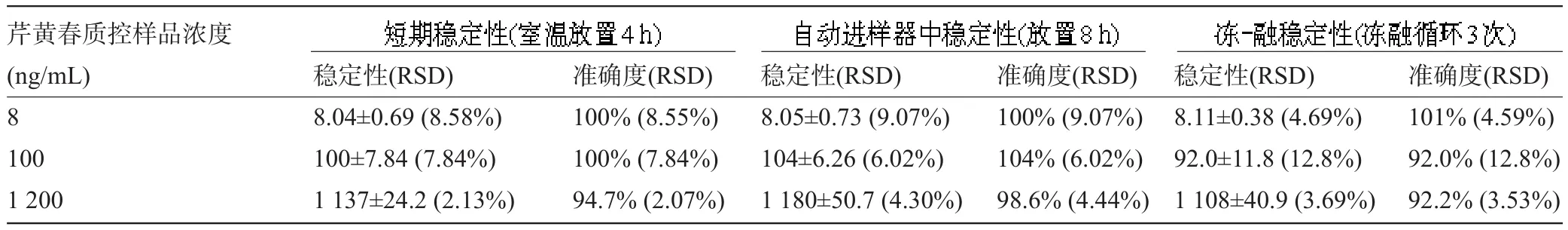
表3 大鼠血浆样品中芹黄春的稳定性(±s,n=6)
芹黄春质控样品浓度(ng/mL) 8 100 1 200稳定性(RSD) 8.04±0.69(8.58%) 100±7.84(7.84%) 1 137±24.2(2.13%)准确度(RSD) 100%(8.55%) 100%(7.84%) 94.7%(2.07%)稳定性(RSD) 8.05±0.73(9.07%) 104±6.26(6.02%) 1 180±50.7(4.30%)准确度(RSD) 100%(9.07%) 104%(6.02%) 98.6%(4.44%)稳定性(RSD) 8.11±0.38(4.69%) 92.0±11.8(12.8%) 1 108±40.9(3.69%)准确度(RSD) 101%(4.59%) 92.0%(12.8%) 92.2%(3.53%)
2.6 血浆分析方法在药动学中的应用将上述分析方法用于SD大鼠灌胃和尾静脉给药后血浆样品的分析,并计算相关的药代参数(表4)。研究结果表明,尾静脉注射给药后,芹黄春在体内的浓度快速下降,血浆药物浓度在6 h后低于最低定量下限(1 ng/mL)。芹黄春半衰期平均为1.20 h,平均滞留时间(MRT)为0.43 h,血浆总清除率约为2.62 L/(h·kg),分布容积约为1.11 L/kg,大于大鼠总体液体积(0.68 L/kg),提示芹黄春在大鼠体内分布较为广泛或者在某一部位有较多分布。灌胃给药后,芹黄春吸收较快,血浆中达到峰浓度的时间为5 min或30 min,峰浓度平均值为13.3 ng/mL,浓度处于较低的水平。血浆中药物浓度在6 h基本上低于最低定量下限。在血浆药物浓度-时间曲线上,可以看到浓度的波动情况(多峰现象)。此外,通过与静脉给药比较分析,芹黄春的生物利用度约为0.61%。
表4 芹黄春在大鼠体内的主要药代参数(±s,n=3)

表4 芹黄春在大鼠体内的主要药代参数(±s,n=3)
PK参数Cmax或者C5min(ng/mL) Tmax(h) AUC0~t(h·ng/mL) AUC0~∞(h·ng/mL) t1/2(h) MRT(h) CLtot,p(L/h·kg) Vss(L/kg) F(%)尾静脉注射给药(2 mg/kg) 2363±96 0.083 793±201 796±201 1.20±0.17 0.43±0.09 2.62±0.64 1.11±0.14 -灌胃给药(10 mg/kg) 13.3±5.8 0.083,0.5 24.2±7.6 28.9±9.2 -3.24±1.92 --0.61±0.19
3 讨论
芹黄春为常见的黄酮苷类物质,在植物中分布广泛。除了植物化学方面的研究工作之外,药理活性研究是重要研究内容。针对这部分研究报道,可以发现,在实验设计时对剂量或浓度的选择较少提及药代动力学方面的依据,原因可能是有关药代动力学的报道较少,或者低估了药代动力学信息在药效/毒性研究中的作用。因此,本文探讨了大鼠经不同给药途径后,芹黄春在大鼠血浆中的存在的物质形式以及口服生物利用度等基本的药代动力学信息。研究结果显示,芹黄春的口服生物利用度较低(0.61%),峰浓度也处于ng/mL级水平(13 ng/mL、10 mg/kg剂量给药)。造成生物利用度如此低的原因可能是:吸收差,代谢稳定性差或消除快。确切的机制有待于进一步研究。静脉给药后,芹黄春在大鼠血浆中短暂的处于较高浓度水平(约2.4 μg/mL、2 mg/kg剂量给药),但浓度迅速下降,t1/2仅为1.2 h,分布容积较大。浓度快速下降的原因可能与:(1)血浆向组织的快速分布;(2)代谢转化;(3)排泄等有关。这些机制也有待于阐明。以上药代动力学信息表明:芹黄春在大鼠体内生物利用度低、消除快而且多以代谢物的形式存在。因此,真正的药效物质形式还有待于进一步确定。进行药效研究时,关注发挥药效作用时的物质形式和浓度也非常有意义。
本文建立了全新的LC-MS/MS的分析方法用于分析大鼠血浆中的芹黄春的药物浓度,方法中涉及的样品处理过程简单易行,分析方法灵敏度高,分析时间短。该定量分析方法成功用于大鼠不同给药途径给予芹黄春后血浆中药物浓度的分析,得到了相关的药代动力学信息,如较低的生物利用度,快速的半衰期和代谢转化等。本文所建立的分析方法有利于芹黄春药代动力学研究的进行。
[1]王文蜀,王志骞,周亚伟.凤尾草化学成分研究[J].中药材,2008,31 (8):1165-1167.
[2]Pisarev D,Novikov OO,Novikova MY,et al.Flavonoid composition of Juniperus oblonga Bieb[J].Bull Exp Biol Med,2011,150(6): 714-717.
[3]Lu J,Feng X,Sun Q,et al.Effect of six flavonoid compounds fromIxeris sonchifolia on stimulus-induced superoxide generation and tyrosyl phosphorylation in human neutrophils[J].Clin Chim Acta,2002, 316(1-2):95-99.
[4]张晶,郑毅男.旱柳叶的化学成分及其药理活性的研究[J].中国中药杂志,2000,25(9):538-541.
[5]张晶,韩立坤.旱柳叶中抗血栓、抗动脉硬化活性成分的研究[J].中药材,1999,22(3):131-133.
[6]Zheng YN,Zhang J,Han LK,et al.Effects of compounds in leaves of Salix matsudana on arachidonic acid metabolism[J].Yakugaku Zasshi,2005,125(12):1005-1008.
[7]王文蜀,周亚伟,叶蕴华,等.半枝莲中黄酮类化学成分研究[J].中国中药杂志,2004,29(10):957-959.
[8]覃珊,温学森.HPLC同时测定菊花中6种活性成分含量[J].中国中药杂志,2011,36(11):1474-1477.
[9]刘金旗,沈其权,刘劲松,等.贡菊化学成分的研究[J].中国中药杂志,2001,26(8):547-548.
[10]胡碧波,吴祖帅,蔡君,等.杭白菊中主要黄酮苷的测定及影响因素考察[J].中国中药杂志,2006,31(21):1772-1775.
[11]赵东保,张卫,李明静,等.顶羽菊化学成分研究[J].中国中药杂志, 2006,31(22):1869-1872.
[12]王亚君,杨秀伟,郭巧生.黄菊花化学成分研究[J].中国中药杂志, 2008,33(5):526-530.
[13]Benedek B,Kopp B,Melzig MF.Achillea millefolium L.s.l.—is the anti-inflammatory activity mediated by protease inhibition?[J].J Ethnopharmacol,2007,113(2):312-317.
[14]Shindo K,Saito E,Sekiya M,et al.Antioxidative activity of the flower of Torenia fournieri[J].J Nat Med,2008,62(2):247-248.
[15]冯卫生,李红伟,郑晓珂,等.构树叶的化学成分[J].药学学报, 2008,43(2):173-180.
[16]吴霞,刘净,于志斌,等.薰衣草中黄酮类化学成分的研究[J].中国中药杂志,2007,32(9):821-823.
[17]Sharaf M.Chemical constituents from the seeds of Trifolium alexandrinum[J].Nat Prod Res,2008,22(18):1620-1623.
[18]谭兴起,郭良君,陈海生,等.络石藤中黄酮类化学成分研究[J].中药材,2010,33(1):58-60.
[19]Baris O,Karadayi M,Yanmis D,et al.Ιsolation of 3 flavonoids from Mentha longifolia(L.)Hudson subsp.longifolia and determination of their genotoxic potentials by using the E.coli WP2 test system[J].J Food Sci,2011,76(9):T212-217.
[20]Ozkan G,Ozcan MM.Some phenolic compounds of extracts obtained from Origanum species growing in Turkey[J].Environ Monit Assess,2014,186(8):4947-4957.
[21]Zaabat N,Hay AE,Michalet S,et al.Antioxidant and antigenotoxic properties of compounds isolated from Marrubium deserti de Noé[J]. Food Chem Toxicol,2011,49(12):3328-3335.
[22]Fuchs J,Milbradt R.Skin anti-inflammatory activity of apigenin-7-glucoside in rats[J].Arzneimittel-Forschung,1993,43(3): 370-372.
[23]Merfort Ι,Heilmann J,Hagedorn-Leweke U,et al.In vivo skin penetration studies of camomile flavones[J].Pharmazie,1994,49(7): 509-511.
[24]Patil CS,Singh VP,Satyanarayan PS,et al.Protective effect of flavonoids against aging-and lipopolysaccharide-induced cognitive impairment in mice[J].Pharmacology,2003,69(2):59-67.
[25]Zheng QS,Sun XL,Xu B,et al.Mechanisms of apigenin-7-glucoside as a hepatoprotective agent[J].Biomed Environ Sci,2005,18 (1):65-70.
[26]Srivastava JK,Gupta S.Antiproliferative and apoptotic effects of chamomile extract in various human cancer cells[J].J Agric Food Chem,2007,55(23):9470-9478.
[27]Tsolmon S,Nakazaki E,Han J,et al.Apigetrin induces erythroid differentiation of human leukemia cells K562:proteomics approach[J]. Mol Nutr Food Res,2011,55(Suppl 1):S93-S102.
[28]Nakazaki E,Tsolmon S,Han J,et al.Proteomic study of granulocytic differentiation induced by apigenin 7-glucoside in human promyelocytic leukemia HL-60 cells[J].Eur J Nutr,2013,52(1):25-35.
[29]Chen Z,Ying X,Meng S,et al.High-performance liquid chromatographic determination and pharmacokinetic study of apigenin-7-O-β-D-glucoside in rat plasma after intravenous administration [J].Arch Pharm Res,2011,34(5):741-746.
[30]Chen Z,Ying X,Meng S,et al.LC determination of luteolin-7-O-β-D-glucoside and apigenin-7-O-β-D-glucoside in rat plasma after administration of Humulus scandens extract and its application to pharmacokinetic studies[J].Nat Prod Res,2012,26(6): 530-539.
[31]Hanske L,Loh G,Sczesny S,et al.The bioavailability of apigenin-7-glucoside is influenced by human intestinal microbiota in rats [J].J Nutr,2009,139(6):1095-1102.
Determination of apigetrin in rat plasma by LC-MS/MS and its application in the pharmacokinetic study.
LI Hai-long1,2,YIN Hang2,WEN Qi2,TANG Yin-feng1,2,CHEN Feng1,2,ZHANG Xiao-po1,2,LAI Wei-yong1,2.1.Hainan Provincial Key Laboratory of R&D of Tropical Herbs,Haikou 571199,Hainan,CHINA;2.School of Pharmacy,Hainan Medical University,Haikou 571199,Hainan,CHINA
ObjectiveTo quantify apigetrin in rat plasma by LC-MS/MS,and investigate pharmacokinetic properties of apigetrin after oral or intravenous administration of apigetrin solution to rats.MethodsSix female Sprague Dawley rats were randomly divided into two groups,with three rats in each group,to receive a single intravenous dose(2 mg/kg)or an oral dose of apigetrin solution(10 mg/kg).Serial blood samples were collected from the orbital sinus under light ether anesthesia.Each plasma sample was precipitated with the ΙS-spiked methanol solution. The mixture was well followed by a vortex shake for 5 min and centrifuged at 13 000 r/min for 10 min.The resulting supernatant was directly applied for LC-MS/MS analysis.Pharmacokinetic parameters were determined with Kinetica 2000 software.ResultsGood linearity was found in the range of 1~2 000 ng/mL for apigetrin.The lower limit determination of apigetrin was 1 ng/mL.The relative extraction recoveries were higher than 90%at three concentrations (8 ng/mL,100 ng/mL,1 200 ng/mL).The RSD values for stability of intraday and interday precision were always less than 12.8%.Ιntraday and interday accuracy ranged from 91.5%to 107%.The accuracy,precision,stability,extraction recoveries and linearity were found to be within the acceptable criteria.This method was successfully applied to a pharmacokinetic study after oral or intravenous administration of apigetrin solution to rats.The Cmaxwas(2 363±96)ng/mL and (13.3±5.8)ng/mL respectively.The AUC0~∞was respectively(796±201)h·ng/mL and(28.9±9.2)h·ng/mL.The plasma t1/2after apigetrin through intravenous administration was(1.20±0.17)hour and its oral bioavailability was very low (0.6%).ConclusionThe LC-MS/MS method for measurement of apigetrin was developed and validated,which can be successfully applied in determination of apigetrin in rat plasma and pharmacokinetics study.
Rat;Apigetrin;LC-MS/MS;Pharmacokinetics
R-332
A
1003—6350(2016)13—2065—05
10.3969/j.issn.1003-6350.2016.13.001
2016-02-10)
海南省重大科技专项(编号:ZDZX2013008-3);海南医学院2014年度引进人才科研启动经费项目
赖伟勇。E-mail:13807660389@163.com
