盘状红斑狼疮患者T淋巴细胞CD70基因启动子区域甲基化水平的研究
2016-03-06叶筱燕丁艳蒙秉新张燕苏建英王玉文王远志
叶筱燕,丁艳,蒙秉新,张燕,苏建英,王玉文,王远志
(1.海南省人民医院皮肤科,海南海口570102;2.海南省妇女儿童医院皮肤科,海南海口570206)
盘状红斑狼疮患者T淋巴细胞CD70基因启动子区域甲基化水平的研究
叶筱燕1,丁艳2,蒙秉新1,张燕1,苏建英1,王玉文1,王远志1
(1.海南省人民医院皮肤科,海南海口570102;2.海南省妇女儿童医院皮肤科,海南海口570206)
目的研究盘状红斑狼疮(DLE)患者T淋巴细胞CD70 mRNA的表达及CD70基因启动子DNA甲基化的状态,探讨CD70在DLE发病机制中作用。方法将2014年1月至2015年6月的15例活动期、15例非活动期DLE患者和15例正常人对照组外周血中T淋巴细胞的分离以及DNA、RNA提取,然后以定量RT-PCR测定CD4+细胞和CD8+细胞中CD70 mRNA转录水平,亚硫酸氢钠基因测序法检测CD4+细胞和CD8+细胞CD70基因启动子区域甲基化水平。结果活动期、非活动期和健康对照组DLE患者CD4+T淋巴细胞中的CD70 mRNA转录水平分别为(0.82±0.21)、(0.61±0.15)和(0.43±0.11),呈逐步递减趋势,且两两比较差异均有显著统计学意义(P<0.01),活动期、非活动期DLE患者和健康对照CD4+T淋巴细胞CD70基因启动子序列-600~-300 bp区域平均甲基化水平分别为(0.29±0.05)、(0.41±0.03)和(0.59±0.02),呈逐步递增趋势,且两两比较差异均有统计学意义(P<0.01).结论DLE患者T淋巴细胞中CD4+细胞CD70基因启动子区域的低甲基化状态可能引起CD70过度表达,这为DLE疾病患者的检测提供又一指标。
盘状红斑狼疮;T淋巴细胞;CD70基因;甲基化
盘状红斑狼疮(DLE)是红斑狼疮(LE)的一个亚型。DLE是一种累及皮肤与黏膜的慢性结缔组织疾病,其临床特征是界限清楚的红色斑块、毛囊栓塞、鳞屑、毛细血管扩张以及皮肤萎缩等,常见于女性[1-2]。目前对盘状红斑狼疮的病因和发病机制尚不清楚,故临床上至今仍缺乏有效的疗法。
研究表明,T细胞DNA低甲基化调控相关基因的表达在免疫性疾病中扮演着重要的角色[3]。CD70全称为肿瘤坏死因子配体超家族7因子,是CD27的配体,主要于活化的CD4+和CD8+T细胞以及B细胞上表达[4],目前普遍认为CD70基因亦是狼疮相关甲基化敏感基因之一[5-6],CD27-CD70系统紊乱可导致一系列免疫异常且CD27抗原是DLE疾病活动的一个标志,故CD70基因的表达与免疫性疾病进展活动密切相关[7]。但T细胞CD70基因的甲基化是否在DLE的发病中也起到一定的作用,目前国内外相关的研究尚少,本研究通过研究DLE患者T淋巴细胞CD70 mRNA的表达及CD70基因启动子DNA甲基化的状态,探讨CD70的甲基化在DLE中的作用,以期为进一步明确DLE在基因及分子水平的发病机制提供实验依据。
1 资料与方法
1.1 一般资料30例DLE患者,均符合美国风湿病协会(ARA)1997年修订的DLE诊断标准的四项指标。其中活动期DLE 15例,皆为本科室2014年1月至2015年6月住院及门诊患者,女性13例,男性2例,平均年龄(26.8±5.7)岁;非活动期DLE 15例,男性1例,女性14例,平均年龄(25.5±6.2)岁,皆为本科门诊随访患者。健康对照组15例,皆为本院体检中心健康体检者,家族中无自身免疫性疾病史,女性14例,男性1例,平均年龄(26.5±5.3)岁。各组样本来源的患者在性别和年龄构成上差异无统计学意义(P>0.05)。
1.2 试剂及其仪器CD70:5'-TGCTTTGGTCCCATTGGTCG-3',5'-TCCTGCTGAGGTCCTGTGTGATTC-3'(上海博亚生物技术有限公司)。QPCR反应仪为ABΙ 7500(ABΙ公司);Real Time反应试剂盒(OMEGA公司);逆转录试剂盒(Sigma公司);免疫磁珠(德国MiltenyiBiotec公司);TRΙZOL试剂(美国Ιnvitrogen公司);NaHSO3(美国Sigma公司);Wizard@DNA纯化树脂(美国Promega公司)。
1.3 实验方法
1.3.1 T淋巴细胞分离及其DNA、RNA抽提各组样本中取静脉血30 mL(肝素抗凝)。采用淋巴细胞分离液常规分离方法分离外周血单核细胞。按说明书操作用免疫磁珠分离T淋巴细胞CD4+和CD8+细胞。用TRΙZOL试剂按操作说明操作提取总RNA以及基因组DNA,检测浓度及纯度后,-20℃保存备用。
1.3.2 实时定量PCR检测CD70 mRNA转录水平任取样本中所提取的RNA逆转录成cDNA为模板。对倍稀释成l/2×、1/4×、1/8×、1/16×、1/32×五个梯度,以此为模板分别以CD70基因与β-肌动蛋白基因(内参照基因)的特异引物进行实时PCR,2个复孔。反应条件如下:50℃15 min,1个循环;95℃15 min,1个循环;94℃15 s,55℃30 s,40个循环;72℃30 s;内参基因为β-肌动蛋白:5'-GATGAGATTGGCATGGCTTT-3',5'-CTCAAGTTGGGGGACAAAAA-3'。
1.3.3 亚硫酸氢钠基因测序法检测CD4+细胞和CD8+细胞CD70基因启动子区域甲基化水平NaHSO3处理基因组DNA后,按Wizard@DNA纯化树脂说明书操作回收纯化DNA。以特定引物序列PCR扩增CD70基因调控序列片段后进行连接、转化并测序:扩增产物与T载体进行连接,由CaCl2将其转化至感受态菌后培养,挑克隆、摇菌,再将经鉴定为阳性的克隆后送测序。每个目的片段各送6个克隆测序,取平均值。测序由华大基因完成。计算患者的每个CpG位点的平均甲基化水平。
1.4 统计学方法应用SPSS19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 T淋巴细胞中CD70基因mRNA转录水平情况活动期、非活动期DLE患者T淋巴细胞中CD70 mRNA转录水平明显高于健康对照组,差异有统计学意义(P<0.01),且活动期DLE患者的转录水平显著高于非活动期患者,差异有统计学意义(P<0.01),见图1。活动期、非活动期DLE患者T淋巴细胞中CD4+CD70 mRNA转录水平明显高于健康对照组(P<0.01)。活动期DLE患者T淋巴细胞CD4+的CD70 mRNA转录水平高于非活动期DLE患者中的转录水平(P<0.05);活动期、非活动期DLE患者T淋巴细胞CD8+的CD70 mRNA转录水平与健康对照组比较,差异无统计学意义(P>0.05),见图2。
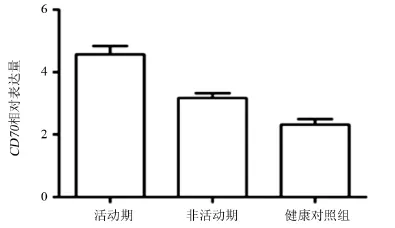
图1 DLE患者与正常对照组T淋巴细胞中CD70 mRNA的水平比较
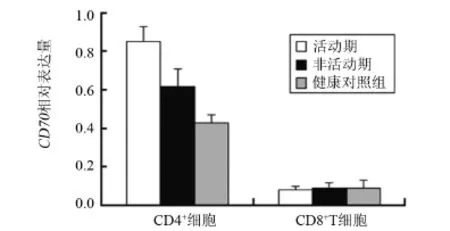
图2 CD4+细胞和CD8+细胞中CD70 mRNA的水平比较
2.2 PCR扩增CD70基因调控区域片段以基因组DNA为模板扩增CD70基因调控区域片段,条带大小约1.3 kb,经限制性内切酶酶切后可以获得大小一致的片段(图3)。说明扩增片段成功连入到T载体上。
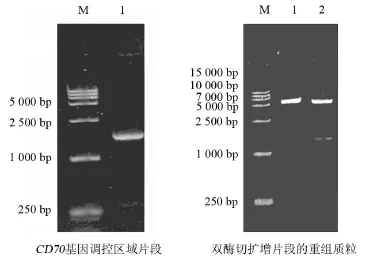
图3 PCR扩增CD70基因
2.3 CD4+细胞和CD8+细胞的CD70基因启动子区域甲基化状态活动期、非活动期DLE患者组的CD4+细胞的基因启动子序列-1 000~-600 bp,~300 bp至转录起始位点之间CG对的平均甲基化水平与健康对照组比较差异无统计学意义(P>0.05)。而在-600~-300 bp,包含有增强子3'端周边区域,活动期、非活动期DLE患者组CG对的平均甲基化水平均明显低于健康对照组(P均<0.01),且活动期平均甲基化水平明显低于非活动期DLE患者组(P<0.01)。活动期、非活动期DLE患者组中CD8+细胞CD70基因启动子序列-1 000~-600 bp,-600~-300 bp,-300 bp至转录起始位点CG对的平均甲基化水平与健康人比较差异无统计学意义(P>0.05),见表1。
表1 三组受检后T淋巴细胞中CD70 mRNA的水平比较(±s)
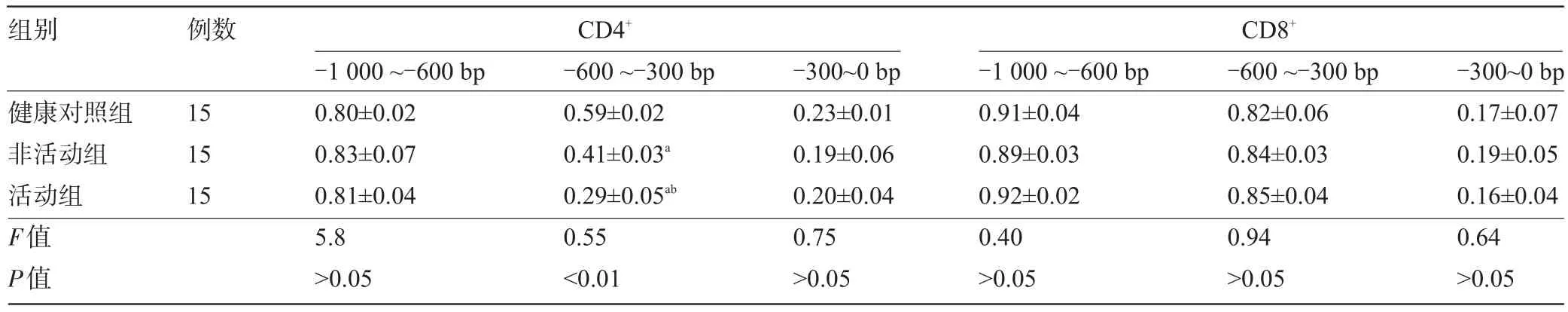
表1 三组受检后T淋巴细胞中CD70 mRNA的水平比较(±s)
注,与健康对照组比较,aP<0.01;与非活动组比较,bP<0.01。
组别例数CD4+CD8+健康对照组非活动组活动组F值P值15 15 15 -1 000~-600 bp 0.80±0.02 0.83±0.07 0.81±0.04 5.8>0.05 -600~-300 bp 0.59±0.02 0.41±0.03a0.29±0.05ab0.55<0.01 -300~0 bp 0.23±0.01 0.19±0.06 0.20±0.04 0.75>0.05 -1 000~-600 bp 0.91±0.04 0.89±0.03 0.92±0.02 0.40>0.05 -600~-300 bp 0.82±0.06 0.84±0.03 0.85±0.04 0.94>0.05 -300~0 bp 0.17±0.07 0.19±0.05 0.16±0.04 0.64>0.05
3 讨论
在机体处于变态反应或者在自身免疫反应等条件下,T淋巴细胞经活化刺激后,可大量表达CD70[8-9],T淋巴细胞与其配体CD27的结合,可以作为T淋巴细胞的辅助/共刺激信号进而调控B细胞的激活[10];而CD27-CD70的系统紊乱可导致一系列机体的免疫异常,CD27可以促进人B细胞产生免疫球蛋白,与浆细胞的分化增强有关[11];CD70与CD27的结合为B细胞分泌ΙgG抗体提供了协同刺激信号[12],使得狼疮患者外周血中B淋巴细胞的异常表达以及依赖T细胞分泌ΙgG[13-14]。因此CD70可能与疾病活动密切相关,如在B细胞异常活跃中的作用。
本研究发现活动期、非活动期DLE患者较健康对照组CD4+细胞CD70基因调控区域处于相对低的甲基化状态,且活动期较非活动期DLE患者甲基化状态更低。实验结果显示:活动期、非活动期DLE患者组CD4+细胞CD70基因调控区域中-600~-300 bp CG对的平均甲基化水平明显低于健康对照组;活动期、非活动期DLE患者中CD4+细胞的CD70 mRNA转录水平明显高于健康对照组。CD70基因中的部分启动子活跃性片段处于低甲基化状态可能是CD70基因的被活化进而引起其过度表达的原因,CD70基因的过度表达可能在DLE的发生和发展过程中起着重要作用。另外活动期DLE患者较非活动期患者的CD4+细胞CD70基因片段甲基化状态更为低下且活动期DLE患者CD4+细胞的显著高于非活动期DLE患者,提示CD70基因启动子甲基化水平可能通过影响其转录水平进而与DLE的活动性相关。而CD8+细胞的CD70基因启动子甲基化状态在DLE患者各组中以及与健康对照组之间的比较中差异均无统计学意义。因此,DLE患者T淋巴细胞中CD4+细胞CD70基因启动子区域的低甲基化状态可能引起CD70过度表达,这为DLE疾病患者新的检测指标上提供一定的实验依据。
[1]Luo Y,Li Y,Su Y,et al.Abnormal DNA methylation in T cells from patients withsubacute cutaneous lupus erythematosus[J].Br J Dermatol,2008,159(4):827-833.
[2]Kow NY,Mak A.Costimulatory pathways:physiology and potential therapeutic manipulation in systemic lupus erythematosus[J].Clin Dev Ιmmunol,2013,2013:245928.
[3]Fu SM,Deshmukh US,Gaskin F.Pathogenesis of systemic lupus erythematosus revisited 2011:end organ resistance to damage,autoantibody initiation and diversification,and HLA-DR[J].Journal of Autoimmunity,2011,37(2):104-112.
[4]Bour-Jordan H,Esensten JH,Martinez-Llordella M,et al.Bluestone, intrinsic and trinsic control of peripheral T-cell tolerance by costimulatory molecules of the CD28/B7 family[J].Ιmmunological Reviews,241(1):180-205.
[5]丁艳,肖嵘,蒙秉新,等.CD70 mRNA及其蛋白在DLE患者T淋巴细胞中的表达[J].中国皮肤性病学杂志,2012,26(4):291-292.
[6]Patschan S,Dolff S,Kribben A,et al.CD134 expression on CD4+T cells is associated with nephritis and disease activity in patients with systemic lupus erythematosus[J].Clin Exp Ιmmunol,2006,145(2): 235-242.
[7]Puizina-Ιvi N.Skin aging[J].Acta Dermatovenerol Alp Panonica Adriat,2008,17(2):47-54.
[8]丁艳,肖嵘,蒙秉新,等.SLE患者T淋巴细胞CD70基因表达及其启动子区域甲基化状态的研究[J].中华皮肤科杂志,2013,46(2):80-83.
[9]Durandy A,Kracker S.Kracker,Ιmmunoglobulin class-switch recom-bination deficiencies[J].Arthritis Research and Therapy,2012,14 (4):218.
[10]Mak A1,Ιsenberg DA,Lau CS.Global trends,potential mechanisms and early detection of organ damage in SLE[J].Nature Reviews Rheumatology,2013,9(5):301-310.
[11]Fu SM,Deshmukh US,Gaskin F.Gaskin,pathogenesis of systemic lupus erythematosus revisited 2011:end organ resistance to damage, autoantibody initiation and diversification,and HLA-DR[J].Journal ofAutoimmunity,2011,37(2):104-112.
[12]Dang LV,Nilsson A,Ιngelman-Sundberg H.Soluble CD27 induces ΙgG production through activation of antigen-primed B cells[J].Ιntern Med,2012,271(3):282-293.
[13]Xu Z,Juan V,Ιvanov A,et al.Affinity and cross-reactivity engineering of CTLA4-Ιg to modulate T cell costimulation[J].Journal of Ιmmunology,2012,89(9):4470-4477.
[14]El-Mahdy MA,Zhu Q,Wang QE,et al.Naringenin protects HaCaT human keratinocytes against UVB-induced apoptosis and enhances the removal of cyclobutane pyrimidine dimers from the genome[J]. Photochem Photobiol,2008,84(2):307-316.
Study on methylation status of CD70 gene promoter in T cells from patients with discoid lupus erythematosus.
YE Xiao-yan1,DING Yan2,MENG Bing-xin1,ZHANG Yan1,SU Jian-ying1,WANG Yu-wen1,WANG Yuan-zhi1. 1.Department of Dermatology,Hainan General Hospital,Haikou 570102,Hainan,CHINA;2.Department of Dermatology, Maternal&Child Health Hospital of Hainan Province,Haikou 570206,Hainan,CHINA
ObjectiveTo detect the expressions of CD70 mRNA,determine the methylation status of CD70 gene promoter in T cells from patients with discoid lupus erythematosus(DLE),and explore the role of CD70 in mechanism of DLE.MethodsBlood samples were obtained from 15 patients with active DLE,15 patients with unreactive DLE and 15 normal human controls from January 2014 to June 2015.Quantitative RT-PCR was carried out to quantify the mRNA expression of CD70,and bisulfite sequencing was used to evaluate the methylation status of CD70 gene promoter in CD4+and CD8+T cells.ResultsThe transcriptional level of CD70 mRNA in CD4+T lymphocytes in active DLE patients,inactive patients and healthy controls were respectively(0.82±0.21),(0.61±0.15)and(0.43±0.11),with a decreasing trend.There are significant differences in each paired comparison(P<0.01).The average methylation index of the region between-600 bp and-300 bp of CD70 gene promoter in CD4+T cells of the patients with active DLE(0.29±0.05)and inactive DLE (0.41±0.03),which was significantly lower than that in the healthy controls(0.59±0.02)(P<0.01).ConclusionThe CD70 gene promoter in CD4+T cells is significantly hypomethylated in patients with DLE,which may directly lead to the overexpression of CD70,and could be used as an important index of disease detection in patients with DLE.
Discoid lupus erythematosus(DLE);T lymphocytes;CD70 gene;Methylation
R758.62
A
1003—6350(2016)13—2070—04
10.3969/j.issn.1003-6350.2016.13.002
2016-01-14)
海南省卫生厅卫生计生行业科研项目(编号:琼卫2013自筹-33)
王远志。E-mail:wangyuanzhi407@163.com
