子宫内膜病变组织超氧化物歧化酶2的表达及临床意义
2016-03-01陈向红
周 鹏,陈向红,朱 鹏
(1.安徽医科大学公共卫生学院,安徽 合肥 230032;2.武警安徽省总队医院病理科,安徽 合肥 232041;
3.安徽医科大学基础医学院病理教研室,安徽 合肥 230032)
子宫内膜病变组织超氧化物歧化酶2的表达及临床意义
周鹏1,2,陈向红3,朱鹏1
(1.安徽医科大学公共卫生学院,安徽 合肥230032;2.武警安徽省总队医院病理科,安徽 合肥232041;
3.安徽医科大学基础医学院病理教研室,安徽 合肥230032)
摘要:目的研究女性子宫内膜正常和病变组织中的超氧化物歧化酶2(SOD2)的表达及其临床意义。方法收集125例女性子宫内膜组织蜡块,包括正常子宫内膜组织38例、子宫内膜简单型增生20例、子宫内膜复杂型增生20例和子宫内膜样腺癌47例,通过组织微阵列仪制备组织微阵列(TMA)蜡块并进行切片,使用免疫组织化学(两步法)检测TMA中各组子宫内膜组织的SOD2表达情况。结果TMA切片中正常子宫内膜、子宫内膜简单型增生、子宫内膜复杂型增生和子宫内膜样癌组织的SOD2的高表达率分别为68.4%、 55.0%、45.0%和38.3%,各组间表达差异具有统计学意义(P<0.05);子宫内膜样腺癌组织中SOD2的表达分别与肿瘤组织学分级和肿瘤子宫肌层浸润呈显著负相关(均P<0.05)。结论SOD2基因表达下调导致的氧化应激加剧可能在女性子宫内膜样腺癌发生发展过程中发挥了一定作用。
关键词:子宫内膜癌;超氧化物歧化酶2;免疫组织化学
子宫内膜癌是中老年女性生殖系统最常见的恶性肿瘤类型之一,而子宫内膜样腺癌占全部子宫内膜癌类型的80%~90%[1]。近年来,随着临床妇科诊疗技术有了一定的进展,针对早期子宫内膜癌患者的治疗效果和临床预后有了显著的提高,但中晚期患者的治疗效果、临床预后和生活质量依然不佳[2]。因此,研究子宫内膜样腺癌发生和发展的潜在分子机制,发掘参与其中的关键因子和通路并尽可能的进行相应干预,能够对提高子宫内膜样腺癌患者的早期诊断率、治疗效果和改善患者预后有着重要意义。近年研究表明,活性氧簇(reactive oxygen species, ROS)增多参与了多种人类常见恶性肿瘤的发生和发展[3],而超氧化物歧化酶2(superoxide dismutase, SOD2)基因编码的锰超氧化物歧化酶(MnSOD),是人体内最主要的超氧自由基清除剂,能够保护体内正常细胞免受ROS损伤的作用。最新研究显示,多种恶性肿瘤中SOD2表达较其相应的正常组织显著下调,提示SOD2介导ROS可能参与了恶性肿瘤的发生演变过程[4]。然而,SOD2在临床子宫内膜癌发生和发展中的角色和作用国内未见报道。本研究首先收集正常和不同癌前病变阶段的子宫内膜以及子宫内膜样腺癌组织,构建组织微阵列(Tissue microarray,TMA)蜡块并进行切片,通过免疫组织化学技术检测各组正常和病变子宫内膜组织中SOD2蛋白的表达,分析其在正常子宫内膜、不同癌前病变阶段和癌变患者中表达及其与患者临床病理特征的关系,探讨SOD2在子宫内膜癌发生发展中的可能的角色和临床意义。
1材料与方法
1.1病例资料收集武警安徽省总队医院和安徽医科大学第一附属医院病理科档案室石蜡包埋样本125例,包括正常子宫内膜蜡块38例、子宫内膜简单型增生蜡块20例、子宫内膜复杂型增生蜡块20例和子宫内膜样腺癌蜡块47例。所有病例均由病理医师复查苏木素-尹红(HE)切片,核对病理诊断。所有患者术前均未进行任何放疗和化疗。
1.2组织微阵列的制备首先收集每例样本的HE染色切片,通过光学显微镜观察选取合适蜡块和具有代表性改变的区域,并且使用专用组织定位器在HE切片上进行颜色标记;然后根据该位点标记在原组织蜡块上查找对应组织区域,确定组织取样空心针的具体穿孔点;最后使用组织微阵列制备仪制备TMA蜡块,其中每个组织点的直径为1 mm,每个组织点的间距为1 mm,每个TMA含有7×8=56个组织点。在行免疫组织化学染色前,将TMA蜡块以3 μm厚度连续切片,敷贴于免疫组织化学专用的防脱载玻片上。
1.3试剂与方法兔抗人SOD2多克隆抗体购自美国Abcam公司,羊抗兔两部法免疫组织化学试剂盒、DAB显色试剂盒、抗原修复液和PBS缓冲液等均购自福州迈新生物技术公司。具体免疫组织化学染色步骤参照试剂说明书要求进行。实验的阴性对照以PBS缓冲液代替一抗进行,按照说明书要求以人乳腺癌组织作为阳性对照。
1.4结果判定组织中SOD2染色以细胞质内出现黄色或棕黄色颗粒视为阳性,参照Fromowitz等[5]提出的以综合染色强度和阳性细胞比例的染色标准进行评估,具体判定标准为:0分为阴性(-),1~2分为弱阳性(1+),3~4分为中度阳性(2+),5~6分为强阳性(3+),其中2分以下视为SOD2低表达,3分以上视为SOD2高表达。
1.5统计学处理采用SPSS 10.0统计软件进行统计学处理。样本SOD2表达率的比较采用χ2检验,P<0.05为差异有统计学意义。
2结果
2.1SOD2在子宫内膜组织中表达和分布SOD2蛋白阳性信号呈黄色或棕黄色颗粒状,主要定位于细胞浆,分布于正常子宫内膜腺体和肿瘤细胞,子宫内膜间质细胞也可见少量表达(图1)。TMA切片中38例正常子宫内膜、20例简单型增生、20例复杂型增生和47例子宫内膜样癌组织的SOD2的高表达率分别为68.4%、 55.0%、45.0%和38.3%,各组间表达差异具有统计学意义(P<0.05)。
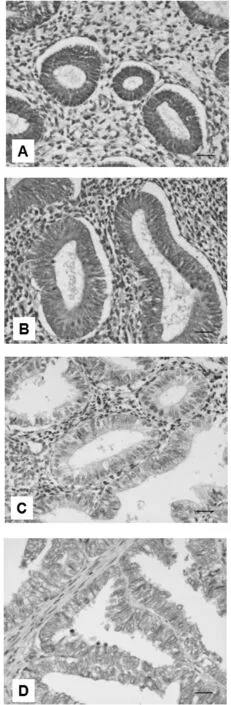
图1 SOD2在正常子宫内膜(A)、
2.2SOD2表达状况与子宫内膜癌临床病理特征的关系为了进一步探讨SOD2表达的临床意义,本研究继续分析了SOD2表达状况与子宫内膜样腺癌患者的临床病理特征的相关性,由表1所示:组织学FIGO分级为I级的子宫内膜样腺癌SOD2表达率为57.1%,显著高于Ⅱ级和Ⅲ级的子宫内膜样腺癌的表达率23.1%(P<0.05);另外,无肌层浸润的子宫内膜样腺癌SOD2的表达率显著高于有肌层浸润的子宫内膜样腺癌(83.3%和37.1%,P<0.05)。而子宫内膜样腺癌SOD2表达状况与患者年龄、肿瘤FIGO分期、肿瘤淋巴结转移、肿瘤宫颈浸润、肿瘤卵巢转移和雌孕激素表达状况均无统计学意义(均P>0.05)。
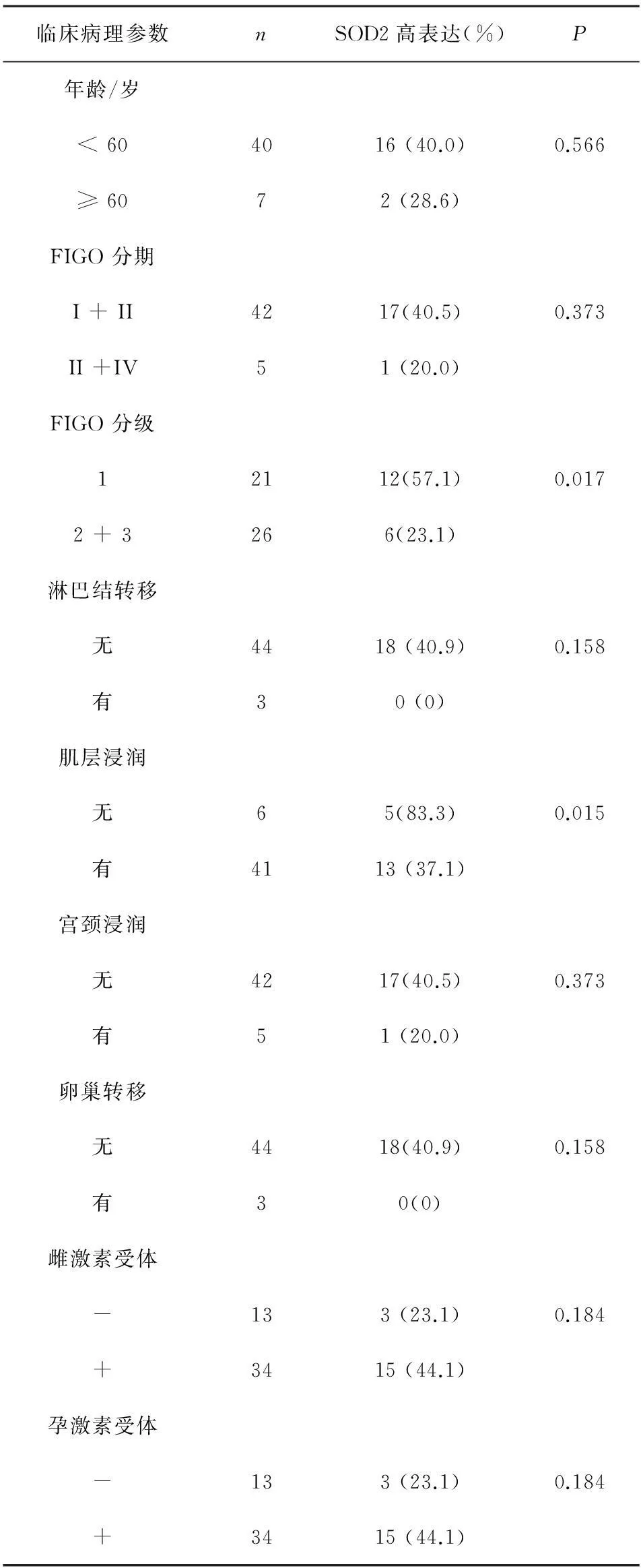
表1 子宫内膜样腺癌SOD2表达与
3讨论
在正常的生理状况下,机体内ROS的产生与清除处于一种相对动态平衡的稳定状态。当外源性的氧化刺激或内源性有害刺激作用于机体后,ROS量的这种稳定的状态就会被打破,进而导致机体内ROS产生速度超过其抗氧化还原系统所能够清除的范围,从而机体内出现ROS过量沉积的状态,引起体内出现氧化应激状态。另一方面,SOD是机体内以氧为唯一底物的天然酶类清除剂和自由基连锁反应的阻断剂, 在保护细胞免受ROS的氧毒性损伤中发挥着重要作用。真核生物中SOD主要包括CuZnSOD和MnSOD两种同工酶,其中SOD2 基因主要编码MnSOD。近年研究发现,SOD2介导的ROS调控不仅在维持生理机能调控中发挥作用,在病理过程中,包括肿瘤的发生发展过程中也发挥了一定作用[6-7]。例如,Huang等[8]研究发现肿瘤细胞SOD2表达显著下调,可以导致细胞内ROS沉积增多,而高浓度的ROS可以导致细胞DNA氧化损伤,从而引起细胞的增殖转化和恶性肿瘤的发生。
子宫内膜癌是女性妇科最常见的恶性肿瘤之一,其发病率呈逐渐上升趋势。在临床肿瘤病理类型分类中,子宫内膜癌通常分为Ⅰ型和Ⅱ型[9]。子宫内膜癌I型主要为子宫内膜样癌,是一种依赖雌激素类型的恶性肿瘤,该类型是最常见类型;而子宫内膜癌Ⅱ型相对罕见,为非雌激素依赖类型。研究显示:子宫内膜样腺癌的发病可能存在着从正常子宫内膜到简单型增生、复杂型增生、到不典型增生,最后演变成癌的一系列发展趋势。如果对该系列的子宫内膜病变进行连续性的动态观察和研究,将有助于了解女性子宫内膜癌的发病过程和发病机制,并且可以帮助从该过程中发掘关键调控因子作为有效的生物学标志物,为子宫内膜癌的预防、早期发现、早期诊断乃至靶向治疗提供有力的依据。为此,本研究收集了正常子宫内膜、子宫内膜简单型增生、复杂型增生的不同癌前病变阶段的子宫内膜和子宫内膜样腺癌组织,观察SOD2在该系列病变过程中的表达改变。
同时,为了保证研究结果的一致性和可比性,我们采用了TMA平台行免疫组织化学检测。TMA又称组织芯片,是将数十个乃至数百个不同来源的组织样本经过处理后,黏贴到同一张固相载体如玻璃载玻片或硅片上,形成高密度的切片[10]。TMA切片具有样本量大、节省实验时间、节约试剂和可比性高等优点,目前已成为临床和基础领域科学研究方法中的一大热点[11]。本研究样本量较大,为了减少不同批次和不同切片中免疫组织化学染色的人为操作的误差,我们构建了TMA,然后通过免疫组织化学技术检测了SOD2蛋白的表达,研究发现:SOD2在子宫内膜样腺癌组织中表达强度显著低于正常子宫内膜、子宫内膜简单型增生和复杂型增生,并且在正常子宫内膜组织和子宫内膜癌前病变的简单型增生和复杂性增生到癌变这个阶段的组织中,SOD2表达呈逐渐下调的趋势,提示SOD2的下调可能参与了子宫内膜癌的发病的一系列过程。进一步,本研究探讨了子宫内膜样腺癌中SOD2表达与患者临床病理特征的关系,结果显示肿瘤组织中SOD2表达状况与肿瘤组织学分级和肿瘤子宫肌层浸润均呈显著负相关,提示SOD2表达的下调可能也参与了子宫内膜癌的恶性演进,即其发挥了一种抑癌基因的角色。体外研究发现,外源性上调细胞内源性SOD2的表达能够通过氧化应激反应抑制人肺癌细胞株A549的增殖过程[12]。Liu等[13]采用免疫组织化学方法检测了100例人舌鳞状细胞癌的SOD2表达,发现其表达状况与肿瘤淋巴结转移呈显著负相关,提示SOD2下调是舌癌进展的一个重要因素。国内张济敏等[14]使用RT-PCR技术检测了18例宫颈癌组织、20例宫颈上皮内瘤变和20例正常宫颈组织中SOD2的mRNA表达,发现宫颈癌SOD2的mRNA表达较正常上皮组织和上皮内瘤变组织显著下调。类似的,王明臣等[15]同样使用RT-PCR技术检测了前列腺良恶性病变组织中SOD2 的mRNA表达,结果发现前列腺癌SOD2表达较良性前列腺增生显著下调,这些结果与本研究均一致,提示SOD2可能在多种人类肿瘤中发挥了抑癌基因的角色。
总之,本研究通过TMA结合免疫组织化学技术,发现SOD2基因表达下调导致的氧化应激加剧可能在子宫内膜癌的发生发展过程中发挥了一定作用,其具体调控分子机制有待进一步研究。
参考文献:
[1]方旖骅,周猷伟,颜士杰.绝经前后子宫内膜癌166例病例分析[J].安徽医药,2013,17(12):2058-2060.
[2]Reynaers EA,Ezendam NP,Pijnenborg JM.Comparable outcome between endometrioid and non-endometrioid tumors in patients with early-stage high-grade endometrial cancer[J]. J Surg Oncol,2015,111(6):790-794.
[3]Udensi UK,Tchounwou PB.Dual effect of oxidative stress on leukemia cancer induction and treatment[J]. J Exp Clin Cancer Res,2014,33(1):106.
[4]Heit C,Dong H,Chen Y,et al. Transgenic mouse models for alcohol metabolism, toxicity, and cancer[J]. Adv Exp Med Biol,2015,815:375-387.
[5]Fromowitz FB,Viola MV,Chao S,et al. Ras p21 expression in the progression of breast cancer[J]. Hum Pathol,1987,18(12):1268-1275.
[6]Termini L,Fregnani JH,Boccardo E,et al.SOD2 immunoexpression predicts lymph node metastasis in penile cancer[J].BMC Clin Pathol,2015,15:3.
[7]Liu Z,He Q,Ding X,et al.SOD2 is a C-myc target gene that promotes the migration and invasion of tongue squamous cell carcinoma involving cancer stem-like cells[J]. Int J Biochem Cell Biol,2015,60:139-146.
[8]Huang Y,Peng J,Oberley LW,et al.Transcriptional inhibition of manganese superoxide dismutase (SOD2) gene expression by DNA methylation of the 5' CpG island[J]. Free Radic Biol Med,1997,23(2):314-320.
[9]Kitchener H.Management of endometrial cancer[J].Eur J Surg Oncol,2006,32:838-843.
[10] 郑娟.组织芯片技术在临床病理研究中的运用 [J].健康必读,2013,9(9):575.
[11] Pandey V,Qian PX,Kang J,et al.Artemin stimulates oncogenicity and invasiveness of human endometrial carcinoma cells[J].Endocrinology, 2010,151(3):909-920.
[12] Li Y,Fu J,Yuan X,et al.Simvastatin inhibits the proliferation of A549 lung cancer cells through oxidative stress and up-regulation of SOD2[J].Pharmazie,2014,69(8):610-614.
[13] Liu X,Wang A,Lo Muzio L,et al.Deregulation of manganese superoxide dismutase (SOD2) expression and lymph node metastasis in tongue squamous cell carcinoma[J].BMC Cancer,2010,10:365.
[14] 张济敏,胡云霞,邹芳,等.宫颈癌组织中SOD2 基因的表达及意义[J].河南大学学报(医学版), 2010,29(3):188-190.
[15] 王明臣,郭茂锋,赵国强,等. 前列腺癌及良性前列腺增生组织中MnSOD基因的mRNA表达水平研究[J]. 中国老年学杂志,2006,26(2):164-165.
Expression and clinical significance of SOD2 in endometrial diseases
ZHOU Peng,CHEN Xiang-hong, ZHU Peng
(CollegeofPublicHealth,AnhuiMedicalUniversity,Hefei,Anhui230032,China)
Abstract:Objective To explore the expression and clinical significance of SOD2 in endometrial diseases.Methods The expression of SOD2 protein was examined in 38 normal endometrial tissues (NE), 20 simple endometrial hyperplasia (SEH), 12 complex endometrial hyperplasia (CEH) and 47 uterine endometrial carcinoma (EC) tissues by two-step immunohistochemical method.ResultsThe high expression rate of SOD2 protein was 38.3% in EC, which was significantly lower than that in NE, SHE and CEH tissue(P<0.05). The expression of SOD2 was reversely correlated with tumor grade and tumor myometrial invasion (bothP<0.05). Conclusions SOD2 might play an important role in tumorgenesis and progression of EC.
Key words:endometrial carinoma;SOD2;immunohistochemistry
收稿日期:(2015-07-09,修回日期:2015-10-09)
doi:10.3969/j.issn.1009-6469.2016.01.019
