抗坏血酸对减轻继发性脑损伤作用机制的研究
2016-03-01刘佰运
张 昊,茆 翔,刘佰运,2
(1.中国人民武装警察部队总医院神经创伤科,北京 100039;
2.首都医科大学附属北京天坛医院神经外科,北京 100050)
抗坏血酸对减轻继发性脑损伤作用机制的研究
张昊1,茆翔1,刘佰运1,2
(1.中国人民武装警察部队总医院神经创伤科,北京100039;
2.首都医科大学附属北京天坛医院神经外科,北京100050)
摘要:目的探讨抗坏血酸减轻颅脑创伤后继发性脑损伤加重的机制。方法将实验大鼠随机分为假手术+生理盐水组、假手术+抗坏血酸组、打击+生理盐水组及打击+抗坏血酸组,每组 12 只。建立中度颅脑损伤模型,颅脑创伤后24 h进行神经功能损伤评分;采用酶联免疫吸附剂测定脑组织超氧化物歧化酶(SOD)活性;采用Western blot法测定颅脑创伤后24 h的损伤侧脑组织中细胞色素P450(CYP2E1),基质金属蛋白酶-9(MMP-9)和血脑屏障紧密连结蛋白Occludin的表达情况。结果打击+抗坏血酸组的损伤程度与打击+生理盐水组相比明显减轻,SOD活力增高,CYP2E1表达减少,MMP-9的含量降低,Occludin的含量增高。结论抗坏血酸可以通过降低血脑屏障的破坏程度,减轻继发性颅脑损伤的进一步加重,其作用可能是依靠抑制CYP2E1的表达而发挥的。
关键词:颅脑创伤;抗坏血酸;CYP2E1;氧化应激
外伤性脑损伤后所发生的各种继发性脑损伤是导致继发性神经元障碍和死亡的主要原因。血脑屏障的破坏和开放是外伤性脑损伤后常见的继发性脑损伤[1]。这种继发性脑损伤危害严重,因此探讨如何减轻打击引起的继发性脑损伤并探讨其可能的机制就显得十分重要。
抗坏血酸是一种抗氧化剂,能防止自由基对人体的伤害。有研究表明[2],抗坏血酸可减轻外伤后早期的氧化应激,延缓打击后的病情进一步发展,因此补充抗坏血酸在临床上已成为减轻继发性脑损伤的重要方法。
细胞色素P450(cytochromeP450,CYPs)是一组结构和功能相关的超家族基因编码的同工酶,是温和条件下能够把底物中反应惰性的碳氢键氧化的单加氧酶,参与大多数内源性物质的代谢,外源性物质的解毒、前致癌物质的激活[3]。CYP2E1是其中的重要成员,它可以催化许多前致癌物质和前毒物转化为致癌物和有毒物,危害机体,而有些药物可以抑制它的表达与活性。
本实验的目的在于使用抗坏血酸对颅脑创伤后的大鼠进行干预,探究CYP2E1在其中发挥的作用,研究抗坏血酸对颅脑创伤保护作用的可能机制。
1材料与方法
1.1动物及分组成年健康雄性SD大鼠, 体质量(270±15)g,由北京维通利华实验动物技术有限公司提供。实验动物随机分为四组:假手术+生理盐水组、假手术+抗坏血酸组、打击+生理盐水组及打击+抗坏血酸组,每组12只。
1.2试剂及药品抗坏血酸;10%水合氯醛;BCA 蛋白浓度测定试剂盒(碧云天生物公司);超氧化物歧化酶(SOD)ELISA检测试剂盒(南京建成),基质金属蛋白酶9抗体(MMP-9,ab38899;Abcam公司);紧密连接蛋白Occludin抗体(ab31721,Abcam公司); 细胞色素P450抗体(CYP2E1,ab28146,Abcam公司)。
1.3动物模型的建立假手术+生理盐水组、假手术+抗坏血酸组、打击+生理盐水组及打击+抗坏血酸组大鼠按 400 mg·kg-1采用 10% 水合氯醛麻醉,取头皮正中切口,分离骨膜,暴露颅骨。在右侧前囟和人字缝尖中间,开直径为 5 mm 的骨窗,注意保持硬膜完整。将大鼠固定于立体定位仪上。将撞击锤(直径 4 mm) 安置于颅窗内,紧贴硬膜。采用PinPointTM颅脑损伤撞击器,建立中度损伤的可控性皮质打击模型,打击条件: 撞击速度2 m·s-1,撞击深度2.5 mm,接触时间85 ms。术后缝合创口。假手术组大鼠除不进行撞击外,其余手术操作同损伤组。术中用恒温手术台维持实验大鼠肛温(37±0.5)℃。
1.4给药生理盐水和抗坏血酸均采用腹腔注射的给药途径。生理盐水注射剂量为5 mL·kg-1,抗坏血酸注射剂量为200 mg·kg-1,注射时间均为伤后即刻开始。
1.5神经功能缺损评分在损伤后24 h对各组大鼠进行神经功能缺损评分[4],采用18分的神经功能量表从感觉试验,平衡试验,反射试验等方面评价实验大鼠的神经功能缺损程度。分数越高,神经功能缺损程度越重,采用双盲法对各组进行评分。
1.6SOD活力的测定大鼠断头取脑组织(去除小脑、脑干) ,称量,按1∶10的比例加入生理盐水,匀浆4 000 r·min-1离心10 min取上清液保存用于ELISA实验。SOD活性测定采用黄嘌呤氧化酶法,具体操作按试剂盒说明书进行。
1.7Western Blot 检测裂解的蛋白置于100℃水浴10 min后,上样于10%SDS-聚丙烯酰胺凝胶中进行电泳,后将蛋白转印于硝酸纤维素膜上,将该膜浸于50 g·L-1的1×TBST中室温轻摇60 min用于封闭非特异性结合位点,1×TBST洗3次,每次5 min。加入兔抗大鼠MMP-9和Occludin抗体,4℃孵育过夜,后移去一抗,1×TBST洗3次,每次5 min。加入二抗(辣根过氧化物酶标记的抗羊和抗兔IgG,1∶5 000),室温孵育1 h,ECL 光化学法显色并拍片。
1.8统计学处理对于连续变量采用均值±标准差;对于分级变量采用百分比;对于连续变量,运用Kolmorogov-Smirnov 检验方法对数据进行正态性检验,而后进行方差齐性的分析。对于两组正态连续变量,使用t检验进行比较。采用 ANOVA 方差分析及posthoc检验或秩和检验对多组计量资料进行比较。P<0.05为差异有显著性。
2结果
2.1神经功能损伤评分24 h后进行神经功能损伤评分,假手术+生理盐水组的评分为(1.0±0.2)分,假手术+抗坏血酸组的评分为(0.9±0.3)分,打击+生理盐水组的评分为(10.2±1.8)分,打击+抗坏血酸组的评分为(7.9±2.1)分。打击+生理盐水组的神经功能损伤评分明显高于假手术组+生理盐水组,假手术组+抗坏血酸组和打击+抗坏血酸组(P<0.05)。打击+抗坏血酸组的评分则低于打击+生理盐水组(P<0.05)。见图1。
2.2SOD的活力假手术+生理盐水组SOD活力为(91.00±0.93)U·mgprot-1,假手术+抗坏血酸组为(86.50±1.12)U·mgprot-1,打击+生理盐水组SOD活力为(72.88±1.70)U·mgprot-1,打击+抗坏血酸组为(80.38±1.05)U·mgprot-1。打击+生理盐水组和打击+抗坏血酸组的SOD活力明显低于假手术+生理盐水组和假手术+抗坏血酸组(P<0.05),但打击+抗坏血酸组的SOD活力高于打击+生理盐水组(P<0.05),见图2。

图1 神经功能损伤评分
注:1.假手术+生理盐水组;2.假手术+抗坏血酸组;3.打击+生理盐水组;4.打击+抗坏血酸组;*:与1、2、4组比较;#:与3组比较。

图2 SOD的活力
注:1.假手术+生理盐水组;2.假手术+抗坏血酸组;3.打击+生理盐水组;4.打击+抗坏血酸组;*:与1、2组比较;#:与3组比较。
2.3CYP2E1的含量与假手术+生理盐水和假手术+抗坏血酸组相比,打击+生理盐水组和打击+抗坏血酸组CYP2E1表达明显增加(P<0.05);而与打击+生理盐水组比,打击+抗坏血酸组CYP2E1表达减少(P<0.05),见图3。

图3 CYP2E1的含量
注:1.假手术+生理盐水组;2.假手术+抗坏血酸组;3.打击+生理盐水组;4.打击+抗坏血酸组 ;*:与1、2组比较;#:与3组比较。
2.4MMP-9的含量 与假手术+生理盐水和假手术+抗坏血酸组相比,打击+生理盐水组和打击+抗坏血酸组MMP-9表达明显增加(P<0.05);而相对于打击+生理盐水组比,打击+抗坏血酸组MMP-9表达减少(P<0.05),见图4。
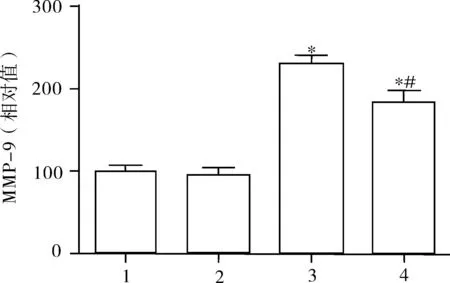
图4 MMP-9的含量
注:1.假手术+生理盐水组;2.假手术+抗坏血酸组;3.打击+生理盐水组;4.打击+抗坏血酸组;*:与1、2组比较;#:与3组比较。
2.5Occludin蛋白的含量与假手术+生理盐水和假手术+抗坏血酸组相比,打击+生理盐水组和打击+抗坏血酸组Occludin蛋白表达明显减少(P<0.05);而相对于打击+生理盐水组比,打击+抗坏血酸组Occludin蛋白表达增多(P<0.05),见图5。
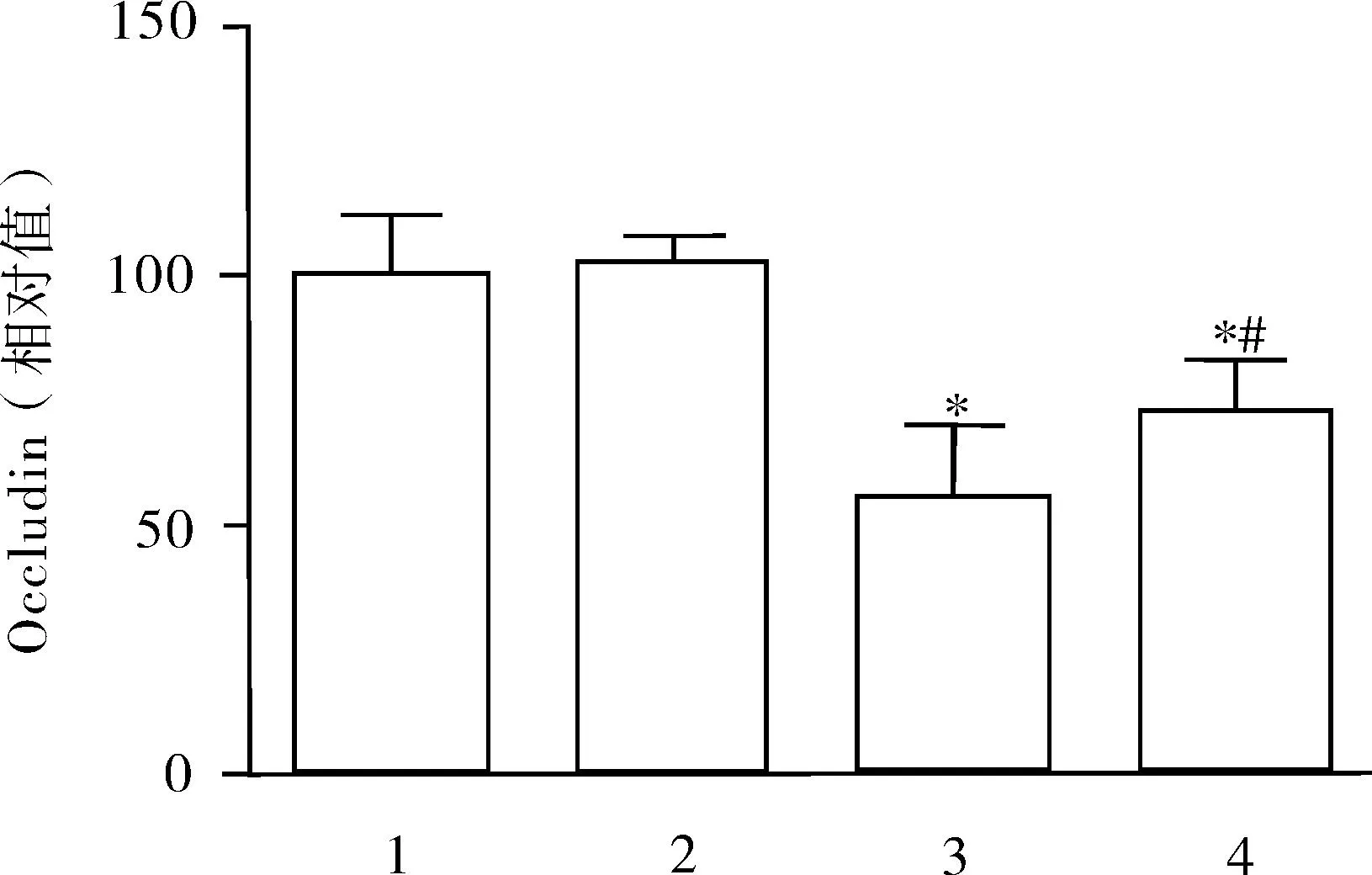
注:1.假手术+生理盐水组;2.假手术+抗坏血酸组;3.打击+生理盐水组;4.打击+抗坏血酸组;*:与1,2组比较;#:与3组比较。
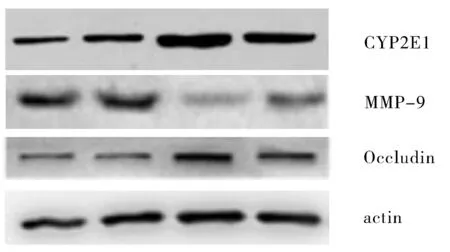
图5 Occludin蛋白的含量
注:1.假手术+生理盐水组;2.假手术+抗坏血酸组;3.打击+生理盐水组;4.打击+抗坏血酸组。
3讨论
颅脑创伤致残、致死率高,给家庭,社会及医疗保健体系带来很重的负担。因此近期的研究主要集中于研究颅脑创伤后的继发性脑损伤,尤其是缺血缺氧性损伤[5]。本实验的研究结果表明,打击+生理盐水组的神经功能损伤评分,CYP2E1表达量,基质金属蛋白酶-9的含量明显高于假手术+生理盐水组和假手术+抗坏血酸组;SOD活力,血脑屏障紧密连接蛋白含量则明显降低。而打击+抗坏血酸组在给予抗坏血酸治疗后,神经功能损伤评分,CYP2E1表达量,基质金属蛋白酶-9的含量均明显降低;SOD活力,血脑屏障紧密连接蛋白含量则升高。说明抗坏血酸能够抑制血脑屏障的破坏程度,减缓了神经元的死亡,减轻了颅脑创伤后继发性脑损伤的进一步发展。
自由基是一类包含未配对电子的化学物质,包括超氧阴离子,羟自由基等,在机体正常状态下,其产生和消耗处于动态平衡之中[6]。外伤性脑损伤后,在前列腺素等的作用下,自由基含量迅速增加,对细胞结构和功能产生破坏。而超氧化物歧化酶(SOD)是脑内重要的清除自由基物质,其活力与自由基的清除呈正比[7]。从本实验可以看出,打击后脑组织中SOD活力迅速降低,反映了自由基增加迅速,加重了继发性脑损伤。而抗坏血酸可以增加SOD的活力,减少自由基的产生,对颅脑创伤起到了较好的保护作用。
MMP-9在脑组织中由神经元或神经胶质细胞产生,它是一种能够分解紧密连接和细胞基底层等细胞外基膜的蛋白酶体[8],其过度表达的结果是破坏了血脑屏障的完整性,研究表明[9],MMP-9的表达与外伤后脑水肿的程度呈正比。本实验结果进一步说明了抗坏血酸可以抑制MMP-9的表达,减少血脑屏障紧密连接的分解及完整性的破坏,减轻脑水肿。
Occludin蛋白是一种存在于脑内皮细胞的紧密连接跨膜蛋白,它的作用是维持紧密连接复合体结构的稳定和功能的正常发挥,而这种紧密连接复合体也是血脑屏障的核心结构。研究表明[10],Occludin蛋白的高表达可以降低血脑屏障的通透性,维持其物理屏障功能[11]。本实验结果显示与对照组相比,说明了抗坏血酸可以增加Occludin蛋白的表达,减少紧密连接结构和功能的变化,降低血脑屏障通透性,减轻脑水肿。
CYP2E1是细胞色素氧化酶P450的重要成员,催化前致癌物质和前毒物转化为致癌物和有毒物。经国内外研究发现[12],CYP2E1对还原型烟酰胺腺嘌呤二核苷磷酸具有较高的氧化活性,可不依赖配体产生自由基,导致细胞膜结构破坏。在创伤性脑外伤的发展中,CYP2E1的存在导致产生更多的氧自由基,进一步加重了继发性脑损伤。
抗坏血酸是一种抗氧化剂,可以保护其它抗氧化剂,防止自由基对人体的伤害。本试验结果表明,打击后大鼠的CYP2E1表达明显增加,而在给予抗坏血酸药物后,大鼠的CYP2E1表达减少。基于以上结果,可以猜测抗坏血酸中可能含有CYP2E1抑制物,使用抗坏血酸后,CYP2E1的表达减少,氧自由基的产生减少,减少了细胞膜结构的破坏,保护血脑屏障,减轻脑水肿,防止神经元膜结构的破坏,减轻颅脑创伤后的继发性脑损伤。其对外伤性脑损伤保护作用的关键靶点可能是CYP2E1。
4结论
本试验结果说明,抗坏血酸对减轻继发性颅脑损伤加重的作用机制可能为对CYP2E1产生了抑制作用,导致氧自由基的产生减少,对细胞膜结构的破环降低,减轻了血脑屏障的破坏开放,为抗坏血酸进一步应用于临床治疗提供了重要的实验依据,为颅脑损伤的临床治疗提供了新思路,但其中具体的机制还有待于进一步研究。
参考文献:
[1]邵大荣,许连宝.巴曲酶和依达拉奉联用对缺血再灌注脑损伤沙土鼠脑保护作用[J].安徽医药,2007,11(11):975-977.
[2]Kan EM,Ling EA,Lu J.Microenvironment changes in mild traumatic brain injury[J].Brain Res Bull,2012,87(4/5):359-372.
[3]Simonian NA,Coyle JT.Oxidative stress in neurodegenerative diseases[J].Ann Rev Pharmacol Toxicol,1996(1):36-83.
[4]McConeghy KW,Hatton J,Hughes L,et al.A review of neuroprotection pharmacology and therapies in patients with acute traumatic brain injury[J].CNS Drugs,2012,26(7):613-636.
[5]张小年,张皓.创伤性颅脑损伤国内研究进展[J].中国康复理论与实践,2008,14(2):101-103.
[6]Hall ED,Vaishnav RA,Mustafa AG.Antioxidant therapies for traumatic brain injury[J].Neurotherapeutics,2010,7(1):51-61.
[7]Etsuo N.Action of ascorbic acid as a scavenger of active and stable oxygen radicals[J].American Journal of Clinical Nutrition,1991,(6z):1119-1124.
[8]Hawkins BT,Davis TP.The blood-brain barrier neurovascular unit in health and disease[J].Pharmacol Rev,2005,57:173-185.
[9]Tsenter J,Beni-Adani L,Assaf Y,et al.Dynamic changes in the recovery after traumatic brain injury in mice: effect of injury severity on T2-weighted MRI abnormalities, and motor and cognitive functions[J].J Neurotrauma,2008,25(4):324-333.
[10] Hawkins BT,Davis TP.The blood-brain barrier/neurovascular unit in health and disease[J].Pharmacol Rev,2005,57(2):173-185.
[11] Yamamoto M,Ramirez SH,Sato S,et al.Phosphorylation of claudin-5 and occluding by rho kinase in brain endothelial cell[J].Am J Pathol,2008,172(2):521-533.
[12] Dwight R,Pierce,Cody C,et al.Are oxidative mechanisms primary in ethanol induced Purkinje neuron death of the neonatal rat[J].Neuroscinece,2006,40(7):130-134.
Mechanisms of ascorbic acid reducing secondary brain injury in rats
ZHANG Hao1, MAO Xiang1, LIU Bai-yun1,2
(1.GeneralHospitalofArmedPoliceForces,Beijing100039,China;
2.DepartmentofNeurosurgery,CapitalMedicalUniversity,Beijing100050,China)
Abstract:Objective To investigate the effect of ascorbic acid on reducing secondary brain injury caused by traumatic brain injury and its possible mechanism.MethodsRats were randomly assigned into sham + saline group, sham + ascorbic acid group, hit + saline group and hit + ascorbic acid group, 12 in each group. Moderate traumatic brain injury model was established,and 24 hours later TBI neurological injury score was graded. The activity of superoxide dismutase in brain tissue was measured by ELISA. Western blot was used to determine the expressions of P450(CYP2E1), MMP-9 and Occludin in the tissue of the damaged brain 24 hours after the traumatic brain injury.ResultsCompared with the hit + saline group, in the blow + ascorbic acid group the trauma was significantly alleviated, the activity of SOD increased, the expression of CYP2E1 decreased, MMP-9 reduced and Occludin increased. ConclusionsAscorbic acid can alleviate the secondary brain injury by reducing the destruction of blood brain barrier, the mechanism of which is to inhibit the expression of CYP2E1.
Key words:traumatic brain injury;ascorbic acid;CYP2E1;oxidative stress
收稿日期:(2015-08-22,修回日期:2015-11-27)
通信作者:刘佰运,男,教授,博士生导师,研究方向:神经创伤,E-mail:liubaiyun1212@163.com
基金项目:国家自然科学基金(No 81471238)
doi:10.3969/j.issn.1009-6469.2016.01.007
