诱导神经干细胞与诱导多能干细胞在同源宿主脑内的致瘤性及免疫原性研究
2016-02-25高谋徐如祥许民辉姚慧董勤张洪钿杨志军杨阳朱建伟
高谋 徐如祥 许民辉 姚慧 董勤 张洪钿 杨志军 杨阳 朱建伟
·基础研究·
诱导神经干细胞与诱导多能干细胞在同源宿主脑内的致瘤性及免疫原性研究
高谋 徐如祥 许民辉 姚慧 董勤 张洪钿 杨志军 杨阳 朱建伟
目的对比研究诱导神经干细胞(iNSCs)与诱导多能干细胞(iPSCs)在同源宿主脑内的致瘤性及免疫原性。方法采用脑立体定向仪将 1×106个 C57BL/6(B6)小鼠胚胎干细胞(ESCs)、iPSCs、神经干细胞(NSCs)及iNSCs分别移植到健康成年B6小鼠大脑运动皮层。于移植后14 d、28 d处死动物,取材进行形态学研究。结果IPSCs和ESCs均可在小鼠脑内形成肿瘤导致组织坏死和免疫细胞浸润。然而,在iNSCs和NSCs移植组内,本研究未观察到肿瘤形成、脑损伤及免疫排斥反应。结论INSCs移植物不具有致瘤性和免疫原性,因而较iPSCs移植物更安全。
致瘤性;免疫原性;诱导神经干细胞;诱导多能干细胞;移植
一直以来,干细胞疗法的安全性评估是实验室和临床研究的首要课题[1]。而安全性评估是一项系统工程,涉及面广,其中干细胞的致瘤性和免疫原性是两个非常重要的衡量指标[2,3]。胚胎干细胞(embryonic stem cells,ESCs)和诱导多能干细胞(induced pluripotent stem cells,iPSCs)都具有无限增殖和多向分化的潜能,可形成肿瘤,限制其直接应用于临床[4]。此外,iPSCs由自体体细胞经体外重编程操作而获得,可能在回输到自体体内后引起免疫排斥反应,类似于同种异体ESCs移植[5]。例如,有报道称iPSCs不能在同源小鼠体内形成畸胎瘤,因为iPSCs的免疫原性引起了大量免疫细胞浸润[6]。可见,干细胞的致瘤性与免疫原性密切相关。然而,目前就体外重编程操作是否改变了iPSCs的免疫原性以及iPSCs能否在同源宿主体内形成肿瘤仍有较多争议[7-9]。与ESCs和iPSCs相比,神经干细胞(neural stem cells,NSCs)的增殖与分化能力均有限,体内成瘤率较低,而且NSCs低表达主要组织相容性复合物等分子抗原,因而其移植安全性高于ESCs和iPSCs[2,10]。诱导神经干细胞(induced neural stem cells,iNSCs),直接由自体体细胞经体外重编程操作而产生,不经过iPSCs中间状态,其增殖与分化特性类似于NSCs,并避免了NSCs因伦理学及细胞来源等限制。本研究前期通过在 小 鼠 胚 胎 成 纤 维 细 胞(mouse embryonic fibroblasts,MEFs)中过表达 Oct4、Sox2、Klf4和 c-Myc等转录因子成功获得iNSCs[11]。理论上,iNSCs类似于NSCs,体内成瘤率低于ESCs和iPSCs[2,11]。然而,体外重编程操作可能引起工程干细胞在遗传学或表观遗传学上的不稳定[12]。目前尚无研究报道体外重编程操作是否改变了iNSCs的致瘤性和免疫原性。在本研究中,为评估干细胞疗法应用于中枢神经系统的安全性,对比研究了C57BL/6(B6)小鼠ESCs、iPSCs、NSCs和iNSCs在同源宿主脑内的致瘤性及免疫原性,现报道如下。
材料与方法
一、B6小鼠ESCs和iPSCs培养
C57BL/6(B6)小鼠ESCs和iPSCs均采用丝裂霉素处理后的B6小鼠MEFs作为饲养层细胞进行培养,加入含15%胎牛血清 (fetal bovine serum,FBS),0.1 mmol/L非必须氨基酸(non-essential amino acids,NEAA),1% Nucleoside,2 mmol/L L-glutamine,10 ng/ml白血病抑制因子(leukemia inhibitory factor,LIF)和0.1 mmol/L β-Mercaptoethanol的杜尔伯科改良伊格尔培养基 (Dulbecco′s modified eagle medium,DMEM)培养基[11]。
二、B6小鼠NSCs培养
B6小鼠NSCs取自13.5 d胎鼠脑组织,采用含2%B27,20 ng/ml碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和20 ng/ml表皮生长因子(epidermal growth factor,EGF)的DMEM/F12与Neurobasal等体积混合培养基进行培养。
三、B6小鼠iNSCs培养
B6小鼠iNSCs直接由自体体细胞经体外重编程操作而产生,采用含2%B27,20 ng/ml bFGF,20 ng/ml EGF,0.05%牛血清白蛋白(albumin from bovine serum,BSA)和2 mmol/L L-glutamine的DMEM/F12与Neurobasal等体积混合培养基进行培养[11]。
四、B6小鼠ESCs、iPSCs、NSCs和iNSCs动物移植实验
采用随机数字表法将健康成年B6小鼠,体质量20~28 g,随机分为ESCs、iPSCs、NSCs和iNSCs移植组。分别制备ESCs、iPSCs、NSCs和iNSCs单细胞悬液并用PBS漂洗3遍,调整细胞密度后放置于离心管中冰浴。用硫喷妥40 mg/kg腹腔注射麻醉小鼠。麻醉成功后将小鼠固定于脑立体定向仪上,剪除鼠毛暴露头部皮肤,碘伏消毒后,铺无菌洞巾,切开皮肤暴露前囟。以lambda缝向喙侧5.5 mm,中线偏右侧1.0 mm,硬膜下2.0 mm为注射点,用25 μl 22 s微量进样器以0.5 μl/min的速度注射5 μl细胞悬液,细胞总量为1×106个,结束后留针5 min,缓慢拔针缝合头皮。
五、脑组织冰冻切片、病理染色和免疫荧光染色
细胞移植后14 d和28 d采用随机数字表法各选取6只动物进行处死,灌注固定后取出大脑,先观察大体形态,再作大脑冠状面连续冰冻切片,切片厚度为10 μm。采用HE染色观察脑组织病理形态学特征。根据病理染色结果进行免疫荧光染色,用10%BSA封闭后,加入CD3、CD11b和CD19抗体4℃孵育过夜。漂洗后,加入荧光标记二抗,室温避光孵育2 h。用4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染细胞核,在荧光显微镜下观察,在20×镜下随机选取6个视野,计数阳性细胞数(特异性抗体标记)和总细胞数(DAPI标记),计算阳性细胞百分率(%)=阳性细胞数/总细胞数×100%。
六、统计学分析
采用SPSS17.0软件进行统计学处理分析。生存时间以中位生存时间表示,生存率的非参数估计法采用Kaplan-Meier法,生存曲线组间比较采用Logrank检验。小鼠脑组织内浸润的免疫细胞数量以均数±标准差(±s)表示,资料先进行正态性检验和方差齐性检验,多组间比较采用单因素方差分析,各组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结果
一、干细胞移植后颅内肿瘤形成
在28 d的观察期内,未发现NSCs和iNSCs移植组内动物死亡。然而,ESCs和iPSCs移植组内动物的生存率明显降低,差异有统计学意义(P<0.05)。例如,在ESCs移植后的14 d和28 d分别有超过50%和90%的小鼠死亡。而在iPSCs移植后的14 d和28 d分别有超过40%和85%的小鼠死亡。ESCs和iPSCs移植组的动物生存率无明显差异,两组的中位生存期分别为13 d和14 d。此外,在连续24周的观察期内,发现NSCs和iNSCs移植组的动物生存率无明显差异。
大体形态上,NSCs和iNSCs移植后的14 d和28 d小鼠脑组织标本未见明显的变化。然而,ESCs和iPSCs移植组内大部分动物的脑组织标本可见不同程度的形态学改变:肿瘤形成和组织破坏。根据光镜下病理染色结果,ESCs和iPSCs移植后脑组织形态学特征可分为:(1)恶性畸胎瘤形成,以内、中和外各胚层的低分化、未成熟组织的出现为特征,并伴有严重的脑损伤和大量免疫细胞浸润(图1);(2)良性畸胎瘤形成,以成熟分化的三胚层组织的出现为特征,可伴有脑损伤和免疫细胞浸润(图2);(3)交界性肿瘤形成,介于良恶性畸胎瘤之间;(4)未检出肿瘤形成、脑损伤和免疫排斥反应。与之相对,包括整个大脑组织在内的连续病理切片未检出NSCs和iNSCs移植后肿瘤形成。

图1 胚胎干细胞移植后14 d病理学检查(HE染色,×100)
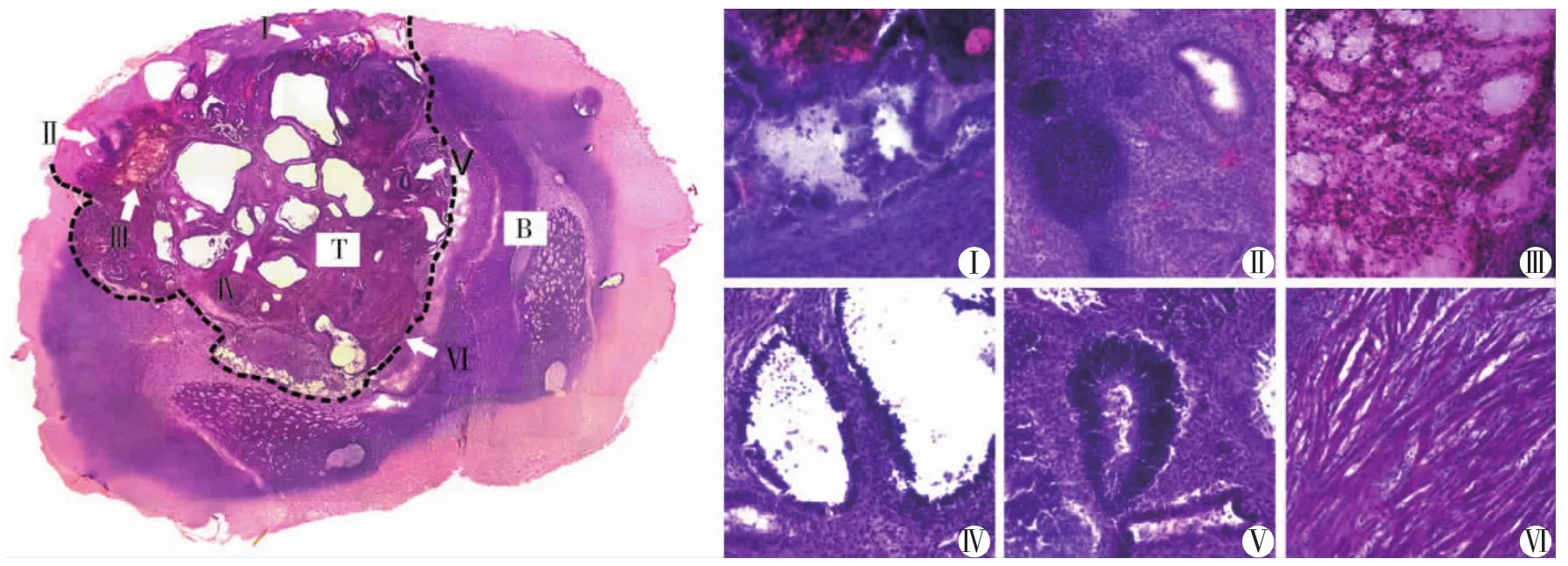
图2 诱导多能干细胞移植后14 d病理学检查(HE染色,×100)
根据脑肿瘤的特征、组织损伤和免疫细胞浸润程度,本研究统计分析了ESCs和iPSCs移植物在移植后14 d和28 d小鼠颅内形成肿瘤的比率,具体内容见表1。结果发现ESCs和iPSCs移植物形成肿瘤的比率明显高于二者未形成肿瘤的比率,差异有统计学意义(P<0.05),并且2级肿瘤的比率在ESCs和iPSCs移植组内均为最高。此外,发现肿瘤的重量和组织损伤面积在3级肿瘤组内是显著高于2级和1级肿瘤组的,差异有统计学意义(P<0.05)。而在同等级别肿瘤组内,肿瘤检出的比率、肿瘤的重量以及组织损伤面积在ESCs和iPSCs移植组间差异无统计学意义。
二、干细胞移植后颅内免疫细胞浸润
为了明确干细胞移植后浸润到颅内免疫细胞的类型,本研究采用小胶质细胞/巨噬细胞(CD11b)、T细胞(CD3)和B细胞(CD19)等特异性抗体分别进行脑组织冰冻切片的免疫荧光染色。结果发现这几类免疫细胞均可在ESCs和iPSCs移植物形成肿瘤的脑组织中检测到。在激光共聚焦显微镜下,可见由ESCs和iPSCs移植物形成的肿瘤组织表达绿色荧光蛋白,因此,采用特异性抗体标记的各类免疫细胞可与肿瘤组织和干细胞移植物相区别。此外,主要分布在肿瘤生长和脑损伤区域内的免疫细胞,其数量是与肿瘤恶性程度及脑损伤严重程度呈正相关的。
例如,在ESCs和iPSCs移植物形成3级肿瘤组内,小鼠脑组织均可见大量免疫细胞浸润和严重的组织破坏。然而,在ESCs和iPSCs移植物形成的2级和1级肿瘤组内,小鼠脑组织内浸润的免疫细胞数量相对低于3级肿瘤组,差异有统计学意义(P<0.05)。此外,在同等级别肿瘤组内,颅内浸润的免疫细胞数量在ESCs和iPSCs移植组间差异无统计学意义。与之相对,本研究发现具有绿色荧光蛋白标签的iNSCs移植物在移植后28 d小鼠颅内未检测出肿瘤形成和免疫排斥反应。而且,在NSCs移植物以及ESCs和iPSCs移植物未形成肿瘤的脑组织中均罕见上述几类免疫细胞浸润。
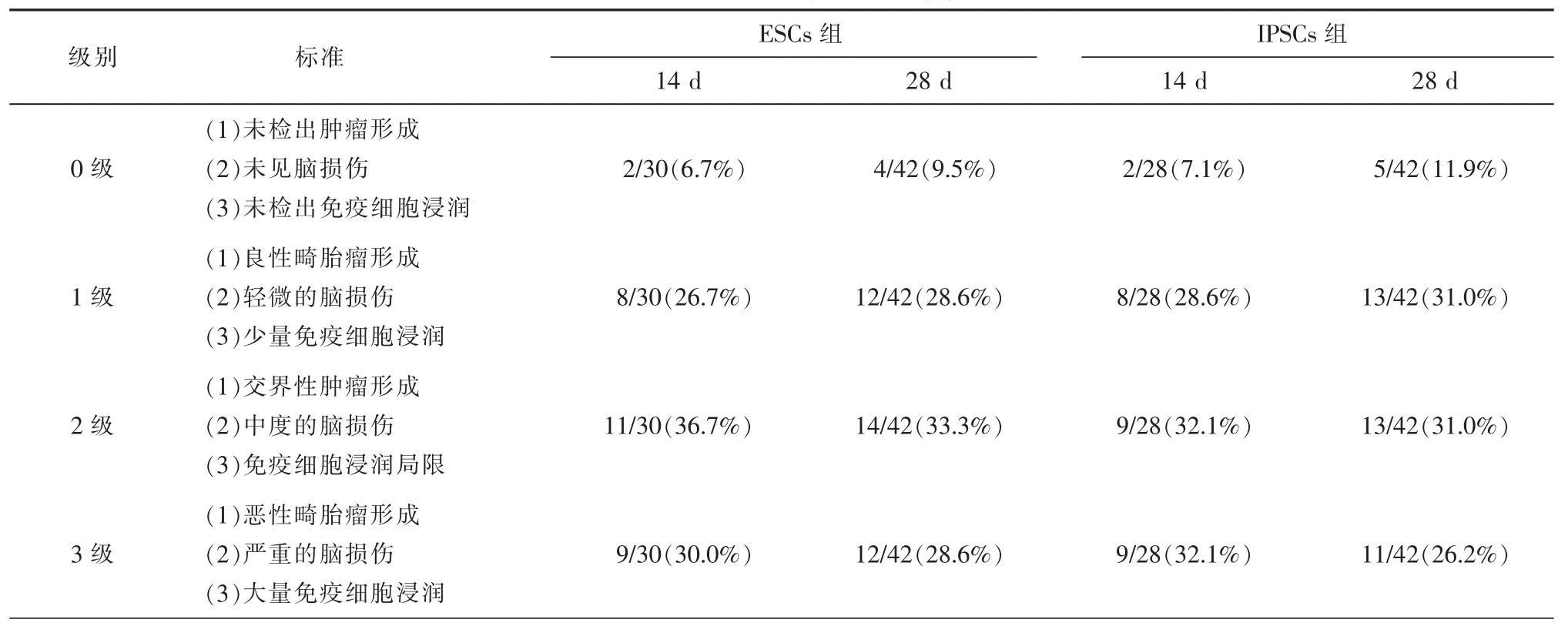
表1 ESCs和iPSCs移植组肿瘤分级
讨论
目前,以移植干细胞为主的治疗方法给中枢神经系统疾病的患者带来了新的希望。因而,评估干细胞移植物在中枢神经系统内的安全性是首先需要研究的课题[2,3]。本研究主要检测了ESCs、iPSCs、NSCs和iNSCs在同源宿主脑内的致瘤性及免疫原性。结果发现iPSCs和ESCs均可在小鼠脑内形成肿瘤导致组织坏死和免疫细胞浸润。然而,在iNSCs和NSCs移植组内,未观察到肿瘤形成、脑损伤及免疫排斥反应。由此可见iNSCs移植物不具有致瘤性和免疫原性,因而较iPSCs移植物更安全。
如前已述,笔者将干细胞移植物注射入同源小鼠大脑中作为研究对象主要基于以下几方面原因。首先,本研究的目的是评估移植的干细胞在中枢神经系统内的安全性。而且,在大脑内部独特的微环境中,研究不同类型干细胞移植物的致瘤性和免疫原性具有重大意义[2,13]。然而,目前少有研究对比iNSCs与iPSCs在脑内的致瘤性和免疫原性。此外,由于颅内容积有效,不断生长的肿瘤可以引起颅内压增高和脑组织破坏,这些都与动物死亡率升高密切相关[14,15]。因而,可以通过观察小鼠的行为改变来分析肿瘤形成。除此之外,中枢神经系统内的免疫反应非常复杂而多样,目前也是研究的热点[16,17]。因而,本研究选取了具有正常免疫功能的同源近交系小鼠大脑作为干细胞移植的位点。
为了比较干细胞移植物的致瘤性,本研究首次将脑肿瘤进行分类并统计分析了各类型肿瘤的比率。这种新的研究方法较以往研究能更加系统而全面地评估干细胞移植物的致瘤性[6]。本研究发现虽然ESCs和iPSCs移植物具有致瘤性,但二者在颅内也并非100%形成肿瘤。此外,同种类型的干细胞移植物可在颅内形成多种类型的肿瘤,包括良性、交界性和恶性肿瘤。本研究结果与之前的研究部分相符,不同之处可能是脑内微环境对干细胞移植物的行为产生了复杂的作用而导致的[3,16]。
接下来,本研究检测了干细胞移植物能否在同源宿主脑内引起免疫排斥反应。结果与之前的研究有所不同,可以归纳为以下几个方面。首先,在接受ESCs移植物的同源宿主脑内,本研究检测到免疫细胞同样浸润于形成肿瘤的区域,而这些未经过体外重编程操作的ESCs本应该避免自体免疫排斥反应。此外,在同等级别肿瘤组内,颅内浸润的免疫细胞数量在ESCs和iPSCs移植组间无明显差异。并且,如上所述,免疫细胞的数量与形成肿瘤的良恶性分级以及脑损伤严重程度呈正相关。因此,本研究推测免疫细胞浸润可能并非由干细胞移植物的免疫原性所导致,而是由ESCs和iPSCs移植物形成肿瘤和组织破坏等引起。
[1]Daley GQ.The promise and perils of stem cell therapeutics[J].Cell Stem Cell,2012,10(6):740-749.
[2]Goldring CE,Duffy PA,Benvenisty N,et al.Assessing the safety of stem cell therapeutics[J].Cell Stem Cell,2011,8(6):618-628.
[3]Hao L,Zou Z,Tian H,et al.Stem cell-based therapies for ischemic stroke[J].Biomed Res Int,2014,2014:468748.
[4]Yamanaka S.Induced pluripotent stem cells:past,present,and future[J].Cell Stem Cell,2012,10(6):678-684.
[5]Cao J,Li X,Lu X,et al.Cells derived from iPSC can be immunogenic-yes or no?[J].Protein Cell,2014,5(1):1-3.
[6]Zhao T,Zhang ZN,Rong Z,et al.Immunogenicity of induced pluripotent stem cells[J].Nature,2011,474(7350):212-215.
[7]Araki R,Uda M,Hoki Y,et al.Negligible immunogenicity of terminally differentiated cells derived from induced pluripotent or embryonic stem cells[J].Nature,2013,494(7435):100-104.
[8]Guha P,Morgan JW,Mostoslavsky G,et al.Lack of immune response to differentiated cells derived from syngeneic induced pluripotent stem cells[J].Cell Stem Cell,2013,12(4):407-412.
[9]Kaneko S,Yamanaka S.To be immunogenic,or not to be:that’s the iPSC[J].Cell Stem Cell,2013,12(4):385-386.
[10]Frank RT,Najbauer J,Aboody KS.Concise review:stem cells as an emerging platform for antibody therapy of cancer[J].Stem Cells, 2010,28(11):2084-2087.
[11]Yao H,Gao M,Ma J,et al.Trans differentiation-Induced Neural Stem Cells Promote Recovery of Middle Cerebral Artery Stroke Rats[J].PloS One,2015,10(9):e0137211.
[12]Mayshar Y,Ben-David U,Lavon N,et al.Identification and classification of chromosomal aberrations in human induced pluripotent stem cells[J].Cell Stem Cell,2010,7(4):521-531.
[13]Lee AS,Tang C,Rao MS,et al.Tumorigenicity as a clinical hurdle for pluripotent stem cell therapies[J].Nat Med,2013,19 (8):998-1004.
[14]Zulch KJ.Brain tumors:their biology and pathology[M].Springer Science&Business Media,2012.
[15]Unterberg AW,Stover J,Kress B,et al.Edema and brain trauma [J].Neuroscience,2004,129(4):1021-1029.
[16]Kokaia Z,Martino G,Schwartz M,et al.Cross-talk between neural stem cells and immune cells:the key to better brain repair?[J].Nat Neurosci,2012,15(8):1078-1087.
[17]Schwartz M,Kipnis J,Rivest S,et al.How do immune cells support and shape the brain in health,disease,and aging?[J].J Neurosci,2013,33(45):17587-17596.
Tumourigenicity and immunogenicity of induced neural stem cell grafts versus induced pluripotent stem cell grafts in syngeneic mouse brain
Gao Mou,Xu Ruxiang,Xu Minhui,Yao Hui, Dong Qin,Zhang Hongtian,Yang Zhijun,Yang Yang,Zhu Jianwei.Affiliated Bayi Brain Hospital, General Hospital of PLA Army,Beijing 100700,China
Xu Ruxiang,Email:zjxuruxiang@163.com
ObjectiveTo provide scientific basis for evaluating the tumourigenicity and immunogenicity of induced neural stem cells(iNSCs)and induced pluripotent stem cells(iPSCs)in syngeneic mouse brain.M ethodsA total of 1×106C57BL/6(B6)embryonic stem cells(ESCs),iPSCs, neural stem cells(NSCs)or iNSCs were separately transplanted into the motor cortex of syngeneic adult mouse with normal immunologic function.At 14 and 28 d post-implantation,animals were sacrificed for morphological analysis.ResultsBoth iPSCs and ESCs were able to form tumours in the mouse brain, leading to tissue destruction along with immune cell infiltration.In contrast,no evidence of tumour formation,brain injury or immune rejection was observed with iNSCs or NSCs.ConclusionINSC grafts,which lacked any resulting tumourigenicity or immunogenicity,are safer than iPSC grafts.
Tumourigenicity;Immunogenicity;Induced neural stem cell;Induced pluripotent stem cell;Transplantation
2016-09-26)
(本文编辑:张丽)
10.3877/cma.j.issn.2095-9141.2016.06.007
100700 北京,中国人民解放军陆军总医院附属八一脑科医院
徐如祥,Email:zjxuruxiang@163.com
高谋,徐如祥,许民辉,等.诱导神经干细胞与诱导多能干细胞在同源宿主脑内的致瘤性及免疫原性研究[J/CD].中华神经创伤外科电子杂志,2016,2(6):350-354.
