移植人羊膜间充质干细胞促进脊髓损伤大鼠神经功能恢复
2016-02-25周洪龙张学军张茂营闫中杰徐智敏徐如祥
周洪龙 张学军 张茂营 闫中杰 徐智敏 徐如祥
移植人羊膜间充质干细胞促进脊髓损伤大鼠神经功能恢复
周洪龙1张学军2张茂营1闫中杰3徐智敏1徐如祥1
目的研究移植人羊膜间充质干细胞(hAMSCs)是否促进脊髓损伤大鼠神经功能恢复,探索其可能作用机制。方法60只雌性SD大鼠按照随机数字表法分为磷酸盐缓冲液(PBS)治疗组(30只)和hAMSCs治疗组(30只)。脊髓损伤采用脊髓撞击损伤模型,hAMSCs或PBS立刻移植到离脊髓损伤中心2 mm的头尾两端。免疫荧光检测细胞分化,血管再生和轴突再生。酶联免疫吸附剂测定试剂盒检测脑源性神经营养因子(BDNF)和血管内皮生长因子(VEGF)含量,BBB运动功能评分检测行为学。结果在脊髓损伤后14 d、21 d和28 d,hAMSCs治疗组BBB评分分别为(8.75±0.701)、(10.375±0.532)和(12.125±0.350),高于 PBS组(6.0±0.463)、(7.25±0.412)和(9.125± 0.440),差异具有统计学意义(P<0.05)。在第7天和第14天,hAMSCs治疗组BDNF表达水平分别为(75.138±4.367)pg/mg和 (66.483±4.099)pg/mg,高于PBS组 (43.901±3.607)pg/mg和 (41.108± 3.848)pg/mg,差异具有统计学意义(P<0.05)。在第7天,第14天和第28天,hAMSCs治疗组VEGF表达水平分别为(23.328±2.463)pg/mg,(22.301±2.223)pg/mg和(14.855±1.282)pg/mg,高于PBS组(9.978±1.572)pg/mg,(9.271±1.496)pg/mg和(7.113±1.123)pg/mg,差异具有统计学意义(P<0.05)。hAMSCs治疗组血管数目(17.5±2.102)高于PBS组(6.25±1.750),差异具有统计学意义(P<0.05)。hAMSCs治疗组小鼠抗5羟色胺阳性神经纤维面积 (3486±203.643)和GAP43阳性神经纤维面积(4568.25±253.881)高于PBS组(2070.25±156.344)和(2455.725±314.475),差异具有统计学意义(P<0.05)。结论移植hAMSCs能促进脊髓损伤大鼠神经功能恢复,其作用机制可能是通过增加神经营养因子表达,促进血管再生和轴突再生。因此hAMSCs移植是治疗脊髓损伤的理想方法。
间充质干细胞;羊膜;脊髓损伤;移植;神经功能恢复
创伤性脊髓损伤(spinal cord injury,SCI)是中枢神经系统的严重疾病,常常导致患者严重的运动感觉功能障碍,也给家庭和社会带来沉重的经济负担。脊髓损伤病理机制复杂,脊髓创伤引起损伤点急性细胞死亡,血管破坏和轴突损伤,接踵而至的是二次脊髓损伤,包括炎症,水肿,自由基产生,组织缺血,兴奋性毒性,细胞凋亡和轴突变性等[1]。尽管对其进行了大量的研究,然而目前没有满意的治疗SCI方法。
干细胞移植治疗是脊髓损伤修复的理想方法。到目前为止,各种类型的干细胞已用为SCI治疗,这些细胞包括胚胎干细胞(embryonic stem cell,ESCs),神经干细胞(neural stemcells,NSCs)和间充质干细胞(mesenchymal stem cells,MSCs)[2-4]。在各种候选种子细胞中,MSCs由于其无伦理学、致瘤性和免疫排斥等问题或许是最优的。在最近几年,来源于人羊膜的间充质干细胞(human amniotic mesenchymal stem cells,hAMSCs)由于具有非侵入性提取过程、来源丰富和低免疫原性等优点特别被认为是一种理想的候选干细胞。他们能向成骨、软骨、脂肪、肝细胞和神经系列细胞分化,也具有免疫调节特性,例如抑制T淋巴细胞增殖,阻断树突细胞分化和成熟[5]。此外,hAMSCs移植能提高心肌缺血大鼠心脏功能[6],促进糖尿病小鼠伤口愈合[7],抑制四氯化碳诱导肝损伤小鼠肝纤维化[8],提高阿尔茨海默病小鼠记忆功能[9]。这些研究在hAMSCs移植对组织修复和再生方面提供了令人鼓舞的结果。然而关于hAMSCs移植对SCI的治疗效应及作用机制研究鲜有文献报道。
因此,本研究的目的是调查hAMSCs移植对SCI的治疗效应及可能的作用机制。
材料与方法
一、分离hAMSCs和细胞培养
胎盘取自6位剖宫产健康孕妇。后续处理过程经中国人民解放军陆军总医院伦理委员会知情同意。参照文献报道分离hAMSCs的方法加以改进[8]。简短的,把羊膜从绒毛膜上钝性分离下来后,用含有1%青霉素/链霉素的磷酸盐缓冲液(phosphate buffered saline,PBS)反复冲洗去除血液和污物后,用0.25%胰蛋白酶消化30 min后,在显微镜下用细胞刮轻轻刮去羊膜上皮层,剩下的组织用眼科剪剪成碎片后用1%Ⅱ型胶原酶37℃消化60 min。获取的细胞培养在添加10%胎牛血清和1%青霉素/链霉素的DMEM培养基中。
二、动物和实验分组
成年雌性SD大鼠(230~260 g)购自北京维通利华公司。所有的操作程序遵循相关动物管理条例。SD大鼠随机分为两组:hAMSCs组(n=30)和对照组(n=30)。
三、脊髓损伤模型制作和细胞移植
大鼠用3.6%的水合氯醛经腹腔麻醉后,切除T8~T10之间的部分椎板,暴露脊髓,用10 g的击锤从25 mm高度自由落体击打在T9段脊髓以制作脊髓损伤模型。损伤后即刻,5×105P4代hAMSCs重悬在5 μl PBS中,分为2个剂量,分别移植到以损伤点为中心的头尾两端,对照组注射等量的PBS。
四、免疫荧光
在SCI后28 d,大鼠(4只/组)经灌注固定后,立刻取出脊髓后固定,脱水后切成片厚20 μm的冰冻切片。对于免疫荧光染色,切片用下列一抗:小鼠抗中心点生长相关蛋白 43(growth associated protein-43,GAP-43),兔抗GFAP,兔抗髓鞘碱性蛋白(myelin basic protein,MBP),兔抗 βIII微管蛋白(Tuj1),小鼠抗人核蛋白 (hNu),小鼠抗5羟色胺(mouse 5-hydroxytryptamine,5-HT),兔抗vWF,兔抗S100。一抗4℃孵育过夜后,用PBS冲洗后,加相应的荧光二抗室温孵育2 h,图片用共聚焦荧光显微镜拍摄,用Image J软件进行分析。
五、酶联免疫吸附测定
在SCI后7 d、14 d和28 d,提取hAMSCs或PBS(在每个时间点每组取6只大鼠)注射的长约1 cm环绕损伤点的脊髓段,匀浆,离心。收集上清液,用 酶 联 免 疫 吸 附 剂 测 定(enzyme linked immunosorbent assay,ELISA)试剂盒定量分析脑源性神经营养因子 (brain derived neurotrophic factor,BDNF)和血管内皮生长因子 (vascular endothelial growth factor,VEGF)含量。
六、大鼠后肢功能的评定
在SCI后1 d、7 d、14 d、21 d和28 d,由两位不知道实验分组的实验人员对大鼠 (8只/组)进行BBB运动功能评分。后肢全瘫为0分,完全正常为21分,两者之间根据功能分别定为0~21分。
七、统计学分析
统计学分析由SPSS13.0完成。实验结果用均数±标准差(±s)表示。行为学数据比较使用重复测量的方差分析。血管数据比较使用曼-惠特尼 U检验方法分析,其它数据则使用t检验分析。以P<0.05为差异具有统计学意义。
结果
一、hAMSCs在体内分化
双标染色 hNu和神经细胞特定标志物检测hAMSCs在体内向神经分化潜能。结果显示在移植后28 d,hAMSCs不能向神经元、星型胶质细胞、少突胶质细胞和雪旺细胞分化(图1)。
二、移植hAMSCs促进血管再生
为了评估移植的hAMSCs是否能促进血管再生,脊髓切片用vWF抗体染色并分析损伤中心点血管数目。结果显示hAMSCs治疗组血管数目17.5± 2.102高于PBS组6.25±1.750,差异具有统计学意义(P<0.05)(图2A~2C)。
三、移植hAMSCs促进轴突再生
为了评估移植hAMSCs是否能促进脊髓轴突再生,本研究检测损伤GAP-43蛋白表达和离损伤点尾侧5~7 mm腹侧区5-HT蛋白的表达。结果显示hAMSCs治疗组 GAP-43阳性神经纤维面积4568.25±253.881高于PBS组2070.25±156.344,差异具有统计学意义(P<0.05)(图2D~2F)。hAMSCs治疗组5-HT阳性神经纤维面积3486±203.643高于PBS组2455.725±314.475,差异具有统计学意义(P<0.05)(图2G~2I)。
四、移植hAMSCs提高损伤脊髓BDNF和VEGF表达水平
本研究用ELISA试剂盒检测SCI后7 d、14 d和28 d损伤脊髓BDNF和VEGF表达水平。在第7天和第14天,hAMSCs治疗组BDNF表达水平分别为(75.138±4.367)pg/mg和(66.483±4.099)pg/mg,高于PBS治疗组(43.901±3.607)pg/mg和(41.108± 3.848)pg/mg,差异具有统计学意义 (P<0.05)(图3A)。在第7天、第14天和第28天,hAMSCs治疗组VEGF表达水平分别为(23.328±2.463)pg/mg,(22.301±2.223)pg/mg和 (14.855±1.282)pg/mg,高于PBS治疗组 (9.978±1.572)pg/mg,(9.271±1.496)pg/mg和(7.113±1.123)pg/mg,差异具有统计学意义(P<0.05)(图3B)。
五、移植hAMSCs促进运动功能恢复
本研究用BBB评分表评估脊髓损伤大鼠后肢运动功能,结果显示在脊髓损伤后14 d、21 d和28 d,hAMSCs治疗组BBB评分分别为8.75±0.701、10.375±0.532和 12.125±0.350,高于 PBS组评分6.0±0.463、7.25±0.412和9.125±0.440,差异具有统计学意义(P<0.05)(图3C)。
讨论
本研究目前的数据显示移植hAMSCs到损伤脊髓能增加营养因子BDNF和VEGF的表达水平,促进轴突再生和血管再生,促进运动功能恢复。
本实验过程中并没有应用免疫抑制剂,然而移植的hAMSCs在体内存活至少28 d,说明hAMSCs具有良好的免疫耐受能力。免疫双标染色结果表明hAMSCs移植到损伤脊髓28 d后并不能向神经元、星型胶质细胞、少突胶质细胞和雪旺氏细胞转分化。因此,笔者认为移植hAMSCs到损伤脊髓导致的治疗效应是通过旁分泌作用而不是细胞替代作用。这些结果与其他的研究组的结果是一致的,支持MSCs导致功能恢复并不是通过细胞替代[10,11]。
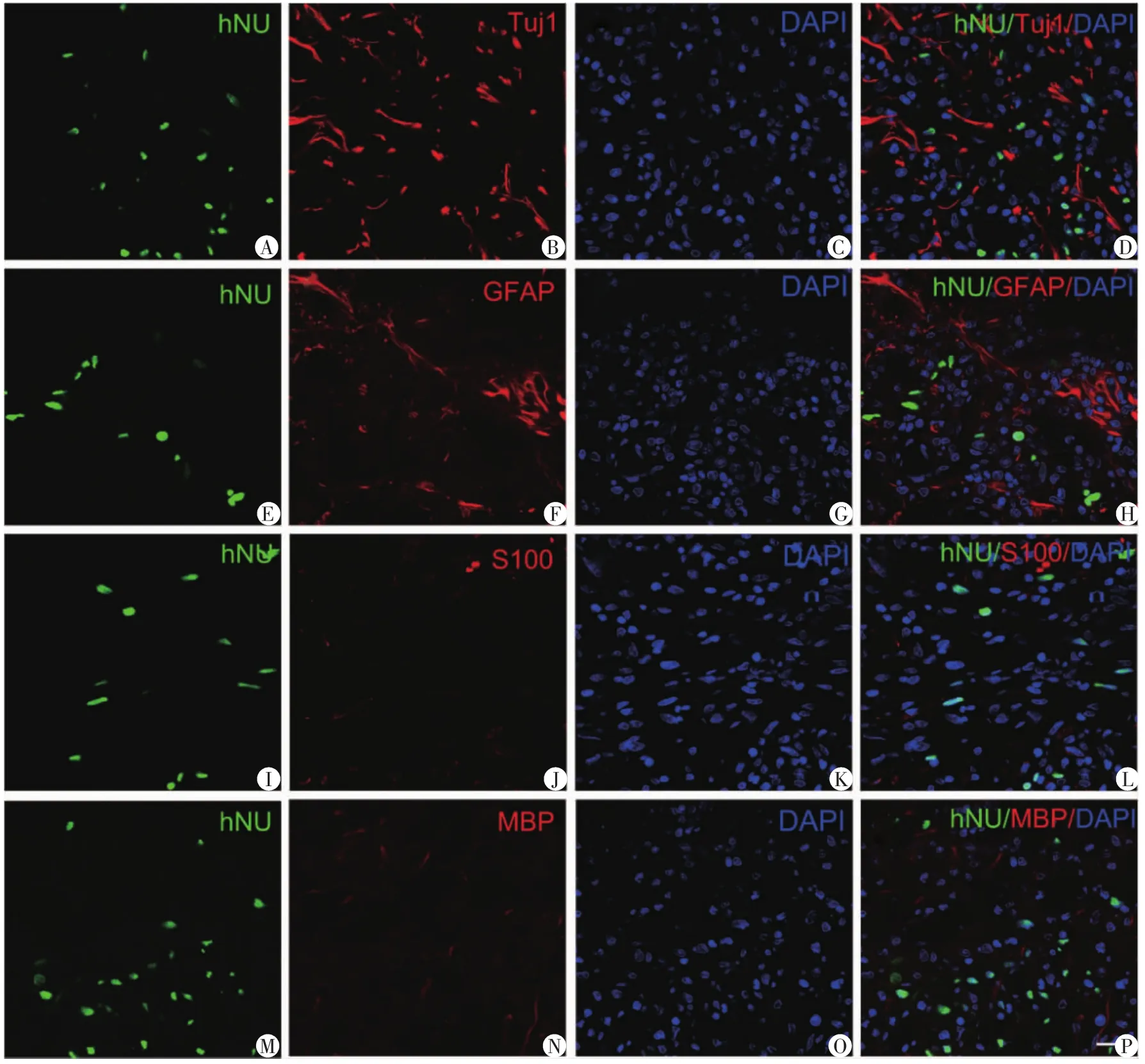
图1 在移植后28 d人羊膜间充质干细胞保持未分化状态
BDNF是中枢神经系统常见的神经营养因子,能保护神经元,促进轴突再生,突触可塑性和髓鞘再生[12]。应用BDNF能减少空洞面积,促进神经元存活,提高SCI大鼠运动功能[13]。移植BDNF过表达MSCs能促进SCI大鼠轴突再生和功能恢复[14]。本研究结果显示移植hAMSCs能提高损伤脊髓BDNF表达水平,与BDNF上调结果一致的是,免疫荧光结果显示与对照组相比,hAMSCs组损伤中心GAP-43+神经纤维面积更大。相似的,移植hAMSCs促进5-HT+神经纤维再生。这些结果表明移植hAMSCs促进功能恢复部分是通过上调BDNF从而促进神经再生。
血管再生,是在原有血管的基础上生成新血管的过程,在脊髓损伤后组织修复过程中起重要作用[15]。因此,脊髓损伤后增强血管再生是治疗SCI的一个重要目的。hAMSCs具有强大的促血管再生能力,能分泌多种促血管再生因子,移植hAMSCs能促进包括心肌缺血在内的多种缺血性疾病血管再生[6]。在各种促血管生成因子中,VEGF对血管再生起关键作用,也呈现神经保护作用[16]。应用VEGF能够增加血管密度,减少细胞凋亡,提高SCI大鼠运动功能[17]。笔者发现与对照组相比,hAMSCs组VEGF表达水平和vWF+血管数目更高。因此,hAMSCs移植促进SCI大鼠运动功能恢复作用机制之一是通过上调VEGF表达水平从而促进血管再生。
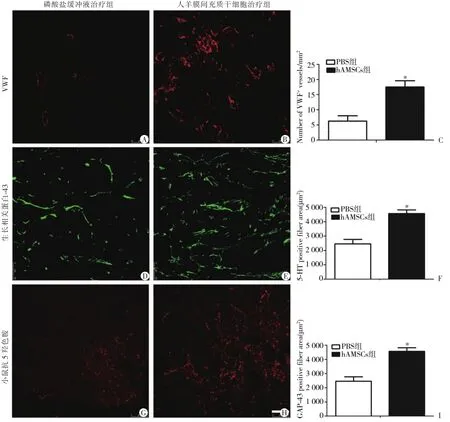
图2 人羊膜间充质干细胞移植促进轴突再生和血管再生

图3 hAMSCs移植提高脊髓脑源性神经营养因子和血管内皮生长因子含量和大鼠运动功能
总之,hAMSCs移植促进SCI大鼠运动功能恢复。其可能是通过提高营养因子BDNF和VEGF表达,促进血管再生和神经再生起作用。因此,hAMSCs是治疗SCI的理想干细胞。
[1]Hagg T,Oudega M.Degenerative and spontaneous regenerative processes after spinal cord injury[J].J Neurotrauma,2006,23(3-4):264-280.
[2]Bottai D,Cigognini D,Madaschi L,et al.Embryonic stem cells promote motor recovery and affect inflammatory cell infiltration in spinal cord injured mice[J].Exp Neurol,2010,223(2):452-463.
[3]McMahon SS,Albermann S,Rooney GE,et al.Engraftment, migration and differentiation of neural stem cells in the rat spinal cord following contusion injury[J].Cytotherapy,2010,12(3):313-325.
[4]Lee KH,Suh-Kim H,Choi JS,et al.Human mesenchymal stem cell transplantation promotes functional recovery following acute spinal cord injury in rats[J].Acta Neurobiol Exp(Wars),2007,67 (1):13-22.
[5]Diaz-Prado S,Muinos-Lopez E,Hermida-Gomez T,et al.Human amniotic membrane as an alternative source of stem cells for regenerative medicine[J].Differentiation,2011,81(3):162-171.
[6]Kim SW,Zhang HZ,Kim CE,et al.Amniotic mesenchymal stem cells with robust chemotactic properties are effective in the treatment of a myocardial infarction model[J].Int J Cardiol,2013, 168(2):1062-1069.
[7]Kim SW,Zhang HZ,Guo L,et al.Amniotic mesenchymal stem cells enhance wound healing in diabetic NOD/SCID mice through high angiogenic and engraftment capabilities[J].PloS one,2012, 7(7):e41105.
[8]Zhang D,Jiang M,Miao D.Transplanted human amniotic membrane-derived mesenchymal stem cells ameliorate carbon tetrachloride-induced liver cirrhosis in mouse[J].PloS one,2011, 6(2):e16789.
[9]Kim KS,Kim HS,Park JM,et al.Long-term immunomodulatory effect of amniotic stem cells in an Alzheimer’s disease model[J]. Neurobiol Aging,2013,34(10):2408-2420.
[10]Hu SL,Luo HS,Li JT,et al.Functional recovery in acute traumatic spinal cord injury after transplantation of human umbilical cord mesenchymal stem cells[J].Crit Care Medicine, 2010,38(11):2181-2189.
[11]Sasaki M,Radtke C,Tan AM,et al.BDNF-hypersecreting human mesenchymal stem cells promote functional recovery,axonal sprouting,and protection of corticospinal neurons after spinal cord injury[J].J Neurosci,2009,29(47):14932-14941.
[12]Kishino A,Ishige Y,Tatsuno T,et al.BDNF prevents and reverses adult rat motor neuron degeneration and induces axonal outgrowth[J].Exp Neurol,1997,144(2):273-286.
[13]Novikova L,Novikov L,Kellerth JO.Brain-derived neurotrophic factor reduces necrotic zone and supports neuronal survival after spinal cord hemisection in adult rats[J].Neurosci Lett,1996,220 (3):203-206.
[14]Lu P,Jones LL,Tuszynski MH.BDNF-expressing marrow stromal cells support extensive axonal growth at sites of spinal cord injury[J].Exp Neurol,2005,191(2):344-360.
[15]Oudega M.Molecular and cellular mechanisms underlying the role of blood vessels in spinal cord injury and repair[J].Cell and tissue research,2012,349(1):269-288.
[16]Storkebaum E,Lambrechts D,Carmeliet P.VEGF:once regarded as a specific angiogenic factor,now implicated in neuroprotection [J].Bioessays,2004,26(9):943-954.
[17]Sundberg LM,Herrera JJ,Narayana PA.Effect of vascular endothelial growth factor treatment in experimental traumatic spinal cord injury:in vivo longitudinal assessment[J].J Neurotrauma, 2011,28(4):565-578.
Transplantation of human amniotic mesenchymal stem cells promotes functional recovery in a rat model of traumatic spinal cord injury
Zhou Honglong1,Zhang Xuejun2,Zhang Maoying1,Yan Zhongjie3,Xu Zhimin1,Xu Ruxiang1.1Affiliated Bayi Brain Hospital,The PLA Army General Hospital, Beijing 100700,China;2Department of Gynecology and Obstetrics,The PLA Army General Hospital, Beijing 100700,China;3Department of Neurosurgery,The Second Hospital of Hebei Medical University, ShiJiazhuang 050000,China
ObjectiveTo assess whether hAMSCs transplantation promotes neurological functional recovery in rats after traumatic spinal cord injury(SCI).In addition,the potential mechanisms underlying the possible benefits of this therapy were investigated.MethodsA total of 60 Female Sprague-Dawley rats were divided into PBS group and hAMSCs group (n=30).The SCI models were induced by a weight Drop device and then hAMSCs,or phosphate buffered saline(PBS)were immediately injected into the contused dorsal spinal cord at 2 mm rostral and 2 mm caudal to the injury site.Immunohistochemistry were performed to assay differentiation,angiogenesis and axonal regeneration. The expressions of BDNF and VEGF were analyzed by ELISA.Hind limb motor function was assessedwith Basso,Beattie and Bresnahan (BBB)locomotor rating scale.ResultsAt 14,21 and 28 d after SCI,BBB scores(8.75±0.701,10.375±0.532,12.125±0.350)of the hAMSCs group were significantly higher than that of PBS group(6.0±0.463,7.25±0.412,9.125±0.440)(P<0.05).At 7 and 14 d after SCI, the levels of BDNF(75.138±4.367 pg/mg,66.483±4.099 pg/mg)of the hAMSCs group were significantly higher than that of PBS group(43.901±3.607 pg/mg,41.108±3.848 pg/mg)(P<0.05).At 7,14 and 28 d after SCI,the levels of VEGF (23.328±2.463 pg/mg,22.301±2.223 pg/mg,14.855±1.282 pg/mg)were significantly higher than that of PBS group(9.978±1.572 pg/mg,9.271±1.496 pg/mg,7.113±1.123 pg/mg) (P<0.05).The number of vWF+blood vessels 17.5±2.102 in the hAMSCs group was significantly higher than that in PBS group 6.25±1.750(P<0.05).The 5HT+fiber area 3486±203.643 and GAP43+fiber area 4568.25±253.881 in the hAMSCs group were significantly higher than that in PBS group (2070.25± 156.344,2455.725±314.475)(P<0.05).ConclusionhAMSCs transplantation significantly enhanced neurological function in rats after SCI.This enhanced neurological function may be due to increased expression of neurotrophic factors and both angiogenesis and axonal regeneration.Thus,hAMSCs transplantation appears to be promising in the treatment of SCI.
Mesenchymalstem cells;Human amnion;Spinal cord injury;Transplantation; Functional recovery
2016-08-18)
(本文编辑:张丽)
10.3877/cma.j.issn.2095-9141.2016.06.008
全军医药科技“十二五”重点项目(BWS11J002);全军医药科技“十二五”重点项目(BWS12J010);国家自然科学基金(81401032)
100700北京,解放军陆军总医院附属八一脑科医院1;100700 北京,解放军陆军总医院妇产科2;050000 石家庄,河北医科大学第二医院神经外科3
徐如祥,Email:zjxuruxiang@163.com
周洪龙,张学军,张茂营,等.移植人羊膜间充质干细胞促进脊髓损伤大鼠神经功能恢复[J/CD].中华神经创伤外科电子杂志,2016,2(6):355-360.
