间充质干细胞与白细胞介素10对四氯化碳诱发的肝纤维化大鼠的治疗作用①
2016-02-24张英杰郝晓娜郝艳梅李玉云
张英杰 禹 丽 郝晓娜 郝艳梅 李玉云
(蚌埠医学院医学检验系临床检验诊断学教研室, 蚌埠233030)
间充质干细胞与白细胞介素10对四氯化碳诱发的肝纤维化大鼠的治疗作用①
张英杰禹丽郝晓娜郝艳梅李玉云
(蚌埠医学院医学检验系临床检验诊断学教研室, 蚌埠233030)
[摘要]目的:探究人脐带源间充质干细胞(MSCs)的分离、培养方法,通过对MSCs与IL-10联合治疗四氯化碳诱导的大鼠肝纤维化的研究,观察其协同效应,为临床治疗肝纤维化寻找新方法,并阐明其在肝纤维化治疗中的部分机制。方法:自然贴壁法分离、纯化人脐带间充质干细胞并进行体外培养和扩增。50只大鼠随机选取5只入选正常对照组(n=5),其余45只大鼠采用皮下多点注射CCl4方法制备大鼠肝纤维化模型,造模成功后随机分为模型损伤组(n=15)、细胞移植组(n=15)和联合用药组(n=15)。细胞移植组在模型制备成功后的第1周、第2周、第3周经尾静脉给予1×106脐带间充质干细胞治疗;联合治疗组在给予细胞移植组相同的细胞治疗基础上,给予腹腔内注射IL-10(4 μg/kg),每周4次。4周后将大鼠处死,收集各组大鼠血液检测肝功能、肝纤维化指标;摘取肝脏行苏木精-伊红染色,观察病理变化;RT-PCR法检测MMP-2 mRNA表达情况,Western blot 法检测TGF-β蛋白的表达。结果:细胞移植组与联合治疗组大鼠肝功能、肝纤维化指标均明显改善,与对照组比较,差异有显著性意义(P<0.05),且联合治疗组改善更明显(P<0.05);大鼠肝组织苏木精-伊红染色提示,细胞移植组、联合治疗组肝纤维化程度明显改善,联合治疗组肝脏病理更接近于正常;损伤组、细胞移植组MMP-2 mRNA表达明显增高,明显高于正常对照组(P<0.05),联合治疗组MMP-2 mRNA表达增高,与正常对照组比较无显著性差异(P>0.05);与正常对照组比较,其他组TGF-β蛋白的表达都有所增高(P<0.05),其中损伤组TGF-β蛋白的表达增高最明显(P<0.05),细胞移植组、联合治疗组TGF-β蛋白的表达较损伤组均有不同程度的降低(P<0.05),联合治疗组与细胞移植组比较TGF-β蛋白的表达也有显著降低(P<0.05)。结论:脐带间充质干细胞单独移植或与IL-10联合治疗均可以改善肝纤维化大鼠外周血液的生化特性和肝的组织学结构,且IL-10联合治疗效果更佳,这可能是由于间充质干细胞与IL-10可下调MMP-2 mRNA的表达,保护肝小叶结构;抑制TGF-β蛋白的表达,减少肝星状细胞的激活等原因。
肝纤维化(Hepatic fibrosis,HF)是由于各种致病因素引起的肝脏损害和炎症,在组织修复过程中导致肝脏细胞外基质(Extracellular matrix,ECM)代谢失衡,发生异常增多和过度沉积的病理过程[1],是肝组织修复过程中的代偿反应,这一阶段若得不到有效治疗,最终会发展为肝硬化,甚至导致患者死亡。目前对于肝硬化的治疗仅限于去除潜在的刺激,用干扰素、病毒唑和拉米呋定等对病毒性肝炎进行抗病毒治疗,以及最后的治疗手段——肝移植。但是由于移植器官的来源有限,需要移植的患者数量众多,以及由于一些因素的限制并非每个患者都适于移植,因此迫切需要发展有效的抗纤维化治疗手段。干细胞移植是目前治疗肝功能衰竭的一个新的研究方向。脐带间充质干细胞能不断地进行自我更新,同时具有多系横向分化的潜能,在一定条件下经体内外生长因子诱导可定向分化为肝细胞,且具备分泌多种可溶性细胞因子功能,从而刺激内源性的实质细胞增生以支持组织的恢复[2-5]。可是,越来越多的证据表明,间充质干细胞可以归巢到伤肝,但分化为肝细胞的数目并不多。这可能是由于已损伤的肝脏微环境,不利于MSCs生长,从而影响了其对受损肝脏的进一步修复功能。近年来随着对肝纤维化形成的分子机制的深入研究,细胞因子在肝纤维化发生、发展中的作用日益凸显。IL-10 作为一种负性免疫调节因子,其拮抗肝纤维化的作用已不断得到证实。
因此本实验创造性地将MSCs和IL-10相结合,旨在观察其治疗CCl4诱导的大鼠肝纤维化的协同作用,并阐明其在肝纤维化治疗中的部分机制。
1材料与方法
1.1材料
1.1.1实验动物雄性 SD 大鼠50只,3 月龄,体质量180~200 g,实验动物均由蚌埠医学院实验动物中心提供,动物使用许可证号:SYXK(皖2013-03),自由饮水和进食。实验过程中对动物的处置符合医学伦理学标准。
1.1.2脐带标本来源于蚌埠医学院附属第一医院妇产科足月妊娠分娩胎儿脐带(脐带为废弃物,无伦理学问题)。
1.1.3主要试剂DMEM 培养液( Invitrogen 公司),10%胎牛血清(Hyclone公司),胰蛋白酶(宝泰克生物技术有限公司),PBS缓冲液(自制),四氯化碳液(太原化工厂),花生油(鲁花5S压榨一级花生油),HA和PCIII放射免疫分析试剂盒(上海海研医学生物技术有限公司),Trizol试剂(Invitrogen公司),Taq酶(MBI Fermentas公司),TGF-β抗体(Bioworld Technology)。
1.1.4主要仪器超净工作台(SANYO公司),CO2恒温细胞培养箱(YAMATO公司),相差倒置光学显微镜(Olympus)等。
1.2方法
1.2.1脐带源间充质干细胞的分离培养将在无菌条件下取得的足月妊娠分娩胎儿脐带充分洗涤后,剔除脐带动静脉,刮取Wharton′s Jelly(间质组织)层,剪碎成约1 mm3大小的组织块,用DMEM冲洗,冲洗液接种于含10%胎牛血清DMEM培养基中,当细胞融合时,用胰蛋白酶消化传代。
1.2.2脐带间充质干细胞的鉴定细胞传至第4代后,用消化液消化细胞,PBS洗涤2次(1 000 r/min),流式细胞术检测CD34、CD29、CD31的表达情况)。
1.2.3动物模型的制备与分组50只SD 雄性大鼠随机选取5只入选正常对照组,其余45只用于造模,采用40% CCl4花生油溶液(自行配制)腹腔注射法制造慢性肝损伤模型。CCl4花生油溶液的浓度为 40%,剂量为2 ml/kg,每周一和周四腹腔注射40%CCl4花生油溶液,共注射4周,将上述经 CCl4处理后的大鼠随机均分为模型损伤组、细胞移植组和联合用药组,细胞移植组(n=15):造模4周后,分别在第1、8、15天,经鼠尾静脉输注1×106L-1的脐带间充质干细胞1 ml;联合治疗组(n=15):在给予与细胞移植组相同的干细胞治疗的情况下,腹腔内注射IL-10(4 μg/kg),每周4次。模型对照组(n=15):造模4周后,与细胞移植组在相同时间等剂量注射生理盐水。
1.2.4血液标本的收集、保存及检测正常饮食饲养各组动物4周后,4%水合氯醛2 ml腹腔注射麻醉大鼠,麻醉满意后,取血行肝功能检测:血清白蛋白(ALB)和丙氨酸氨基转移酶(ALT);取血行肝纤维化指标检测:HA(透明质酸酶)和PCⅢ (Ⅲ型前胶原)。
1.2.5肝脏病理学观察取动物肝脏左叶,体积分数10%的甲醛固定,石蜡包埋切片,苏木精-伊红染色镜检观察肝组织病理变化;并按下述标准评判肝纤维化程度[4]:“-”无成纤维细胞增生(0分);“+”汇管区扩大,有少量成纤维细胞增生(1分);“++”汇管区成纤维细胞增生并向小叶内延伸,呈较窄较短的纤维素条(2分);“+++”汇管区成纤维细胞大量增生并向小叶内明显延伸,形成纤维隔伴有小叶结构紊乱(3分)。请病理教研室同一位老师单盲读片进行评分。
1.2.6MMP-2 mRNA的表达取-80℃ 冰箱保存的各组肝脏100 mg,置于匀浆器,加入 1.0 ml Trizol液,参照Trizol试剂说明书提取细胞总RNA。取3 μl总RNA作为模板,用随机引物法逆转录合成cDNA,再以此cDNA 2 μl为模板,PCR扩增,引物由上海生工生物工程技术服务有限公司合成,引物序列见表1。PCR反应体系终体积为25 μl,反应条件:95℃预变性3 min,94℃变性30 s,59℃退火30 s,72℃延伸45 s,36个循环后72℃ 平衡7 min,4℃保存。PCR产物进行1.5%琼脂糖凝胶电泳,Smartview图像分析处理系统进行灰度扫描分析。
1.2.7Western blot法检测TGF-β蛋白的表达分别取各组50 mg肝组织,加入1 ml蛋白裂解液裂解30 min,再经4℃、12 000 r/min离心10 min,取上清,BCA法蛋白定量。加入上样缓冲液,煮沸5 min。每孔加入20 μl总蛋白上样,进行SDS-PAGE(8%分离胶,5%浓缩胶)电泳,电压90 V,待溴酚蓝电泳达凝胶底部时将凝胶中的蛋白质湿转至硝酸纤维素膜(PVDF)上。采用丽春红s染膜、考马斯亮蓝染胶,通过与蛋白Marker比较,确定目的条带位置。再将PVDF膜置于含5%脱脂奶粉的TBST中,室温下摇床轻摇2 h进行封闭。加入大鼠抗TGF-β单抗,4℃孵育过夜继以相匹配的辣根过氧化物酶结合的二抗室温孵育1 h,TBST充分洗膜。ECL显色,暗室曝光,凝胶成像系统扫描成像。
表1RT-PCR引物
Tab.1Primer of RT-PCR
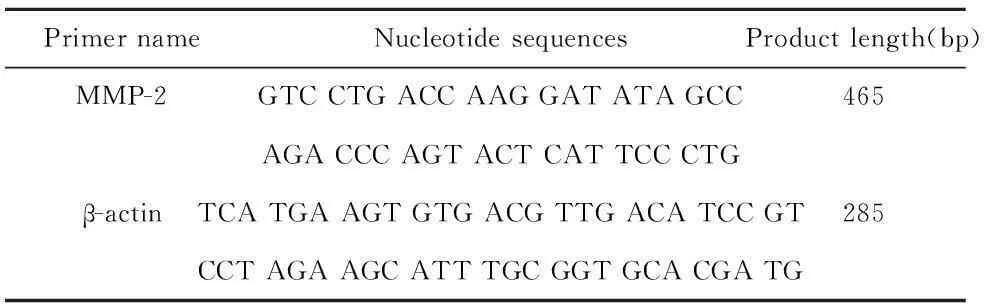
PrimernameNucleotidesequencesProductlength(bp)MMP-2GTCCTGACCAAGGATATAGCC465AGACCCAGTACTCATTCCCTGβ-actinTCATGAAGTGTGACGTTGACATCCGT285CCTAGAAGCATTTGCGGTGCACGATG
1.3统计学分析所有数据采用P表示,用SPSS13.0软件包进行统计学分析。多组样本间比较采用单因素方差分析方法,组间两两比较采用q检验,以α=0.05 水准,P<0.05 为差异具有显著性意义。
2结果
2.1人脐带间充质干细胞的培养组织块贴壁后1周可见散在分布、贴壁生长的细胞集落。细胞多为双突起的长梭形或扁平形的成纤维样细胞;14 d时细胞贴满瓶底,此时呈鱼群样、漩涡状、辐射状或网状排列(图1)。传代后细胞增殖迅速,一般2~3 d可传1代。
2.2人脐带间充质干细胞的鉴定选取状态较稳定的第4代脐带间充质干细胞,流式细胞术分析结果显示,脐带源性间充质干细胞均强表达整合素黏附分子CD29(97.32±2.77)%,而造血干细胞的标记C34表达率仅为(1.01±0.56)%,内皮细胞标记CD31仅为(2.47±0.54)%,见图2。图2可见细胞强表达整合素黏附分子CD29,而造血细胞的标记C34和内皮细胞标记CD31少见表达,符合脐带间充质干细胞的表达。

图1 实验的脐带间充质干细胞Fig.1 Umbilical cord-mesenchymal stem cellsNote: A.Primary cultured Mesenchymal stem cells(×400);B.The fourth generation of cultured Mesenchymal stem cells(×400).
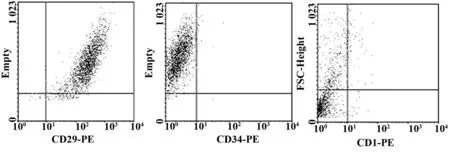
图2 分离的人脐带间充质干细胞的免疫表型Fig.2 Immunology phenotype of umbilical cord-mesen-chymal stem cells
2.3血清肝功能生化ALT、ALB结果的比较脐带间充质干细胞移植4周后,将全部大鼠处死,收集血液,检测血清ALT、ALB变化,并与正常对照组大鼠血清ALT、ALB进行比较(表2)。结果显示,模型损伤、细胞移植组、联合治疗组与正常对照组比较,血清ALT、ALB均有不同程度增高,结果有显著性差异(P<0.05),提示肝损伤仍然存在;细胞移植组、联合治疗组与模型损伤组比较ALT、ALB明显降低,且有显著性差异(P<0.05),提示与模型损伤组比较肝功能有明显恢复;联合治疗组与细胞移植组比较ALT、ALB也有显著降低(P<0.05),提示联合治疗组肝功能恢复更佳。
2.4血清肝纤维化指标HA和PCⅢ的检测将全部处死大鼠的血清进行HA和PCⅢ的检测,并与正常对照组大鼠血清HA、PCⅢ进行比较(表3)。
结果显示,模型损伤、细胞移植组、联合治疗组与正常对照组比较,血清HA和PCⅢ均有不同程度增高,结果有显著性差异(P<0.05),提示肝纤维化仍然存在;细胞移植组、联合治疗组与模型损伤组比较HA和PCⅢ明显降低,且有显著性差异(P<0.05),提示与模型损伤组比较肝纤维化有明显恢复;联合治疗组与细胞移植组比较HA和PCⅢ也有显著降低(P<0.05),提示联合治疗组肝纤维化恢复更佳。
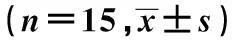


GroupsALT(U/L)ALB(g/L)Controlgroup28.58±8.2135.25±1.25Modelgroup256.32±16.581)22.77±1.321)MSCstransplantinggroup94.47±10.621)2)27.13±1.111)2)Combinationtherapygroup45.47±9.521)2)3)30.34±1.121)2)3)
Note:Compared with control groups,1)P<0.05;compared with model group,2)P<0.05;compared with MSCs transplanting group,3)P<0.05.
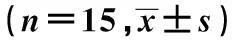

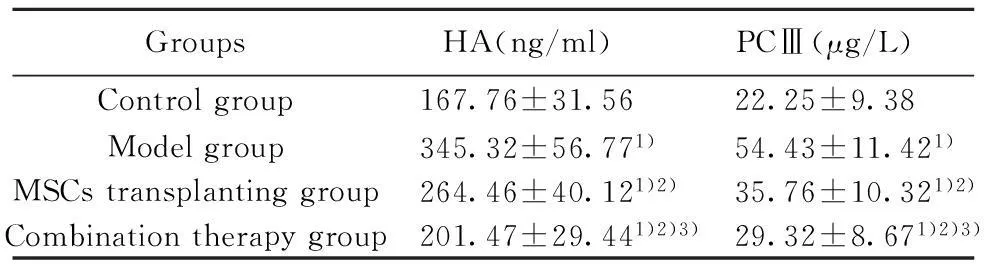
GroupsHA(ng/ml)PCⅢ(μg/L)Controlgroup167.76±31.5622.25±9.38Modelgroup345.32±56.771)54.43±11.421)MSCstransplantinggroup264.46±40.121)2)35.76±10.321)2)Combinationtherapygroup201.47±29.441)2)3)29.32±8.671)2)3)
Note:Compared with control groups,1)P<0.05;compared with model group,2)P<0.05;compared with MSCs transplanting group,3)P<0.05.
2.5苏木精-伊红染色法观察病理变化模型损伤组肝锁严重紊乱,炎细胞浸润,成纤维细胞增生(图3B);脐带间充质干细胞移植组肝锁紊乱,成纤维细胞增生不明显(图3C);联合治疗组肝小叶肝细胞排列整齐,小叶结构明显修复(图3D)。病理结果提示,脐带间充质干细胞移植组明显好于模型损伤组,联合治疗组与细胞移植组比较,联合治疗效果更佳。
2.6脐带间充质干细胞对肝纤维化程度的影响请病理教研室同一位老师单盲读片对肝纤维化程度进行评分(表4),结果显示细胞移植组、联合治疗组与模型损伤组大鼠比较损伤程度明显好转,且联合治疗组比细胞移植组恢复程度更佳,差异有显著性意义(P<0.05)。
2.7RT-PCR法检测MMP-2 mRNA的表达如表5与图4所示,正常对照组MMP-2 mRNA表达极低,损伤组、细胞移植组MMP-2 mRNA明显增高,明显高于正常对照组(P<0.05),联合治疗组MMP-2 mRNA表达增高,与正常对照组比较无显著性差异(P>0.05)。
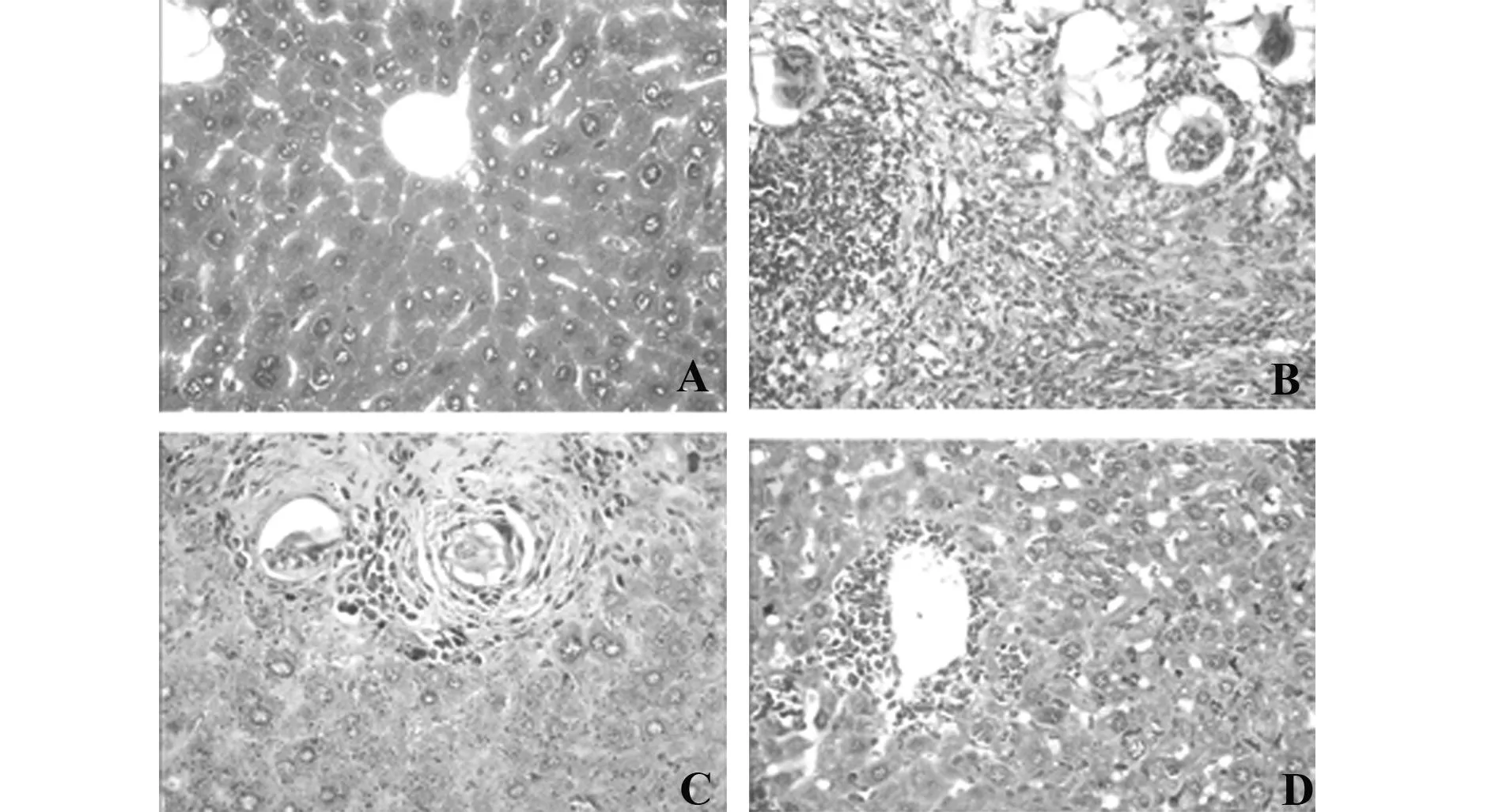
图3 苏木精-伊红染色法观察大鼠肝纤维化病理变化(×400)Fig.3 Pathological changes of hepatic fibrosis in rats(HE staining,×400)Note: A.Control group;B.Model group;C.MSCs transplanting group;D.Combination therapy group.
表4肝纤维化程度评分
Tab.4Score of liver fibrosis

Modelgroup(n=15)MSCstransplantinggroup(n=15)Combinationtherapygroup(n=15)0point0001point01132point41223point1120Means(Score)2.732.071)1.131)2)
Note:Compared with model group,1)P<0.05;compared with MSCs transplanting group,2)P<0.05.
表5大鼠肝组织MMP-2 mRNA变化
Tab.5Changes of MMP-2 mRNA in liver tissue of rats

GroupsMMP-2(%)Controlgroup(n=5)9.1±1.2Modelgroup(n=15)20.2±2.21)MSCstransplantinggroup(n=15)12.1±1.21)Combinationtherapygroup(n=15)10.4±1.52)
Note:Compared with control groups,1)P<0.05,2)P>0.05.

图4 大鼠肝组织MMP-2 mRNA变化Fig.4 Changes of MMP-2 mRNA in liver tissue of ratsNote: 1.Control group;2.Combination therapy group;3.MSCs transplanting group;4.Model group.

图5 大鼠肝组织TGF-β蛋白变化Fig.5 Changes of TGF-β mRNA in liver tissue of ratsNote: 1.Control group;2.Model group;3.MSCs transplanting group;4.Combination therapy group.
2.8Western blot法检测TGF-β蛋白的表达如图5与表6所示,与正常对照组比较,损伤组TGF-β蛋白的表达明显增高(P<0.05),细胞移植组、联合治疗组TGF-β蛋白的表达较损伤组均有不同程度的降低(P<0.05),联合治疗组与细胞移植组比较TGF-β蛋白的表达也有显著降低(P<0.05)。
3讨论
脐带间充质干细胞(MSCs)是干细胞的一种类型,具备干细胞的重要特征,即很强的自我增殖能力和多向分化潜能。且人MSCs具有低免疫原性,不表达MHCⅡ类分子和B7等共刺激分子,具有免疫赦免特性,即可在相同或不同种属间移植,而不发生移植排斥反应。且脐带为废弃物,细胞来源不涉及社会和伦理学等方面的争议,这使其在近年来国内外研究中倍受关注。近年来,MSCs对肝纤维化治疗作用的研究不断深入,国内外研究证明来自其他组织的干细胞能够归巢到肝脏,并可能参与肝组织的再生[1-5],且具备分泌多种可溶性细胞因子功能,从而刺激内源性的实质细胞增生以支持组织的恢复[6,7]。在MSCs移植治疗肝纤维化模型中人们发现MSCs移植可以减轻肝纤维化并恢复枯竭的肝功能[8-10]。可是,越来越多的证据表明,间充质干细胞可以归巢到伤肝,但无法分化成肝细胞[11,12],这与我们之前的研究结果可分化为肝细胞但数目并不多相一致。这可能是由于已损伤的肝脏微环境,不利于MSCs生长,从而影响了其对受损肝脏的进一步修复功能。
表6大鼠肝组织TGF-β蛋白变化
Tab.6Changes of TGF-β protein in liver tissue of rats
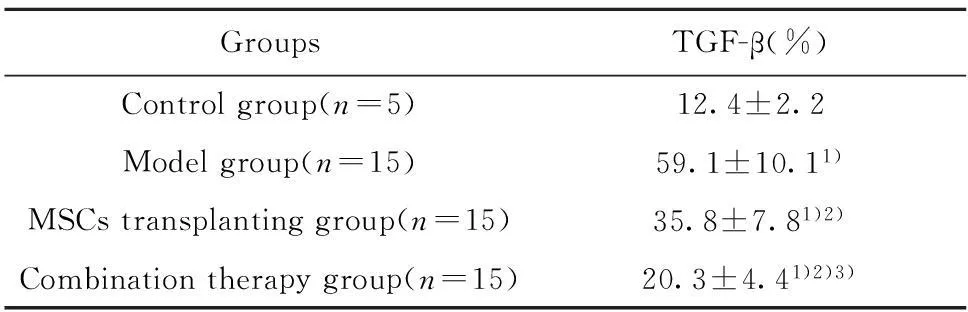
GroupsTGF-β(%)Controlgroup(n=5)12.4±2.2Modelgroup(n=15)59.1±10.11)MSCstransplantinggroup(n=15)35.8±7.81)2)Combinationtherapygroup(n=15)20.3±4.41)2)3)
Note:Compared with control groups,1)P<0.05;compared with model group,2)P<0.05;compared with MSCs transplanting group,3)P<0.05.
IL-10 作为一种负性免疫调节因子,其拮抗肝纤维化的作用已不断得到证实[13,14],IL-10可通过以下几个方面起到抗纤维化的作用:首先,抑制肝星状细胞(Hepatic stellate cells,HSCs)的激活,这可能与其可下调炎症细胞免疫反应及TGF-β、TNF-α和TIMPs等这些HSCs的刺激因子有关,从而减轻肝脏纤维化程度[15,16];其次,抑制细胞外基质的合成及促进其降解[17,18],亦显示出 IL-10 抗肝纤维化的作用。因此本实验创造性地将IL-10与MSCs相结合,观察其对CCl4诱导的大鼠肝纤维化模型治疗的协同效应。研究结果显示,脐带间充质干细胞单独或与IL-10联合均可明显改善CCl4导致的大鼠肝纤维化,这主要体现在组织病理明显改善,且与IL-10联合治疗组大鼠肝脏更接近与正常肝组织;肝功能检测、肝纤维化指标都有明显好转,且与IL-10联合治疗效果更佳。
肝纤维化(Hepatic fibrosis,HF)是多种致病因子作用于反细胞引起肝细胞变性坏死后的共同病理基础,是肝脏细胞外基质(ECM)合成与分解失衡,细胞外基质过度沉积的结果。众多的研究证实,肝星状细胞的激活是HF的中心环节[19-21]。肝脏细胞受到各种损伤因子的刺激,Kupffer 细胞、肝细胞等释放 PDGF 及 TGF-β等多种细胞因子激活 HSC,激活的 HSCs合成大量的细胞外基质(Extracellular matrix,ECM),并抑制胶原降解。
TGF-β是众多细胞因子中致纤维化最强的细胞因子,TGF-β主要通过自分泌和旁分泌方式参与HSCs的活化,从而造成ECM的沉积,因此肝组织中TGF-β蛋白的表达可反映慢性肝纤维化中组织炎症坏死及纤维化程度。因此,本实验将TGF-β蛋白的表达作为考量MSCs和IL-10抗纤维化作用的分子指标之一。研究结果显示,细胞移植组、联合治疗组TGF-β蛋白的表达较损伤组均有不同程度的降低,联合治疗组与细胞移植组比较TGF-β蛋白的表达也有显著降低。说明MSCs和IL-10联合治疗更能阻碍HSCs的活化,减少ECM的沉积,抗纤维化效果更佳。
MMP-2 是明胶酶类的代表,主要降解Ⅳ、Ⅴ、Ⅶ、Ⅹ型胶原和弹性蛋白、纤维连接蛋白。Ⅳ型胶原是构成基底膜的主要成份,MMP-2 合成增多、活性增强,可降解 Disse 间隙的基底膜,破坏肝小叶的正常结构,并且激活窦周细胞,包括HSC,进一步促进肝纤维化的发生。因此本实验将MMP-2作为考量MSCs和IL-10抗纤维化作用的另一个分子指标。结果显示损伤组、细胞移植组MMP-2 mRNA明显增高,明显高于正常对照组,联合治疗组MMP-2 mRNA表达增高,与正常对照组比较无显著性差异。提示联合治疗可通过下调MMP-2基因的表达保护肝小叶的正常结构。
综上所述,IL-10联合间充质干细胞移植可在一定程度上修复受损的肝组织,这为众多肝纤维化甚至肝硬化患者带来了希望。但其逆转肝纤维化的分子机制很多,一些尚不完全清楚,另外,要获取间充质干细胞移植的长期生存率、长期不良反应等信息都有待今后开展大规模临床双盲试验。但我们相信随着这些难题的解决细胞因子联合间充质干细胞移植有望成为治疗肝纤维化的理想方法。
参考文献:
[1]牛铁兵,陈玉丙,张立新.骨髓间充质干细胞移植对大鼠肝纤维化模型的修复作用[J].吉林大学学报(医学版),2009,35(5):874-877.
[2]Kadota Y,Yagi H,Inomata K,etal.Mesenchymal stem cells support hepatocyte function in engineered liver grafts[J].Organogenesis,2014,10(2):268-277.
[3]Nagaishi K,Ataka K,Echizen E,etal.Mesenchymal stem cell therapy ameliorates diabetic hepatocyte damage in mice by inhibiting infiltration of bone marrow-derived cells[J].Hepatology,2014,59(5):1816-1829.
[4]Esrefoglu M.Role of stem cells in repair of liver injury:experimental and clinical benefit of transferred stem cells on liver failure[J].World J Gastroenterol,2013,19(40):6757-6773.
[5]Salomone F,Barbagallo I,Puzzo L,etal.Efficacy of adipose tissue-mesenchymal stem cell transplantation in rats with aceta minophen liver injury[J].Stem Cell Res,2013,11(3):1037-1044.
[6]Caplan AI,Dennis JE.Mesenchymal stem cells as trophic mediators[J].J Cell Biochem,2006,98(5):1076-1084.
[7]Parekkadan B,van Poll D,Suganuma K,etal.Mesenchymal stem cell-derived molecules reverse ful minant hepatic failure[J].PLoS One,2007,2(9):e941.
[8]Sakaida I,Terai S,Yamamoto N,etal.Transplantation of bone marrow cells reduces CCl4-induced liver fibrosis in mice[J].Hepatology,2004,40(6):1304-1311.
[9]Cho KA,Lim GW,Joo SY,etal.Transplantation of bone marrow cells reduces CCl4-induced liver fibrosis in mice[J].Liver int,2011,31(7):932-939.
[10]Fang B,Shi M,Liao L,etal.Systemic infusion of FLK1+ mesenchymal stem cells ameliorates carbon tetrachloride-induced liver fibrosis in mice[J].Transplantation,2004,78(1):83-88.
[11]Popp FC,Slowik P,Eggenhofer E,etal.No contribution of multipotent mesenchymal stromal cells to liver regeneration in a rat model of prolonged hepatic injury[J].Stem Cells,2007,25(3):639-645.
[12]Di Bonzo LV,Ferrero I,Cravanzola C,etal.Human mesenchymal stem cells as a two-edged sword in hepatic regenerative medicine:engraftment and hepatocyte differentiation versus profibrogenic potential[J].Gut,2008,57(2):223-231.
[13]涂云忠,张坚,刘慧萍,等.白细胞介素10基因修饰的骨髓间充质干细胞抑制大鼠肝纤维化形成的实验研究[J].中华肝脏病杂志,2012,20(12):908-911.
[14]Chen YX,Huang YH,Zheng WD,etal.Interleukin-10 gene modification attenuates hepatocyte activation of rat hepatic stellate cells in vitro[J].Mol Med Rep,2013,7(2):371-378.
[15]王小众,张莉娟.IL-10抗肝纤维化的实验研究结果及临床现状[J].世界华人消化杂志,2007,15(23):2469-2472.
[16]吴玉婧,郭津律.肝星状细胞、Toll样受体4信号途径、炎症及纤维化环境与原发性肝癌发生发展的关系[J].临床肝胆病杂志,2015,31(6):876-879.
[17]Seki E,Brenner DA.Recent advancement of molecular mechanisms of liver fibrosis[J].J Hepatobiliary Pancreat Sci,2015,22(7):512-518.
[18]Zhang LJ,Yu JP,Li D,etal.Effects of cytokines on carbon tetrachloride-induced hepatic fibrogenesis in rats[J].World J Gastroenterol,2004,10(1):77-81.
[19]Friedman SL,Roll FJ,Boyles J,etal.Hepatic lipocytes;the principal collagen-producing cells of normal rat liver[J].Proc Natl Acad Sci USA,1985,82(24):8681-8685.
[20]Weiskirchen R,Tacke F.Cellular and molecular functions of hepatic stellate cells in inflammatory responses and liver immunology[J].Hepatobiliary Surg Nutr,2014,3(6):344-363.
[21]Brandau DF,Ramalhu LN,Ramalho FS,etal. Liver cirrhosis and hepatic stellate cells[J].Acta Cir Bras,2006,21(1):54-57.
[收稿2015-05-25修回2015-07-07]
(编辑倪鹏)
[关键词]脐带源间充质干细胞;白细胞介素10;肝纤维化;细胞移植
Treatment of experimental hepatic fibrosis in rats by transplanting with mesenchymal stem cells derived from human umbilical cord and Interleukin-10
ZHANGYing-Jie,YULi,HAOXiao-Na,HAOYan-Mei,LIYu-Yun.LaboratoryDepartmentofBengbuMedicalCollege,Bengbu233030,China
[Abstract]Objective:To observe the conditions of isolation,purification and culture of mesenchymal stem cells(MSCs) in vitro derived from human umbilical cord,and to observe the repairing effect on experimental hepatic fibrosis in rats by transplantation with MSCs only or MSCs with IL-10.Methods: The MSCs derived from human umbilical cord were isolated,purified and cultivated in vitro.The model of hepatic fibrosis induced by CCl4was established.After the model of hepatic fibrosis was succeeded,the rats were divided into three groups:model group,MSCs transplantation group,MSCs transplantation with IL-10 group.MSCs transplantation group was given 1×106MSCs by the tail vein injection at the first 1 weeks,2 weeks and 3 weeks.MSCs transplantation with IL-10 group not only was given MSCs the same with MSCs transplantation group,but also was injected of IL-10(4 μg/kg)in abdomen,4 times a week.After 4 weeks,the rats were executed,rats blood was collected to observe the changes of liver function and the index of liver fibrosis.The liver HE staining was carried out to observe the changes of liver pathology.Expression of MMP-2 mRNA was detected by RT-PCR method,expression of TGF-β protein was detected by Western blot method.Results: The rat liver function and the index of liver fibrosis improved obviously with a significant difference between model group ,MSCs transplantation group and MSCs transplantation with IL-10 group after transplanting,MSCs with IL-10 was better than MSCs only.Liver tissue of rats with hematoxylin eosin staining suggested,liver fibrosis was obviously improved,and the MSCs transplantation with IL-10 group was best.MMP-2 mRNA expression was significantly higher between normal group and model group,MSCs transplantation group with a significant difference (P<0.05),MMP-2 mRNA expression was higher with a no significant difference between model group and MSCs transplantation with IL-10 group(P>0.05).TGF-β protein expression of other groups was higher than normal group with a significant (P<0.05),and MSCs transplantation with IL-10 group was the largest decrease than normal group.Conclusion: MSCs only or MSCs with IL-10 transplantation can improve the biochemical characteristics of rat peripheral blood and liver histological structure,and with IL-10 wan better than MSCs only.MSCs and IL-10 play a role in the treatment of liver fibrosis through lowering the expression of MMP-2 and the expression of TGF-β protein.
[Key words]Mesenchymal stem cells;IL-10;Hepatic fibrosis;Transplantation
通讯作者及指导教师:李玉云(1964年-),女,副教授,主要从事间充质干细胞的相关研究。
作者简介:张英杰(1979年-),男,硕士,讲师,主要从事间充质干细胞的相关研究。
中图分类号R318
①本文受安徽省教育厅重点项目(No.KJ2012A198)基金资助。
文献标志码A
文章编号1000-484X(2016)01-0023-06
doi:10.3969/j.issn.1000-484X.2016.01.005
