沙眼衣原体pORF5质粒蛋白免疫优势片段的筛选与鉴定①
2016-02-24何战胜粟胜梅雷文波李忠玉
何战胜 邹 燕 粟胜梅 雷文波 李忠玉
(南华大学医学院病原生物学研究所/特殊病原体防控湖南省重点实验室,衡阳421001)
沙眼衣原体pORF5质粒蛋白免疫优势片段的筛选与鉴定①
何战胜邹燕②粟胜梅雷文波李忠玉
(南华大学医学院病原生物学研究所/特殊病原体防控湖南省重点实验室,衡阳421001)
[摘要]目的:鉴定沙眼衣原体pORF5质粒蛋白的免疫原性,并进一步筛选和确定pORF5质粒蛋白免疫优势片段。方法:以沙眼衣原体D血清型DNA为模板,设计pORF5基因全长和9个不同片段特异引物进行PCR扩增,PCR产物经BamHⅠ、NotⅠ双酶切后插入经同样双酶切的原核表达载体pGEX-6p中,构建pORF5质粒蛋白不同长度片段的原核表达重组体,重组体经PCR和测序鉴定后,转化XL1 Blue大肠杆菌表达10种不同长度的GST融合蛋白;ELISA方法检测pORF5质粒蛋白的免疫原性,Western blot 鉴定pORF5质粒蛋白的免疫反应性;ELISA测定10个不同片段与沙眼衣原体生殖道感染患者血清、鼠免疫血清以及抗pORF5单克隆抗体的免疫反应性,鉴定pORF5质粒蛋白免疫优势片段。结果:pORF5质粒蛋白免疫原性强,能刺激机体产生高效价抗体;破坏pORF5质粒蛋白天然空间结构,其免疫反应性基本消失;在ELISA反应中,N端缺失66氨基酸的F6片段的免疫反应强度与pORF5全长基本相似,F2与F3出现较弱的免疫反应,其余片段免疫反应消失。结论:pORF5质粒蛋白为构象依赖性免疫优势抗原,其免疫优势表位和构象表位位于C端,本研究为进一步探讨pORF5质粒蛋白的生物学功能和疫苗的研制提供实验依据。
沙眼衣原体(Chlamydia trachomatis,Ct)泌尿生殖道感染是一种严重危害公众健康的细菌性感染疾病。自上世纪九十年代以来,Ct已超过淋球菌而成为泌尿生殖道感染性疾病的主要性病病原体。Ct生殖道感染不仅引起女性盆腔炎、不孕和异位妊娠等,也可引起男性尿道炎、附睾炎、睾丸炎和前列腺炎等[1],同时Ct还可增加HIV[2,3]及宫颈癌[4-6]的发病率。由于Ct感染临床症状不明显,致使该疾病不易被发现而得不到及时治疗,造成Ct在宿主体内持续存在引起严重并发症。因此,阐明Ct致病机制,寻找免疫优势抗原研制出有效疫苗,是预防和控制Ct感染性疾病的关键。
Ct 共有A~L 19个血清型,每个血清型几乎均存在一种约7.5 kb大小的隐蔽性质粒,该质粒共有8个开放阅读框架(Open reading frame,ORF),编码8种质粒蛋白。在8种质粒蛋白中,pORF5是唯一一种分泌性质粒蛋白[7]。在自然感染状态下,pORF5质粒蛋白基因均被激活产生内源性靶蛋白。有研究发现Ct患者血清中存在高滴度的特异性的pORF5抗体,提示pORF5可能为免疫优势抗原[8,9]。为进一步鉴定pORF5质粒蛋白的免疫原性,筛选和确定pORF5质粒蛋白免疫优势片段,本研究采用基因重组技术构建Ct质粒蛋白pORF5全长和9个不同长度的原核表达重组体,将重组质粒转化宿主菌XL1 Blue,并对表达的蛋白进行免疫原性研究,本研究为Ct基因工程疫苗和免疫诊断试剂的研制提供实验依据。
1材料与方法
1.1主要材料Ct D标准株、XL1-Blue大肠杆菌和pGEX-6p原核表达载体为本研究所保存;限制性内切酶BamHⅠ、NotⅠ、pfxDNA聚合酶、蛋白分子量标准等为Invitrogen公司产品;QuickClean PCR 纯化试剂盒、质粒提取试剂盒购自美国Qiagen公司;Glutathione Sepharose 4B Beads为Phatnacia 公司产品。
1.2pORF5不同片段基因克隆及原表达重组体的构建根据GenBank提供的Ct pORF5基因序列设计10对引物(表1),并在各对引物的5′加上BamH Ⅰ酶、Not Ⅰ酶切位点及保护碱基。PCR方法扩增pORF5基因全长(FL)和9个不同长度的pORF5基因片段(F1~F9),PCR产物经BamHⅠ、NotⅠ酶切后,连接至经相同酶消化后的pGEX-6p载体中,构建pGEX-6p/pORF5-FL、F1~F9原核表达重组体,重组体转化感受态大肠杆菌XL1 Blue,在含氨苄青霉素的LB培养基上挑取单个菌落,小量提取质粒,PCR筛选和DNA测序鉴定。
表1pORF5基因不同片段引物
Tab.1Primers for different fragments of pORF5 gene

Name(Length)PrimersequencesFL(M1-A264)5'-CGC-G▼GATCC-ATGGGAAATTCTGGTTTTTATTTG-3'5'-TTTTCCTTTT-GC▼GGCCGC-TTAAGCGTTTGTTTGAGGTATTA-3'F1(M1-S66)5'-CGC-G▼GATCC-ATGGGAAATTCTGGTTTTTATTTG-3'5'-TTTTCCTTTT-GC▼GGCCGC-TTAAGAAGCATTGGTTGATGAATT-3'F2(M1-N132)5'-CGC-G▼GATCC-ATGGGAAATTCTGGTTTTTATTTG-3'5'-TTTTCCTTTT-GC▼GGCCGC-TTAGTTGCATTGAATTTTATTAGTG-3'F3(M1-S198)5'-CGC-G▼GATCC-ATGGGAAATTCTGGTTTTTATTTG-3'5'-TTTTCCTTTT-GC▼GGCCGC-TTATGAGTATCCATAACTAATCG-3'F4(I67-N132)5'-CGC-G▼GATCC-ATTACAATTGGTTTGGTAGCGG-3'5'-TTTTCCTTTT-GC▼GGCCGC-TTAGTTGCATTGATTTTATTAGTG-3'F5(I67-S198)5'-CGC-G▼GATCC-ATTACAATTGGTTTGGTAGCGG-3'5'-TTTTCCTTTT-GC▼GGCCGC-TTATGAGTATCCATAACTAATCG-3'F6(I67-A264)5'-CGC-G▼GATCC-ATTACAATTGGTTTGGTAGCGG-3'5'-TTTTCCTTTT-GC▼GGCCGC-TTAAGCGTTTGTTTGAGGTATTA-3'F7(G133-S198)5'-CGC-G▼GATCC-GGGTTATTCACTCCCAGTAAC-3'5'-TTTTCCTTTT-GC▼GGCCGC-TTATGAGTATCCATAACTAATCG-3'F8(G133-A264)5'-CGC-G▼GATCC-GGGTTATTCACTCCCAGTAAC-3'5'-TTTTCCTTTT-GC▼GGCCGC-TTAAGCGTTTGTTTGAGGTATTA-3'F9(S199-A264)5'-CGC-G▼GATCC-TCAGGCATTCCTAATTTATGTAG-3'5'-TTTTCCTTTT-GC▼GGCCGC-TTAAGCGTTTGTTTGAGGTATTA-3'
1.3pORF5不同长度融合蛋白的表达与纯化将鉴定后的阳性克隆接种于含100 μg/ml氨苄的LB培养液中,37℃震荡培养过夜。次日将过夜培养物以1∶100的比例加入含氨苄的LB培养液中,37℃震荡培养至OD600约为0.8时,加入终浓度为0.2 mmol/L的IPTG,30℃诱导3 h后低速离心收集细菌,超声破菌后高速离心收集上清,上清经Glutathione Sepharose 4B Beads纯化得到pORF5不同长度的融合蛋白(FL、F1~F9),纯化的融合蛋白经12% SDS-PAGE电泳分析,观察其表达情况和纯化效果。
1.4pORF5免疫原性分析将pORF5、CPAF(衣原体蛋白酶样活性因子)、HSP60(热休克蛋白60)、MOMP(主要外膜蛋白)融合蛋白进行1∶10稀释后加入谷胱苷肽包被的酶标板,同时设置GST和空白对照孔,4℃过夜后,0.05%PBST洗涤酶标板以除去未吸附的游离的蛋白抗原;加入2.5%脱脂牛奶室温封闭1 h,再加入经含GST的大肠杆菌裂解液吸附后的Ct泌尿生殖道感染患者血清,室温静置2 h,PBST洗涤后加入1∶2 000稀释的HRP标记的抗人二抗,室温2 h;最后加入ABTS显色剂,室温避光反应5~10 min后,2 mmol/L H2SO4终止反应,酶标仪读取450nm波长的A值,当(实验组A450值-空白组A450值)/(对照组A450值-空白组A450值)≥2.1时为阳性。同时以pORF5、CPAF、HSP60融合蛋白为抗原,以不同稀释的Ct泌尿生殖道感染患者血清为一抗、HRP标记的羊抗人IgG为二抗,Western blot 分析pORF5质粒蛋白的免疫反应性。
1.5pORF5免疫优势片段分析将所制备的pORF5 F1~F9融合蛋白及pORF5蛋白全长作为ELISA反应抗原,与酶标板已包被的谷胱苷肽4℃结合过夜,2.5%脱脂牛奶封闭后,分别加入Ct泌尿生殖道感染患者血清、鼠抗GST-pORF5多克隆抗体(pAb)和pORF5 单克隆抗体(mAb)2p和4e6,抗原抗体充分反应后,再分别加入HRP标记的抗鼠、抗人抗体,最后加入显色剂,酶标仪读取405nm吸收值,分析pORF5蛋白各个片段的免疫反应性。
2结果
2.1pGEX-6p/pORF5-FL与pGEX-6p/pORF5 F1~F9重组质粒的构建和鉴定以Ct D血清型DNA为模版,应用10对特异性引物对pORF5不同长度基因片段进行扩增,结果扩增出了特异性目的基因片段,与预期目的基因片段大小相符(图1)。pGEX-6p/pORF5-FL及pGEX-6p/pORF5 F1~F9重组质粒经BamHⅠ和NotⅠ双酶切后,可切出2个片段,小片段与各目的片段基因大小一致,大片段约4.9 kb,与空质粒大小一致(图2)。重组质粒测序结果显示各基因片段与GenBank登陆的D型Ct pORF5质粒碱基序列完全一致。
2.2pORF5各基因片段融合蛋白的表达将pORF5全长和9个不同片段的重组质粒转化E.coli XL1Blue,IPTG诱导表达10个融合蛋白,Glutathione Sepharose 4B beads 纯化融合蛋白,纯化的蛋白经SDS-PAGE电泳分析,发现重组质粒菌在各自相应的位置有一明显蛋白条带,结果与预期各融合蛋白分子量相符(图3)。
2.3pORF5 免疫原性分析ELISA结果显示,pORF5与病人血清出现了强烈的免疫反应,病人血清中存在高滴度pORF5抗体,与传统的衣原体免疫优势抗原比较,pORF5 与CPAF免疫原性基本相似,但略高于MOMP、HSP60抗原(图4)。在Western blot分析pORF5免疫特性时,发现病人血清进行1∶4 000稀释后,pORF5出现较弱的反应条带,而CPAF、MOMP和HSP60出现强阳性反应条带,病人血清做1∶20 000稀释时,pORF5反应带消失,而CPAF、MOMP和HSP60蛋白仍可见明显的条带(图5)。

图1 Ct pORF5质粒基因不同片段PCR扩增产物Fig.1 PCR products of different fragments of pORF5 plasmid gene from Chlamydia trachomatisNote: 1.DNA marker;2.PCR product of pORF5 gene;3.PCR product of pORF5 F1 fragment;4.PCR product of pORF5 F2 fragment;5.PCR product of pORF5 F3 fragment;6.PCR product of pORF5 F4 fragment;7.PCR product of pORF5 F5 fragment;8.PCR product of pORF5 F6 fragment;9.PCR product of pORF5 F7 fragment;10.PCR product of pORF5 F8 fragment;11.PCR product of pORF5 F9 fragment.
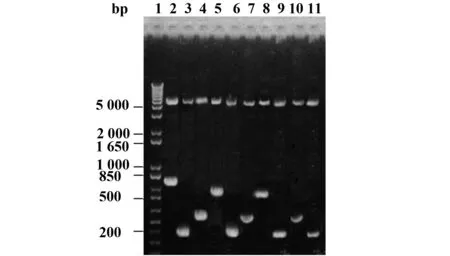
图2 pGEX-6p/pORF5-FL及pGEX-6p/pORF5 F1~F9重组质粒双酶切鉴定Fig.2 Identification of pGEX-6p/pORF5-FL and pGEX-6p/pORF5 F1-F9 recombinant plasmids by double digestionNote: 1.DNA marker;2.pGEX-6p/pORF5-FL recombinant plasmid digested with BamHⅠand NotⅠ;3.pGEX-6p/pORF5-F1 recombinant plasmid digested with BamHⅠand NotⅠ;4.pGEX-6p/pORF5-F2 recombinant plasmid digested with BamHⅠand NotⅠ;5.pGEX-6p/pORF5-F3 recombinant plasmid digested with BamHⅠand NotⅠ;6.pGEX-6p/pORF5-F4 recombinant plasmid digested with BamHⅠand NotⅠ;7.pGEX-6p/pORF5-F5 recombinant plasmid digested with BamHⅠand NotⅠ;8.pGEX-6p/pORF5-F6 recombinant plasmid digested with BamHⅠand NotⅠ;9.pGEX-6p/pORF5-F7 recombinant plasmid digested with BamHⅠand NotⅠ;10.pGEX-6p/pORF5-F8 recombinant plasmid digested with BamHⅠand NotⅠ;11.pGEX-6p/pORF5-F9 recombinant plasmid digested with BamHⅠand NotⅠ.

图3 纯化pORF5不同片段的SDS-PAGE分析Fig.3 SDS-PAGE analysis of purified pORF5 diff-erent fragmentsNote: 1.Protein marker;2.Purified pORF5 full length;3.Purified pORF5 F1;4.Purified pORF5 F2;5.Purified pORF5 F3;6.Purified pORF5 F4;7.Purified pORF5 F5;8.Purified pORF5 F6;9.Purified pORF5 F7;10.Purified pORF5 F8;11.Purified pORF5 F9.
2.4pORF5质粒蛋白免疫优势片段分析为筛选pORF5质粒蛋白免疫优势片段,将pORF5 9个不同片段分别与Ct生殖道感染患者血清、鼠抗pORF5 pAb、pORF5 mAb (2p和4e6)进行ELISA分析,结果显示:不同pORF5片段与血清反应强度不一,相同的片段在不同的血清中反应强度也不尽相同;N端缺失66氨基酸的F6片段在Ct感染患者血清ELISA反应中最为强烈,与pORF5全长反应强度基本相似,其次是F2、F3片段,F4、F7、F9反应性最弱;来源于GST-pORF5免疫小鼠产生的抗体能强烈识别F6及全长,但也能识别其他各个片段。pORF5 mAb 2p和4e6 ELISA反应模式相同,只识别F6及全长(图6)。

图4 ELISA 方法分析pORF5质粒蛋白免疫原性Fig.4 Immunogenic analysis of pORF5 plasmid protein by ELISA method

图6 pORF5质粒蛋白免疫优势片段分析Fig.6 Analysis of immunodominant fragment of pORF5 plasmid protein
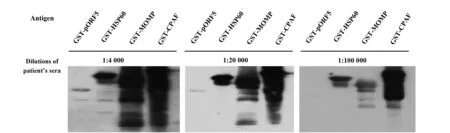
图5 Western blot 分析pORF5质粒蛋白免疫原性Fig.5 Immunogenic analysis of pORF5 plasmid protein by Western blot
3讨论
Ct除含有约1 Mb的基因组外,各血清型中亦存在一种隐蔽性质粒,质粒不是衣原体生存所必需的,但质粒缺失后,衣原体毒力高度降低,不能上行引起生殖道的病变[10-12],提示质粒与衣原体毒力密切相关。在质粒编码的8种质粒蛋白中,pORF5是唯一一种分布于宿主细胞胞浆的分泌性质粒蛋白,该蛋白在Ct感染12 h后可在感染细胞胞浆中检测其表达,随着时间的延长,表达量逐渐增加,直至维持到整个细胞发育周期[7]。已有研究证实pORF5可通过诱生炎症因子、拮抗LL37抗菌肽活性等多种机制参与衣原体的致病过程[13-17]。
pORF5质粒蛋白由264氨基酸编码,生物信息学分析该蛋白缺乏信号肽序列,具有多个亲水性区域,提示可能存在多个抗原表位。Donati等研究发现衣原体感染的患者血清中存在高滴度的特异性抗体[8,9],为探讨pORF5质粒蛋白的免疫原性,本研究采用基因重组技术构建Ct质粒蛋白pORF5原核表达重组体,将重组质粒转化宿主菌XL1 Blue,经IPTG诱导以及Glutathione Sepharose 4B Beads纯化后制备了pORF5融合蛋白。采用ELISA方法检测Ct泌尿生殖道感染患者血清中抗体的滴度,结果发现pORF5抗原与患者血清出现强烈的阳性免疫反应,其免疫反应要高于经典的Ct免疫优势抗原MOMP、HSP60,与CPAF基本相似; pORF5不仅与全部患者血清发生反应,而且刺激机体产生抗体的效价最高,提示pORF5可作为一种新的衣原体免疫诊断试剂,有望应用于Ct感染的实验室诊断,同时pORF5亦作为一种新的免疫优势抗原,可为衣原体疫苗的研制提供一个新的潜在靶抗原。
虽然pORF5 与患者的血清在ELISA反应中出现了强烈的免疫反应,但是当用相同的抗原与抗体进行Western blot 分析时,却显示出较弱的免疫反应,其反应强度远低于MOMP、HSP60和CPAF,其原因可能是在进行Western blot 分析时,抗原需要经过加热及SDS作用,破坏了pORF5的天然空间构象,而蛋白质的一级、二级、三级和四级结构决定了它的物理、化学、生物化学、物理化学和生物学性质,空间构象改变,影响抗原与抗体的结合。提示pORF5存在构象依赖性表位,pORF5是一种构象依赖性免疫优势抗原。
为进一步筛选和确定pORF5抗原免疫优势片段,我们将pORF5抗原分成9个片段,在pORF5 9个片段与Ct生殖道感染患者血清、pORF5多克隆抗体、pORF5单克隆抗体的反应中,发现不同pORF5片段与血清反应强度不一,相同的片段在不同的血清中反应强度也不尽相同;N端缺失66氨基酸的F6片段在Ct感染患者血清ELISA反应中最为强烈,与pORF5全长反应强度基本相似,其次是F2、F3片段,F4、F7、F9反应性最弱;来源于GST-pORF5免疫小鼠产生的抗体能强烈识别F6及全长,但也能识别其他各个片段,提示pORF5 9个片段都具有免疫原性。但当去除F6蛋白N端或C端66个氨基酸时,其免疫反应性大大的减弱,说明了pORF5 抗原优势表位主要位于C端。
本实验证实pORF5质粒蛋白为Ct免疫优势抗原,在自然感染状态下,pORF5质粒蛋白可诱导机体产生高滴度抗体,具有强烈的免疫原性,其免疫优势表位位于C端;同时pORF5质粒蛋白具有强烈的免疫反应性,pORF5质粒蛋白对抗体的识别呈高度的构像依赖性,证实pORF5质粒蛋白是一种构象依赖性免疫优势抗原。本研究为进一步阐明Ct pORF5质粒蛋白的功能,Ct基因工程疫苗和免疫诊断试剂的研制提供实验依据。
参考文献:
[1]Gallegos G,Ramos B,Santiso R,etal.Sperm DNA fragmentation in infertile men with genitourinary infection by Chlamydia trachomatis and Mycoplasma[J].Fertil Steril,2008,90(2):328-334.
[2]Schust DJ,Ibana JA,Buckner LR,etal.Potential mechanisms for increased HIV-1 transmission across the endocervical epithelium during C.trachomatis infection[J].Curr HIV Res,2012,10(3):218-227.
[3]Sperling R,Kraus TA,Ding J,etal.Differential profiles of immune mediators and in vitro HIV infectivity between endocervical and vaginal secretions from women with Chlamydia trachomatis infection:a pilot study[J].J Reprod Immunol,2013,99(1/2):80-87.
[4]Seraceni S,De Seta F,Colli C,etal. High prevalence of hpv multiple genotypes in women with persistent chlamydia trachomatis infection [J]. Infect Agent Cancer,2014,9:30.
[5]Deluca GD,Basiletti J,Schelover E,etal.Chlamydia trachomatis as a probable cofactor in human papillomavirus infection in aboriginal women from northeastern Argentina[J].Braz J Infect Dis,2012,15(6):567-572.
[6]Bellaminutti S,Seraceni S,De Seta F,etal.HPV and chlamydia trachomatis co-detection in young asymptomatic women from high incidence area for cervical cancer[J].J Med Virol,2014,86(11):1920-1925.
[7]Li Z,Chen D,Zhong Y,etal.The chlamydial plasmid-encoded protein pgp3 is secreted into the cytosol of Chlamydia-infected cells[J].Infect Immun,2008,76(8):3415-3428.
[8]Donati M,Laroucau K,Storni E,etal.Serological response to pgp3 protein in animal and human chlamydial infections[J].Vet Microbiol,2009,135(1/2):181-185.
[9]Horner P,Soldan K,Vieira SM,etal.C.trachomatis Pgp3 antibody prevalence in young women in England,1993-2010[J].PLoS One,2013,8(8):e72001.
[10]O′connell CM,Ingalls RR,Andrews CW,etal.Plasmid-deficient Chlamydia muridarum fail to induce immune pathology and protect against oviduct disease[J].J Immunol,2007,179(6):4027-4034.
[11]Frazer LC,Darville T,Chandra-Kuntal K,etal.Plasmid-cured Chlamydia caviae activates TLR2-dependent signaling and retains virulence in the Guinea pig model of genital tract infection[J].PLoS One,2012,7(1):e30747.
[12]O′connell CM,Abdelrahman YM,Green E,etal.Toll-like receptor 2 activation by Chlamydia trachomatis is plasmid dependent,and plasmid-responsive chromosomal loci are coordinately regulated in response to glucose limitation by C.trachomatis but not by C.muridarum[J].Infect Immun,2011,79(3):1044-1056.
[13]邓红玉,李忠玉,吴移谋,等.沙眼衣原体pORF5质粒蛋白诱发小鼠生殖道免疫损伤初步研究[J].中华微生物学和免疫学杂志,2013,33(2):107-111.
[14]Zhou H,Huang Q,Li Z,etal.PORF5 plasmid protein of Chlamydia trachomatis induces MAPK-mediated pro-inflammatory cytokines via TLR2 activation in THP-1 cells[J].Sci China Life Sci,2013,56(5):460-466.
[15]Liu Y,Huang Y,Yang Z,etal.Plasmid-encoded Pgp3 is a major virulence factor for Chlamydia muridarum to induce hydrosalpinx in mice[J].Infect Immun,2014,82(12):5327-5335.
[16]马康康,李忠玉,粟盛梅,等.pORF5质粒蛋白拮抗LL37抗菌肽增强沙眼衣原体感染的初步研究[J].中华皮肤科杂志,2014,47(10):703-707.
[17]曹文娟,戴文婷,杨晓玉,等.沙眼衣原体pORF5质粒蛋白激活NALP3炎性复合体诱导THP-细胞产生IL-1β和IL-18[J].中国免疫学杂志,2015,31(5):590-594.
[收稿2015-07-10修回2015-08-17]
(编辑张晓舟)
[关键词]沙眼衣原体;pORF5质粒蛋白;免疫原性;免疫优势表位
Screen and identification of immunodominant fragment of pORF5 plasmid protein from Chlamydia trachomatis
HEZhan-Sheng,ZOUYan,SUSheng-Mei,LEIWen-Bo,LIZhong-Yu.PathogenicBiologyInstitute,SchoolofMedicine,UniversityofSouthChina/HunanProvincialKeyLaboratoryforSpecialPathogensPreventionandControl,Hengyang421001,China
[Abstract]Objective:To investigate the immunogenicity of pORF5 plasmid protein,and further to screen and identify its immunodominant domian.Methods: 10 different fragments of pORF5 gene including full length were amplified from the DNA of Chlamydia trachomatis serovar D by PCR and cloned into appropriate site of pGEX-6p vector to construct recombinant vectors after digested with BamHⅠ and NotⅠ restriction endonucleases.After identification by PCR and sequencing,the recombinant plasmids were transformed into XL1 Blue E.coli to express the GST fusion proteins.ELISA and Western blot were carried out to identify the immunogenicity and immunoreaction of pORF5 plasmid protein.10 different fragments were reacted with sera from patients urogenitally infected with Chlamydia trachomatis,mouse polyclonal antibodies and mouse monoclonal antibodies of pORF5 plasmid protein with ELISA method.Results: pORF5 plasmid protein displayed strong immunogenicity and could induce a strong antibody response in human.The reactivity of human antibodies almost completely disappeared,when the native structure of pORF5 plasmid protein was destroyed.F6 that only lacked the N-terminal 66 amino acids was recognized by antibodies in ELISA as strongly as the whole pORF5 plasmid protein was.However,no other fragments were significantly recognized although there was a minimal reactivity of F2 and F3 with antibodies.Conclusion: pORF5 plasmid protein was an immunodominant antigen containing conformation-dependent epitope,and the C-terminal three quarters of pORF5 amino acid sequence was required for maintaining its immune dominance and conformation.The significance of the above findings lay a foundation for the further study on pORF5 protein function and vaccine development.
[Key words]Chlamydia trachomatis;pORF5 plasmid protein;Immunogenicity;Immunodominant epitope
通讯作者及指导教师:李忠玉(1972年-),女,教授,主要从事衣原体致病机制与防治研究,E-mail:lzhy1023@hotmail.com。
作者简介:何战胜(1971年-),女,主要从事病原体致病机制研究,E-mail:2241332533@qq.com。
中图分类号R374+1
①本文为国家自然科学基金(No.81102230、No.31470277)、湖南省高校创新平台开放基金(13K081)、湖南省重点研发计划(2015JC3087)、湖南省高层次卫生人才“225”工程培养项目(2013-13)、湖南省普通高校带头人培养项目(2014-186)、特殊病原体防控湖南省重点实验室(2014-5)和湖南省高等学校“分子靶标新药研究”协同创新中心(2014-405)资助项目。
②共同第一作者。
文献标志码A
文章编号1000-484X(2016)01-0059-06
doi:10.3969/j.issn.1000-484X.2016.01.013
·免疫学技术与方法·
