野古草居群光合作用对光强和CO2浓度的响应特征
2016-02-23刘英白龙雷家军
刘英,白龙,雷家军
(沈阳农业大学园艺学院,辽宁 沈阳110866)
野古草居群光合作用对光强和CO2浓度的响应特征
刘英,白龙,雷家军*
(沈阳农业大学园艺学院,辽宁 沈阳110866)
摘要:以移植于同一环境的辽宁地区4个野古草居群为对象,比较了它们的光合作用对光强和CO2浓度的响应差异,为研究其居群表型性状多样性的生理基础提供参考。结果表明,野古草光合速率对光强和CO2浓度的光合响应特征参数在居群间多数存在显著差异,居群P1(本溪)、居群P2(北镇)具较高的光饱和点(分别为1782和1690 μmol/m2·s)、表观量子效率(分别为0.0553和0.0564)及表观羧化效率(分别为0.0568和0.0783),较低的CO2补偿点(分别为14和12 μmol/mol),具有较高的光能生产潜力。居群P3(建平)、居群P4(彰武)的气孔导度低(分别为0.1227和0.1176 mol/m2·s),蒸腾速率低(分别为2.67和2.68 mmol/m2·s),持水能力强。
关键词:野古草;居群;光合速率;气孔导度;蒸腾速率
野古草(Arundinellahirta)为禾本科野古草属多年生植物。自然分布于除新疆、西藏之外的全国各地;多生于海拔2000 m以下的山坡灌丛、道旁、林缘、田地边及水沟旁;根状茎发达,适应性强,可作饲料[1],也可以作固堤防沙植物[2],或作为等高草篱防止坡耕地水土及养分流失[3-4],还可作为生物能源植物发电[5]。因其株型整齐,圆锥花序淡紫色,雅致古朴等特点,越来越多地被人们用作园林配置植物,极大地丰富了园林配置素材,增加了城市园林景观的生物多样性[6-9]。
目前,国内外对关于野古草的研究较少,武菊英等[10-11]对野古草观赏性、种子繁殖特性[12]进行了评价,袁小环等[13]筛选出了最佳的基质配方来培育野古草容器苗,以进一步推广野古草的种植。包宝祥[14]对野古草的耐旱性进行了评价。有学者对三峡库区岸生植物野古草水淹后的存活和恢复生长动态[15-16]、幼苗茎通气组织[17]、细胞色素C氧化酶和淀粉酶活性[18]等进行了研究。高志强[19]利用野古草对Sn的超量富集提取作用来修复污染的土壤和水体。Dengler等[20]对野古草叶片发育过程中叶脉的形成模式进行了研究。杨允菲等[21]对松嫩平原野古草无性系种群的营养繁殖特征进行了研究。洪锐民等[22]和谭玉莲等[23]分别利用酶电泳法、同工酶分析、SRAP标记对野古草种群的遗传变异性和种群遗传结构进行了探讨。关于野古草光合的研究较少,仅Wakayama等[24-25]对野古草叶片发育过程光合作用酶的积累过程以及光合器官的结构与酶表达的关系进行了研究;罗芳丽等[26]对野古草在水淹环境下的光合响应机制进行了研究,为阐明野古草的光合作用机理提供了一定的依据。
光合作用是植物有机物质积累、生长发育的主要源头[27],是一个极其复杂的生理过程,受植物本身生理特性和环境因素的共同影响[28],其中光照和CO2是影响光合作用进程的重要因素[29]。本课题组通过对辽宁省8个野古草野生居群的生物学特性和观赏价值进行评价,筛选出了4个观赏价值高、株型优美的居群,本文拟研究这4个野古草居群的光合生理生态学特征和规律,从而为野古草的引种驯化、人工栽培以及在园林布置中的合理利用提供理论依据,也为野古草属新品种改良和选育奠定理论基础。
1材料与方法
1.1试验设计
本试验于2012年6月在辽宁省沈阳市沈阳农业大学百草园(N 41°46′,E 123°25′)内进行。所用材料为2010年从辽宁省采集的野生材料。每个居群采集20个单株,居群内采样间隔10 m以上,居群间距离3 km以上。按单株种植,所有材料全部按照常规方式进行田间管理,材料详细信息见表1,其中居群P1具有株高中等,茎基粗壮,旗叶长而窄,小穗数量多,生物量较大等特点;居群P2、P3具有株型高大,旗叶长而宽,生物量大等特点;居群P4植株矮小,叶片短、窄,生物量小等特点。选择晴朗无云的天气,利用Li-6400便携式光合测定仪(Li-Cor,USA)于上午9:00-11:00对4个野古草居群植株抽穗期的净光合速率(Pn,μmol/m2·s)、蒸腾速率(Tr,mmol/m2·s)、气孔导度(Gs,mol/m2·s)、胞间CO2浓度(Ci,μmol/mol)等光合生理参数进行测定[30]。测定时选取从顶部数第1片完全展开叶,每居群均选择5个健壮植株重复,每株测定1次。
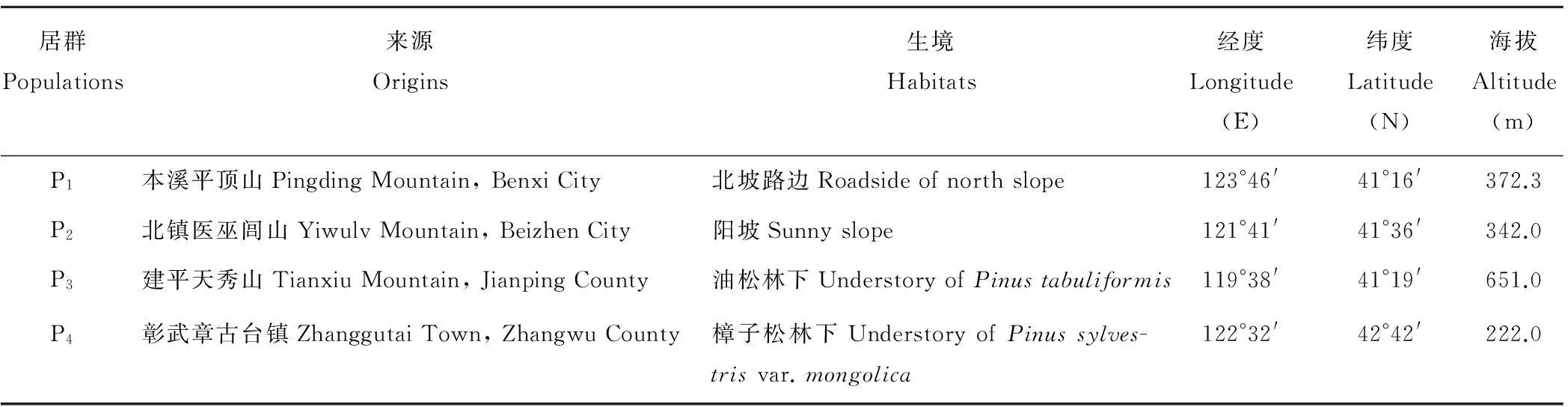
表1 本试验中野古草居群来源
1.2测定项目与方法
1.2.1光合—光强响应测定利用Li-6400内置红蓝光源提供不同的光合有效辐射强度,设定PAR由高到低依次为2000,1800,1600,1400,1200,1000,800,600,400,200,100,50,0 μmol/(m2·s),利用自动测量程序进行光合-光(Pn-PAR)响应的测定。测定期间,设定叶室温度为25℃,空气相对湿度为70%,CO2浓度为390 μmol/mol。
1.2.2光合—CO2响应测定利用Li-6400便携式光合测定仪内部温度调节器控制以小钢瓶内液态为CO2气源,设置CO2浓度由高到低依次为1200,1000,800,600,400,200,150,100,80,50,0 μmol/mol,利用自动测量程序进行光合-CO2(Pn-Ci)响应的测定。测定期间,设定叶室温度为25℃,空气相对湿度为70%,PAR为1700 μmol/(m2·s)。
1.3数据处理
光合-光响应曲线采用经典的Farquhar和Caemmerers[31]模型和线性方程进行拟合[32],模型的理论公式为:
式中,Pn为净光合速率(μmol/m2·s);Pnmax为最大净光合速率;I为光合有效辐射(PAR);α为表观量子效率(AQY);K为光响应曲线的曲角;Rday为暗呼吸速率。将PAR浓度为0~200 μmol/(m2·s)以下的Pn-Ci响应曲线进行直线回归,其斜率为表观量子效率。把直线方程与最大净光合速率与X轴平行的这两条直线相连,得出交点即为光饱和点(LSP)。
光合-CO2响应曲线拟合采用直角双曲线模式[33],模型的理论公式为:
Pn=CE·Ci·Pnmax/(CE·Ci+Pnmax)-Rp
式中,CE为植物RuBP 羧化效率;Ci为胞间CO2浓度;Pnmax为一定光强下CO2达到饱和点时的最大表观光合速率;Rp为植物的光呼吸速率。将CO2浓度为0~200 μmol/mol以下的Pn-Ci响应曲线进行直线回归,其斜率为羧化效率。
水分利用效率(WUE,water use efficiency)计算公式[34]为:WUE=Pn/Tr。式中,Tr为蒸腾速率(mmol/m2·s)。
采用Excel作图,使用SPSS 16.0对数据进行one-way ANOVA方差分析,并用Dunken法进行多重比较分析。
2结果与分析
2.1不同野古草居群光合作用对光强的响应
2.1.1光合—光响应曲线的特征从光合—光响应曲线(图1A)可知,4个野古草居群的Pn起初随着PAR的增强逐渐增大,且幅度较大而后逐渐变缓,达到光饱和点后,Pn不再随着PAR的增强而增大。居群P1、P2与居群P3、P4的Pn值分别在PAR达到1700 μmol/(m2·s)和1400 μmol/(m2·s)后呈下降趋势,表现出光抑制现象。PAR越强,居群P1、P2与居群P3、P4之间Pn的差值越大,表现出较强的光合能力,表明其光能利用率高。利用Farquhar生化模型及直线回归方程拟合光合响应参数(R2>0.96)见表2。

表2 不同野古草居群光合-光响应特征参数
注:同列不同小写字母表示差异显著(P<0.05)。测定数值用平均值±标准差表示。下同。
Note: The values in the same column followed by the different letters are significantly different atP<0.05.Value show as mean±SD. The same below.
由表2可知,居群P1、P2表观量子效率显著高于居群P3、P4(P<0.05),分别为0.0553和0.0564,说明居群P1、P2的光能利用效率高于居群P3、P4。居群P1最大净光合速率Pnmax最高,为30.14 μmol/(m2·s),居群P3最低(13.88 μmol/m2·s),居群P2(25.72 μmol/m2·s)、P4(18.97 μmol/m2·s)居中,表明居群P1光合能力最强。居群P1的光补偿点高于其他3个居群。
2.1.2气孔导度(Gs)的变化气孔是叶片获取CO2的通道,PAR增强导致Pn的增大,消耗CO2增大,叶片为弥补CO2的消耗,通过调节气孔,增大Gs来加速外界CO2向叶细胞内的扩散[30]。随着PAR的增大,4个野古草居群的Gs都呈不同程度的上升趋势(图1B)。居群P1、P2的Gs明显高于居群P3、P4,其上升幅度也较大。居群P3、P4的Gs增幅较小。在光强大于1600 μmol/(m2·s)时,除了居群P4的Gs开始降低之外,其余3个居群依然呈缓慢上升的趋势。
2.1.3蒸腾速率(Tr)和水分利用率(WUE)的变化Tr的强弱是植物水分代谢的一个重要生理指标[30]。4个野古草居群的Tr均随PAR的增强而增大,呈上升趋势(图1C),其中,居群P1、P2的Tr上升幅度明显高于居群P3、P4。PAR增强,Pn增大,植物叶片对CO2需求增加,Gs增大,单位面积叶片蒸腾失水增多。
4个居群的WUE随PAR的增大呈先上升后下降的趋势,在PAR达到800 μmol/(m2·s)时WUE达到最大值(图1D),4个居群的WUE差异显著(P<0.05),大小顺序为:P4>P3> P1> P2,说明居群P4的水分利用效率最高。
2.2不同野古草居群光合作用对CO2浓度的响应
2.2.1光合—CO2响应曲线的特征从光合-CO2响应曲线(图2A)可知, 4个野古草居群的Pn均随CO2浓度的增大逐渐增大,当CO2浓度达到CO2饱和点时(约800 μmol/mol)Pn达到最大值,之后则呈下降趋势。利用直角双曲线模型和直线回归方程拟合的CO2响应参数见表3,居群P2的表观羧化效率最高,为0.0783,居群P2最大净光合速率Pnmax也最高,为24.78 μmol/(m2·s),居群P4最低(18.92 μmol/m2·s),居群P1(23.17 μmol/m2·s)、P3(20.48 μmol/m2·s)居中,表明居群P2光合能力最强。居群P2、P4的CO2补偿点显著低于居群P1、P3(P<0.05)。居群P4的CO2饱和点最高,为872 μmol/mol,说明居群P4的CO2利用范围最广。
2.2.2气孔导度(Gs)的变化随CO2浓度的升高,4个野古草居群的Gs呈下降趋势(图2B)。居群P1、P2的Gs明显高于居群P3、P4, 且下降幅度较小。居群P1、P2的CO2饱和点显著低于居群P3、P4(P<0.05),但居群P1、P2的最大净光合速率却更高(表3),表明此时居群P1、P2光合作用的下降不是由于气孔关闭所引起的,而主要是非气孔限制导致的,即叶肉细胞光合活性降低的缘故[35]。
2.2.3蒸腾速率(Tr)和水分利用率(WUE)的变化随着CO2浓度的升高,4个居群的Tr变化趋势一致(图2C)。居群P3、P4的Tr明显高于居群P1、P2,在CO2浓度为0~600 μmol/mol,各居群的蒸腾速率均呈下降趋势,CO2浓度大于600 μmol/mol时,各居群的蒸腾速率逐渐增大。
4个野古草居群的WUE随着CO2浓度的升高均呈先上升后下降的趋势(图2D)。居群P1、P2在CO2浓度达到800 μmol/mol时达到最大,而居群P3、P4在CO2浓度达到1000 μmol/mol时达到最大,且后两者明显高于前两者。

图2 不同野古草居群叶片光合-CO2响应曲线Fig.2 CO2response curve of photosynthesis in four A. hirta populations
3讨论
光是植物生长必需的生态因子之一,植物叶片的光饱和点与光补偿点反映了植物对光照条件的要求,表观量子效率反映了植物利用弱光进行光合作用的能力,最大净光合速率可反映植物对光合有效辐射的利用和适应能力[36]。目前,国内外学者已对牧草、粮食及其他经济作物的光合效率进行了大量研究,发现光合作用不仅受光照、水、温度、水分、养分、空气、土壤等外界条件所制约[8,36],也受植物本身的遗传特性影响,不同作物种(或品种)的光合效率常存在差异[37-38],因此,光合效率常作为种质资源筛选与评价的重要依据。本研究中,处于抽穗期的野古草居群P1、P2的近光饱和点相对较高,补偿点较低,最大净光合速率高,表观量子效率高,说明这两个居群对光环境的适应性强,利用效率高,同时,叶片净光合速率和气孔导度都与此前生长期间的干物质积累效率有极显著的正相关关系,居群P1、P2的分蘖枝条干重和株丛高度均高于居群P3、P4的原因,与其光合效率较高有关[分蘖枝条干物质累积量的大小顺序为:P1(8.49 g)>P2(7.09 g)>P3(7.07 g)>P4(6.62 g);株丛高度大小顺序为:P1(149 cm)> P3(130 cm)> P2(95 cm)>P4(93 cm)]。居群P1、P2的蒸腾速率较高,说明需水量较多,因此要加强水分管理以促进其健壮生长,而居群P3、P4气孔导度较低,对水分的保持能力较强,抗旱性较强,但是居群间及与其他的观赏草之间的抗旱性的强弱差异还需进一步测定,以期筛选出抗旱性强的野古草种质,为解决包宝祥[14]提出的野古草耐旱性较其他观赏草弱的问题提供了方向。
蒋高明[39]认为阴性植物的光补偿点小于20 μmol/(m2·s),光饱和点为500~1000 μmol/(m2·s)或更低;阳性植物的光补偿点在50~100 μmol/(m2·s)之间,光饱和点在1600~2000 μmol/(m2·s)之间或更高。野古草居群P1的光饱和点为1782 μmol/(m2·s),光补偿点分别为64.65 μmol/(m2·s),为典型阳生植物的特征;居群P2的光饱和点为1690 μmol/(m2·s),光补偿点却较低,为35.82 μmol/(m2·s),说明P2具备阳生植物的特征,但对弱光具有一定的适应性;居群P3、P4的光饱和点为1432 μmol/(m2·s)和1403 μmol/(m2·s),光补偿点却较高,分别为51.39 μmol/(m2·s)和57.93 μmol/(m2·s),具备部分阳生植物的特点。居群P1、P2的表观量子效率略低于耐阴性阳性植物地毯草的表观量子效率(0.059)、与狼尾草(0.059~0.063)比较接近[40-41],P4的表观量子效率与较耐阴的中华结缕草(0.460)接近[42],而居群P3的表观量子效率则更低,表明4个野古草居群具有阳性植物的特点,且均具有一定的耐阴性,耐阴性强弱顺序为:P4>P3>P1>P2。
植物的光合速率受植物体内叶绿体的光合速率和CO2供应的控制。在CO2响应曲线中初始斜率与核酮糖1,5-二磷酸羧化酶(Rubisco)的活性呈正相关[37],居群P2最高,达到0.0783,具有较高的酶活性。当CO2浓度从200 μmol/mol增加到600 μmol/mol,净光合速率可提高7.67~11.28 μmol/(m2·s),为最大净光合速率的40%~49%,尤其是居群P3,CO2饱和浓度下最大净光合速率较光饱和最大净光合速率高(表2、3),进一步证实了野古草居群强光下光合速率在更大程度上受CO2供应的控制。CO2补偿点低的作物常具有净光合速率高、产量高的特点,因此低CO2补偿点也常被用作选育高产品种指标[43]。4个野古草居群的CO2补偿点都比较低,但居群P1、P2还具有较高的表观量子效率和表观羧化效率,因此具有高光效和高CO2利用率等光合特性,是具有较高光能生产潜力的种质资源。
References:
[1]Guan D S. Phytomass and net primary production (NPP) of the grassland consisting ofIschaemumspp.+Arundinellasetosa+Eulaliaspeciosacommunity. Chinese Journal of Ecology, 1997, 16(6): 22-26.
[2]Xu S J, Zeng B, Lei S T,etal. Root features of several flooding-tolerant plants and their roles in enhancing anti-erodibility of the soil in Three Gorges Reservoir Region. Acta Pedologica Sinica, 2011, 48(1): 160-167.
[3]Yu D F, Dai Q H, Wang Q H,etal. Effects of contour grass hedges on soil water and N, P nutrients loss on sloping croplands in Beijing. Journal of Soil and Water Conservation, 2010, 24(6): 11-15.
[4]Niu D K, Huang C W, Wu J Y. Effects of grass hedgerow on the soil and water loss and soil nutrient of slope land. Journal of Anhui Agriculture Science, 2009, 37(7): 3079-3081, 3084.
[5]Helder M, Strik D P, Hamelers H V,etal. Concurrent bio-electricity and biomass production in three Plant-Microbial Fuel Cells usingSpartinaanglica,ArundinellaanomalaandArundodonax. Bioresource Technology, 2010, 101: 3541-3547.
[6]Li S X. Flora of Liaoling (Volume Ⅱ)[M]. Shenyang:Liaoning Science & Technology Press, 1992: 944-946.
[7]Zhong Y F. New favourite in landscape-Ornamental grass. China Flower and Horticulture, 2005, 18: 49-52.
[8]Gao H, Zong J Q, Chen J B,etal. Diurnal change of photosynthetic characteristics and response to light intensity of seven ornamental grasses. Acta Prataculturae Sinica, 2010, 19(4): 87-93.
[9]Yuan X H, Teng W J, Wu J Y. New ground cover plant-Ornamental grass. In: Chen Z Z, Zhou H. Review on the Progress of Lawn and Ground Cover Plant[M]. Beijing: China Forestry Press, 2006: 266-268.
[10]Wu J Y, Teng W J, Wang Q H. Evaluation of ornamental characters of introduced drought-tolerant perennial ornamental grasses in spring. Acta Agriculturae Boreali-Sinica, 2006, 21(1): 129-132.
[11]Wu J Y, Teng W J, Wang Q H,etal. Evaluation of growth and ornamental value for introduced perennial ornamental grass in Beijing. Acta Horticulturae Sinica, 2006, 33(5): 1145-1148.
[12]Wu J Y, Teng W J, Yuan X H,etal. Investigation and propagation characteristics of native ornamental grass resources in Beijing. Acta Agrestia Sinica, 2009, 17(1): 10-16.
[13]Yuan X H, Teng W J, Yang X J,etal. Effect of peat on growth and sprouting ofArundinellahirtacontainer seedling. Acta Agrestia Sinica, 2010, 18(4): 598-602.
[14]Bao B X. Selection of the Ground Cover Plants with Drought Resistance in Urban Greenland in Beijing Area[D]. Huhhot: Inner Mongolia Agricultural University, 2008.
[15]Li Y, Zeng B. Research on dynamics of the recovery growth ofArundinellaanomalaSteud. after submergence in water. Journal of Anhui Agriculture Science, 2012, 40(19): 10112-10114.
[16]Li Y. The Effects of Flooding on Survival and Recovery Growth of Riparian Plant SpeciesSalixvariegateFrach. andArundinellaanmalaSteud. in Three Gorges Reservoir Region[D]. Chongqing: Southwest University, 2008.
[17]Chen T. Effect of waterflooding on the formation of aerenchymas in the stems ofArudinellaanomalaandSalixvariegateseedlings. Journal of Anhui Agriculture Science, 2009, 37(15): 7265-7266.
[18]Liu D. The Effects of Simulated Flooding on Cytochrome Coxidase and Amylase Activity of the Riparian PlantArundinellaanomalaSteud. In Three Gorges Reservoir Region[D]. Chongqing: Southwest University, 2007.
[19]Gao Z Q. Identification of Sn Heperaccumulators and Adsorption-desorption Mechanisms of Contaminated Soil Remediation[D]. Tianjing: Nankai University, 2013.
[20]Dengler N G, Woodvine M A, Donnelly P M,etal. Formation of vascular pattern in developing leaves of the C4grassArundinellahirta. Int. Journal Plant Science, 1997, 158(1): 1-12.
[21]Yang Y F, Zhang H J, Zhang B T. Propagation ofArundinellahirtaclonal population in Songnen Plain of China. Acta Prataculturae Sinica, 1998, 17(1): 1-5.
[22]Hong R M, Wang Y S, Huang D M,etal. Genetic variability and genetic structure in clonal population ofArundinellahirta. Acta Ecologica Sinica, 2004, 24(5): 908-913.
[23]Tan Y L, Liu Y H, Xiong L N,etal. Genetic diversity ofArundinellaanomalaat different altitudes. Journal of Southwest China Normal University (Natural Science), 2009, 34(2): 71-74.
[24]Wakayama M, Ohnishi J I, Ueno O. Structure and enzyme expression in photosynthetic organs of the atypical C4grassArundinellahirta. Planta, 2006, 223: 1243-1255.
[25]Wakayama M, Ueno O, Ohnishi J I. Photosynthetic enzyme accumulation during leaf development ofArundinellahirta, a C4grass having kranz cells not associated with veins. Plant & Cell Physiology, 2003, 44(12): 1330-1340.
[26]Luo F L, Wang L, Zeng B,etal. Photosynthetic responses of the riparian plantArundinellaanomalaSteud. in three gorges reservoir region as affected by simulated flooding. Ecologica Sinica, 2006, 26(11): 3602-3609.
[27]Pasture G M, Lencinas M V, Peri P L,etal. Photosynthetic plasticity ofNothofaguspumilioseedlings to light intensity and soil moisture. Forest Ecology and Management, 2007, 243(2-3): 274-282.
[28]Villabobos A E, Peláez D V. Influence of temperature and water stress on germination and establishment ofProsopiscaldeniaBurk. Journal of Arid Environment, 2001, 49: 321-328.
[29]O′Connor T G, Haines L M, Snyman H A. Influence of precipitation and species composition on phytomass of a semi-arid African grassland. Journal of Ecology, 2001, 89: 850-860.
[30]Zhang L W, Zhong G C, Zhang L,etal. A study on photosynthesis and photo-response characteristics of threeSalviaspecies. Acta Prataculturae Sinica, 2012, 21(2): 70-76.
[31]Farquhar G D, Caemmerers S. A biochemical model photosynthetic CO2assimilation in leaves of C3species. Planta, 1980, 149: 78-90.
[32]Wang X H, Ji M S. Photosynthetic characteristics of an invasive plantConyzacanadensisand its associated plants. Chinese Journal of Applied Ecology, 2013, 24(1): 71-77.
[33]Ye Z P. A review on modeling of responses of photosynthesis to light and CO2. Chinese Journal of Plant Ecology, 2010, 34(6): 727-740.
[34]Yao J, Liu X B, Cui X,etal. Effects of NaCl stress on substances linked to osmotic adjustment and on photosynthetic physiology ofMelilotoidesruthenicain the seedling stage. Acta Prataculturae Sinica, 2015, 24(5): 91-99.
[35]Xu D Q. Non-uniform stomatal closure and non-stomatal limitation of photosynthesis. Plant Physiology Communications, 1995, 31(4): 246-252.
[36]Li L Z, Zhang D G, Xin X P,etal. Photosynthetic characteristics ofLeymuschinensisunder different soil moisture grades in Hulunber Prairie. Acta Ecologica Sinica, 2009, 29(10): 5271-5279.
[37]Dong Z X, Han Q F, Jia Z K,etal. Photosynthesis rate in response to light intensity and CO2concentration in different alfalfa varieties. Acta Ecologica Sinica, 2007, 27(6): 2272-2278.
[38]Zou C M, Wang Y Q, Cao W D,etal. Selection of high photosynthetic efficiencyVignaangularisvarieties and evaluation of their nutritional value. Acta Prataculturae Sinica, 2015, 24(5): 91-99.
[39]Jiang G M. Plant Ecophysiology[M]. Beijing: Higher Education Press, 2004: 59-62.
[40]Jian H Y, Zou S Q. The photosynthetic characteristics in leaves of carpet grass-Axonopuscompressus. Guihaia, 2003, 23(2): 181-184.
[41]Yang X J, Wu J Y, Teng W J,etal. Study on the photosynthetic characteristics of fivePennisetumspecies. Chinese Agricultural Science Bulletin, 2013, 29(1): 122-126.
[42]Deng L, Li G Y, Wang Y,etal. A comparative study on photosynthetic characteristics and chlorophyll contents of fourZoysiaspecies. Grassland and Turf, 2010, 30(1): 7-10.
[43]Han Q F, Jia Z K. Evaluation and Screen ofMedicagosativaGermplasms[M]. Yanglin: Northwest A&F University Press, 2004.
参考文献:
[1]管东升. 香港鸭嘴草+野古草+金茅群落的生物量和第一性生产力. 生态学杂志, 1997, 16(6): 22-26.
[2]徐少君, 曾波, 类淑桐, 等. 三峡库区几种耐水淹植物根系特征与土壤抗水蚀增强效应. 土壤学报, 2011, 48(1): 160-167.
[3]喻定芳, 戴全厚, 王庆海, 等. 北京地区等高草篱防治坡耕地水土及氮磷流失效果研究. 水土保持学报, 2010, 24(6): 11-15.
[4]牛德奎, 黄传伟, 武菊英. 草篱对坡耕地水土流失和土壤养分的影响. 安徽农业科学, 2009, 37(7): 3079-3081, 3084.
[6]李书心. 辽宁植物志(下册)[M]. 沈阳: 辽宁科学技术出版社, 1992: 944-946.
[7]钟云芳. 园林新宠-观赏草. 中国花卉园艺, 2005, 18: 49-52.
[8]高鹤, 宗俊勤, 陈静波, 等. 7种优良观赏草光合生理日变化及光响应特征研究. 草业学报, 2010, 19(4): 87-93.
[9]袁小环, 滕文军, 武菊英. 新型地被植物-观赏草. 见: 陈佐忠, 周禾. 草坪与地被科学研究进展[M]. 北京: 中国林业出版社, 2006: 266-268.
[10]武菊英, 滕文军, 王庆海. 耐旱多年生观赏草春季观赏性评价. 华北农学报, 2006, 21(1): 129-132.
[11]武菊英, 滕文军, 王庆海, 等. 多年生观赏草在北京地区的生长状况与观赏价值评价. 园艺学报, 2006, 33(5): 1145-1148.
[12]武菊英, 滕文军, 袁小环, 等. 北京地区野生禾本科观赏草资源调查及繁殖特性研究. 草地学报, 2009, 17(1): 10-16.
[13]袁小环, 滕文军, 杨学军, 等. 草炭对野古草容器苗生长和萌芽的影响. 草地学报, 2010, 18(4): 598-602.
[14]包宝祥. 北京市城市绿地耐旱性地被植物的筛选[D]. 呼和浩特: 内蒙古农业大学, 2008.
[15]李娅, 曾波. 野古草水淹后恢复生长动态研究. 安徽农业科学, 2012, 40(19): 10112-10114.
[16]李娅. 水淹对三峡库区岸生植物秋华柳和野古草存活和恢复生长的影响[D]. 重庆: 西南大学, 2008.
[17]陈婷. 水淹对野古草和秋华柳幼苗茎通气组织形成的影响. 安徽农业科学, 2009, 37(15): 7265-7266.
[18]刘巅. 水淹胁迫对三峡库区岸生植物野古草(ArundinellaanomalaSteud.)细胞色素C氧化酶和淀粉酶活性的影响[D]. 重庆: 西南大学, 2007.
[19]高志强. 锡超积累花卉筛选及污染土壤修复的吸附-解吸机制[D]. 天津: 南开大学, 2013.
[21]杨允菲, 张洪军, 张宝田. 松嫩平原野古草无性系种群的营养繁殖特征. 草业学报, 1998, 17(1): 1-5.
[22]洪锐民, 王昱生, 黄大明, 等. 野古草种群克隆的遗传变异和遗传结构. 生态学报, 2004, 24(5): 908-913.
[23]谭玉莲, 刘迎辉, 熊丽娜, 等. 不同海拔高度的野古草的遗传多样性分析. 西南师范大学学报(自然科学版), 2009, 34(2): 71-74.
[26]罗芳丽, 王玲, 曾波, 等. 三峡库区岸生植物野古草光合作用对水淹的响应. 生态学报, 2006, 26(11): 3602-3609.
[30]张力文, 钟国成, 张利, 等. 3种鼠尾草属植物光合作用_光响应特性研究. 草业学报, 2012, 21(2): 70-76.
[32]王晓红, 纪明山. 入侵植物小飞蓬及其伴生植物的光合特性. 应用生态学报, 2013, 24(1): 71-77.
[33]叶子飘. 光合作用对光和CO2响应模型的研究进展. 植物生态学报, 2010, 34(6): 727-740.
[34]姚佳, 刘信宝, 崔鑫, 等. 不同NaCl胁迫对苗期萹蓿豆渗透调节物质及光合生理的影响. 草业学报, 2015, 24(5): 91-99.
[35]许大全. 气孔的不均匀关闭与光合作用的非气孔限制. 植物生理学通讯, 1995, 31(4): 246-252.
[36]李林芝, 张德罡, 辛晓平, 等. 呼伦贝尔草甸草原不同土壤水分梯度下羊草的光合特性. 生态学报, 2009, 29(10): 5271-5279.
[37]董志新, 韩清芳, 贾志宽, 等. 不同苜蓿品种光合速率对光和CO2浓度的响应特征. 生态学报, 2007, 27(6): 2272-2278.
[38]邹长明, 王允青, 曹卫东, 等. 高光合效率小豆筛选与营养价值评价. 草业学报, 2015, 24(5): 91-99.
[39]蒋高明. 植物生理生态学[M]. 北京: 高等教育出版社, 2004: 59-62.
[40]蹇洪英, 邹寿青. 地毯草的光合特性研究. 广西植物, 2003, 23(2): 181-184.
[41]杨学军, 武菊英, 滕文军, 等. 5种狼尾草属观赏草光合特性研究. 中国农学通报, 2013, 29(1): 122-126.
[42]邓蕾, 李高扬, 王艳, 等. 4种结缕草光合特性及叶绿素含量的比较研究. 草原与草坪, 2010, 30(1): 7-10.
[43]韩清芳, 贾志宽. 紫花苜蓿种质资源评价与筛选[M]. 杨陵: 西北农林科技大学出版社, 2004.
*Photosynthetic responses ofArundinellahirtapopulations to light intensity and CO2concentration
LIU Ying, BAI Long, LEI Jia-Jun*
CollegeofHorticulture,ShenyangAgriculturalUniversity,Shenyang110866,China
Abstract:Photosynthetic responses to light intensity and CO2concentration were determined in fourArundinellahirtaTanaka populations in Liaoning province in order to provide a basis for further studies of phenotypic variation in this species. Most of the characteristic parameters were significantly different among the fourA.hirtapopulations, suggesting that there are genetic differences between them. The Benxi (P1) and Beizhen (P2) populations showed higher yield potentials as they had higher light saturation points (1782 and 1690 μmol/m2·s, respectively), apparent quantum yields (0.0553 and 0.0564, respectively), carboxylation efficiencies (0.0568 and 0.0783 μmol/m2·s, respectively) and lower CO2compensation points (14 and 12 μmol/mol), respectively. The Jianping (P3) and Zhangwu (P4) populations performed better with regard to drought tolerance, with lower stomata conductance (0.1227 and 0.1176 mol/m2·s, respectively) and transpiration rates (2.67 and 2.68 mmol/m2·s, respectively) and with higher water holding capacities.
Key words:Arundinellahirta; populations; photosynthesis rate; stomata conductance; transpiration rate
*通信作者Corresponding author. E-mail: jiajunleisy@163.com
作者简介:刘英(1978-),女,四川资中人,讲师,在读博士。E-mail:liuyingsyau@126.com
基金项目:沈阳农业大学校青年基金(20091008)和农业部环境保护科研监测所省部级重点实验室2015年度开放基金课题资助。
*收稿日期:2015-06-29;改回日期:2015-09-08
DOI:10.11686/cyxb2015327
http://cyxb.lzu.edu.cn
刘英, 白龙, 雷家军. 野古草居群光合作用对光强和CO2浓度的响应特征. 草业学报, 2016, 25(1): 254-261.
LIU Ying, BAI Long, LEI Jia-Jun. Photosynthetic responses ofArundinellahirtapopulations to light intensity and CO2concentration. Acta Prataculturae Sinica, 2016, 25(1): 254-261.
