抗巨噬细胞移动抑制因子单抗对溃疡性结肠炎小鼠治疗效果及炎症因子水平的影响▲
2016-02-17张启芳王柏涛邱小芬张海莲李西融
张启芳 王柏涛 郑 奕 邱小芬 张海莲 李西融
(1 广西壮族自治区南溪山医院消化内科,桂林市 541002, E-mail:zhangqifang-gl@163.com;
2 桂林医学院研究生学院,桂林市 541004;3 广西壮族自治区南溪山医院病理科,桂林市 541002)
论著·基础研究
抗巨噬细胞移动抑制因子单抗对溃疡性结肠炎小鼠治疗效果及炎症因子水平的影响▲
张启芳1王柏涛2郑 奕1邱小芬3张海莲1李西融3
(1 广西壮族自治区南溪山医院消化内科,桂林市 541002, E-mail:zhangqifang-gl@163.com;
2 桂林医学院研究生学院,桂林市 541004;3 广西壮族自治区南溪山医院病理科,桂林市 541002)
目的 探讨抗巨噬细胞移动抑制因子(MIF)单抗对溃疡性结肠炎(UC)小鼠治疗效果及炎症因子水平的影响。方法 选取30只雄性BALB/c小鼠,分为正常对照组、UC模型组、抗MIF单抗组各10只,以5%葡聚糖硫酸钠诱导建立小鼠UC模型,建模后抗MIF单抗组采用抗MIF单抗腹腔注射给药。给药期间观察各组小鼠一般情况并进行疾病活动指数(DAI)评分、大肠大体损伤评分及组织学评分。建模后第8天检测血清MIF、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)浓度。结果 与正常对照组比较,UC模型组及抗MIF单抗组小鼠DAI评分、大肠大体损伤评分及组织学评分均明显增高(P<0.05);与UC模型组比较,抗MIF单抗组DAI评分、大肠大体损伤评分及组织学评分均明显下降(P<0.05);与正常对照组相比,UC模型组及抗MIF单抗组MIF、TNF-α和IL-6浓度显著升高(P<0.05);与UC模型组相比,抗MIF单抗组MIF、TNF-α和IL-6浓度降低(P<0.05)。结论 抗MIF单抗能有效地抑制UC小鼠血清炎症因子的水平,对UC的治疗有一定的效果。
溃疡性结肠炎;抗巨噬细胞移动抑制因子单抗;巨噬细胞移动抑制因子;肿瘤坏死因子-α;白细胞介素-6;疗效;小鼠
溃疡性结肠炎(ulcerative colitis,UC)是一种主要累及结肠和直肠黏膜及黏膜下层的肠道慢性非特异性炎性疾病,常反复发作,并逐渐加重。UC的病因及发病机制至今尚未明确[1],目前认为其发病与遗传、环境、免疫、精神、肠道菌群失调等多因素有关,而与促炎因子和抗炎因子的平衡失调相关的免疫调节在UC发病中居主导地位[2]。目前针对UC的治疗,临床多选用糖皮质激素、氨基水杨酸制剂、免疫抑制剂等,通过干预炎症因子间的平衡失调,在一定程度缓解UC患者的病情进展,但复发率较高,副作用明显,多数患者需终身治疗。因此现阶段探寻治疗UC的理想方法极其必要,亦是当前研究领域的热点。
巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)最初在炎症性疾病中被发现,广泛存在于人体组织中,是第一个被发现的具有多种生物学功能的炎性趋化细胞因子,可以抑制巨噬细胞的游走和移动,同时具有促炎作用。有学者发现MIF作为促炎因子参与炎症性肠病的发病[3],我们的前期研究也证实MIF参与UC的发病,且其可能是反映UC活动的指标,控制MIF的产生可能有治疗UC作用[4]。本实验采用葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导建立小鼠UC模型,探讨抗MIF单抗是否能够通过抑制UC小鼠血清中MIF及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin-6,IL-6)等炎症因子水平,从而减缓UC的发生发展,为其临床治疗提供新的靶标。
1 材料与方法
1.1 实验动物 无特定病原体级雄性BALB/c小鼠30只,鼠龄8~9周,体质量(24±2)g,湖南斯莱克景达实验动物有限公司提供,许可证号SCXK(湘)2011-0003。桂林医学院实验动物中心(清洁级)饲养,温度(20±4)℃,湿度45%~60%,通风良好,光照随昼夜浮动,饲养环境符合本实验要求。适应性喂养1周,自由饮水。1周后采用随机数字表达将小鼠分为正常对照组、UC模型组、抗MIF单抗组,每组10只。
1.2 药品与试剂 葡聚糖硫酸钠(MW36000-50000),美国MP Biomedicals生物医学公司生产;抗MIF单抗,重庆探生科技有限公司生产(产品货号:FAB20140001);小鼠MIF 酶联免疫吸附试剂盒(产品货号:CSB-E07292m)与IL-6 酶联免疫吸附试剂盒(产品货号:CSB-E04640r)购自武汉华美生物工程有限公司;小鼠TNF-α酶联免疫吸附试剂盒(产品货号:EMC104.96),购自北京欣博盛生物科技有限公司;尿粪隐血测试盒(产品货号:C027),南京建成生物工程研究所。
1.3 仪器与设备 Allegra 64R高速冷冻离心机购自美国Beckman Coulter公司;QL-901涡旋混合机由江苏海门市其林贝尔仪器制造有限公司生产;M200全波段酶标仪由瑞士Tecan公司生产;LRH-150B生化培养箱由广东省医疗器械厂生产。
1.4 模型制备及药物干预 正常对照组自由饮水,其余两组每日饮用5% DSS溶液,连续7 d,以建立模型;各组小鼠每日均正常进食鼠粮。抗MIF单抗(4 mg/ml)与生理盐水按1 ∶3体积比稀释后,分别于建模开始后1 d、2 d、4 d、6 d,对单抗组小鼠腹腔注射给药,每次0.2 ml/只,1次/d,其余两组未注射抗MIF单抗。
1.5 标本收集及测定 于建模后第8天小鼠眼球取血,室温下静置1 h后,5 000 r/min离心5 min,取上清后于-80℃保存待测。严格按照酶联免疫吸附测定试剂盒说明书,检测小鼠血清MIF、TNF-α、IL-6浓度。
1.6 疗效评价
1.6.1 小鼠一般情况:建模及给药期间,每天定时称量体重,观察各组小鼠应激反应、精神状态、毛色、粪便性状、有无便血等。
1.6.2 疾病活动指数(disease activity index,DAI)评分:建模后1~7 d每日定时对各组小鼠称量体重,观察粪便性状,联苯胺法检测粪便隐血后,根据Cooper的经典评分方法[5]进行DAI评分,取7 d评分的平均值进行比较。评分标准见表1。

表1 DAI评分标准
注:DAI评分=(体重下降评分+粪便性状评分+便血评分)/3,分值范围:0~4分。
1.6.3 大肠大体损伤评分:建模后第8天将所有小鼠处死,取正常对照组小鼠大肠远端组织,其余两组取小鼠炎症及溃疡严重的大肠组织。大肠大体损伤按以下标准[6]进行评分:0分,大肠黏膜无损伤;1分,大肠黏膜充血;2分,溃疡面积≤受损面积的25%;3分,溃疡面积25%~50%;4分,溃疡面积≥50%。留取炎症及溃疡严重的大肠组织2 mm×10 mm,予10%甲醛溶液固定,石蜡包埋,切片,苏木精- 伊红(hematoxylin-eosin,HE)染色。光学显微镜下观察并按大肠组织学评分标准[7]进行评分,见表2。组织学损伤程度采用炎症、病变深度、隐窝破坏及病变范围评分的乘积表示。

表2 大肠组织学评分标准
1.7 统计学分析 采用SPSS 18.0软件进行统计学分析,计量资料以(x±s)表示,多组间均数的比较采用单因素方差分析,组间两两比较采用LSD-t检验;以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠一般情况 正常对照组小鼠毛色柔顺,反应灵敏,精神活跃,体重不同程度增加,无便血和腹泻;UC模型组小鼠毛色杂乱、毛发干枯,体重明显下降,精神萎靡,反应迟缓,便血严重;抗MIF单抗组小鼠毛色杂乱程度与体重下降幅度不及模型组明显,精神良好。
2.2 各组小鼠DAI评分 UC模型组DAI评分明显高于抗MIF单抗组及正常对照组(P<0.05);抗MIF单抗组小鼠DAI评分亦高于正常对照组(P<0.05)。见表3。
2.3 各组小鼠的大肠大体损伤情况 肉眼观察,对照组小鼠大肠黏膜无充血、无出血点,肠壁光滑,血管网清晰可见;UC模型组大肠黏膜充血水肿、色泽暗淡,局部可见糜烂或溃疡,管壁僵硬;抗MIF单抗组小鼠大肠黏膜充血水肿明显、有较多小出血点,颜色更加暗淡,其范围、程度均较模型组减轻。UC模型组大肠大体损伤评分明显高于抗MIF单抗组及正常对照组(P<0.05),抗MIF单抗组小鼠评分亦高于正常对照组(P<0.05),见表3。
2.4 大肠HE染色组织学评分 对照组小鼠的大肠黏膜及黏膜下层结构完整、无缺损,上皮细胞排列整齐,腺体规则,浆膜层无充血;模型组大肠黏膜上皮明显糜烂,固有层大部分腺体结构破坏,可见肉芽组织形成,固有层及黏膜下层大量炎症细胞浸润;单抗组大肠黏膜上皮无明显糜烂,腺体规则、整齐,血管内见红细胞聚集一起,呈充血现象,固有层有炎症细胞浸润,但是其数量及浸润深度比模型组轻。见图1。UC模型组大肠组织学评分明显高于抗MIF单抗组及正常对照组(P<0.05),抗MIF单抗组小鼠评分亦高于正常对照组(P<0.05),见表3。
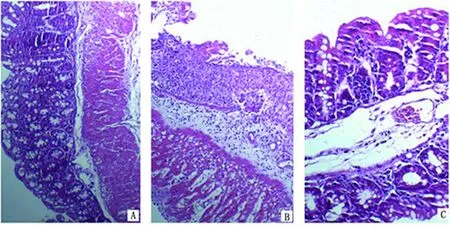
图1 大肠组织HE染色情况(HE染色×100)
注:A为对照组,B为UC模型组,C为抗MIF单抗干预组。

表3 小鼠DAI评分、大肠大体损伤及大肠组织学评分(x±s,分)
注:各指标中,两两比较均P<0.05。
2.5 各组小鼠MIF、TNF-α、IL-6浓度比较 UC模型组及抗MIF单抗组小鼠血清MIF、TNF-α、IL-6的浓度明显高于正常对照组(P<0.05);抗MIF单抗组小鼠血清MIF、TNF-α、IL-6浓度低于UC模型组(P<0.05)。见表4。

表4 各组小鼠血清MIF、TNF-α、IL-6的浓度(x±s,pg/ml)
注:各指标中,两两比较均P<0.05。
3 讨 论
UC是炎症性肠病中较常见的一种类型,欧洲及北美为主要好发区域[8]。近年来伴随我国经济的飞速发展以及国民饮食习惯的改变等诸多因素,我国UC发病率呈现逐年上升态势[9],已成为常见的消化系统病种之一,因此受到广泛关注。目前UC确切的发病机制及相关致病因素尚不明确,但目前国内外学者普遍达成共识,认为促炎因子和抗炎因子的平衡失调致使机体免疫调节失衡在UC的发病中起到重要的作用,因而针对免疫方面治疗UC的研究日益深入。MIF作为近年发现的多效能细胞因子,在机体内广泛存在,参与多种疾病的炎症反应过程,尤以在炎症反应性疾病及恶性肿瘤等的病程演进中呈显著性表达[10]。国内外研究表明,在UC患者的血清中,TNF-α、IL-6等促炎因子的表达水平明显增高,且增高的水平和病情严重程度呈正相关[11]。而我们的前期研究已证实,UC中MIF可以激发TNF-α、IL-6等炎性介质的释放,此类炎性介质又可反向作用于MIF刺激其释放,从而可正性调控炎症反应的发生,加重病情,因此MIF被认为是TNF-α、IL-6等促炎因子的上游调控因子[12-13],在炎症反应中具有重要作用。英夫利昔单抗在UC的临床治疗中已取得一定疗效[14],但仍有一部分病人治疗效果并不理想,所以,寻找对UC治疗更为有效的生物制剂已成为当前该领域的研究热点。
目前炎症性肠病动物模型制备方法主要有化学药物诱导法和基因法,其中化学药物诱导法是由三硝基苯磺酸、DSS、恶唑酮等诱导而成的动物模型。鉴于DSS模型制作的简单易行,成功率高,重复性好,症状、结肠肉眼病变和组织学改变均与人类UC相似,且可人为地反复以DSS刺激,产生类似人类UC急性期和缓解期的变化,已成为研究UC发病机制和药物疗效较为理想的方法。本研究选用5% DSS诱导成功建立了UC急性期的动物模型,通过小鼠的一般情况、DAI评分、结肠组织的大体损伤评分及HE染色结果的显微镜下观察确立了UC模型的成功建立。
本研究中,与UC模型组比较,应用抗MIF单抗干预治疗后小鼠的精神状态、体重变化、便血程度、腹泻次数、毛发杂乱程度等表现均有所改善,DAI评分、结肠组织的大体损伤评分、组织学评分均降低(P<0.05),表明抗MIF单抗不仅有助于改善UC小鼠的症状,亦对大肠的大体及病理学损伤有所缓解,有利于UC小鼠结肠黏膜炎症的好转或愈合。此外,抗MIF单抗组血清MIF、TNF-α、IL-6等促炎因子的表达水平较UC模型组也有不同程度的下降(P<0.05),这与国外研究结果相符[15-16]。这表明抗MIF单抗能抑制UC小鼠MIF及其他炎症因子的释放,干预降低UC血清的炎症因子水平,从而调节炎症因子间的平衡,以达到机体的免疫平衡稳态,减轻炎症反应,改善UC的临床表现及减轻大肠黏膜的损伤程度,进而缓解UC的病情进展。其可能的作用机制是抗MIF单抗通过直接作用于UC中主要促炎因子的上游调控因子MIF本身,而阻断其异常表达,减轻巨噬细胞的聚集,降低UC促炎因子的诱导产生,且相关促炎因子可进一步减少对MIF的刺激分泌,从而对UC病情的进展起到很好的控制作用。
本实验从UC小鼠模型中促炎因子在血清中表达水平的直观变化着眼,对抗MIF单抗对小鼠UC的治疗作用及发挥作用的可能路径进行了初步探讨,肯定了抗MIF单抗对UC治疗的确切疗效,但是对抗MIF单抗治疗作用的具体机制尚需进一步研究。
[1] Siggers RH,Hackam DJ.The role of innate immune-stimulated epithelial apoptosis during gastrointestinal inflammatory diseases[J].Cell Mol Life Sci,2011,68(22):3 623-3 634.
[2] 王怡薇,张会会,王彦礼,等.黄芩汤对溃疡性结肠炎大鼠 NF-κBp65 调控作用研究[J].药学学报,2015,50(1):21-27.
[3] Ohkawara T,Miyashita K,Nishihira J,et al.Transgenic over-expression of macrophage migration inhibitory factor renders mice markedly more susceptible to experimental colitis[J].Clin Exp Immunol,2005,140(2):241-248.
[4] 张启芳,邱小芬,张翠萍,等.巨噬细胞移动抑制因子在炎症性肠病发病中的作用[J].世界华人消化杂志,2008,16(15):1 645-1 648.
[5] Cooper HS,Murthy SN,Shah RS,et al.Clinicopathologic study of dextran sulfate sodium experimental murine colitis[J].Lab Invest,1993,69(2):238-249.
[6] Ekström GM.Oxazolone-induced colitis in rats:effects of budesonide,cyclosporin A,and 5-aminosalicylic acid[J].Scand J Gastroenterol,1998,33(2):174-179.
[7] Dieleman LA,Palmen MJ,Akol H,et al.Chronic experimental colitis induced by dextran sulphate sodium(DSS) is characterized by Th1 and Th2 cytokines[J].Clin Exp Immunol,1998,114(3):385-391.
[8] Al-Mofarreh MA,Al-Mofleh IA.Emerging inflammatory bowel disease in saudi outpatients:a report of 693 cases[J].Saudi J Gastroenterol,2013,19(1):16-22.
[9] Prideaux L,Kamm MA,De Cruz PP,et al.Inflammatory bowel disease in Asia:a systematic review[J].J Gastroenterol Hepatol,2012,27(8):1 266-1 280.
[10]Giannice R,Erreni M,Allavena P,et al.Chemokines mRNA expression in relation to the Macrophage Migration Inhibitory Factor(MIF) mRNA and Vascular Endothelial Growth Factor(VEGF) mRNA expression in the microenvironment of endometrial cancer tissue and normal endometrium:a pilot study[J].Cytokine,2013,64(2):509-515.
[11]张超贤,秦咏梅.溃疡性结肠炎患者血清肿瘤坏死因子-α、白细胞介素-8水平变化及其临床意义[J].西安交通大学学报:医学版,2009,30(5):646-647.
[12]张启芳,梁志海,唐国都,等.巨噬细胞移动抑制因子在急性坏死性胰腺炎肺损伤中的表达及白介素-10 的干预作用[J].中国现代医学杂志,2008,18(19):2 795-2 797,2 801.
[13]王柏涛,张启芳,邱小芬,等.抗巨噬细胞移动抑制因子单抗对溃疡性结肠炎小鼠发病的干预机制研究[J].安徽医科大学学报,2016,51(1):31-35.
[14]谭晓燕,毛靖伟,王英德.回顾性分析溃疡性结肠炎115例[J].世界华人消化杂志,2014,22(33):5 188-5 192.
[15]de Jong YP,Abadia-Molina AC,Satoskar AR,et al.Development of chronic colitis is dependent on the cytokine MIF[J].Nat Immunol,2001,2(11):1 061-1 066.
[16]Ohkawara T,Nishihira J,Takeda H,et al.Amelioration of dextran sulfate sodium-induced colitis by anti-macrophage migration inhibitory factor antibody in mice[J].Gastroenterology,2002,123(1):256-270.
Effects of anti-macrophage migration inhibitory factor antibody on efficacy and inflammatory factors in mice with ulcerative colitis
ZHANGQi-fang1,WANGBai-tao2,ZHENGYi1,QIUXiao-fen3,ZHANGHai-lian1,LIXi-rong3
(1DepartmentofGastroenterology,NanxishanHospitalofGuangxiZhuangAutonomousRegion,Guilin541002,China; 2GraduateSchool,GuilinMedicalUniversity,Guilin541004,China; 3DepartmentofPathology,NanxishanHospitalofGuangxiZhuangAutonomousRegion,Guilin541002,China)
Objective To investigate the effects of anti-macrophage migration inhibitory factor(MIF) antibody(Ab) on efficacy and inflammatory factors in mice with ulcerative colitis(UC).Methods Thirty BALB/c male mice were enrolled and divided into normal control group,UC model group and anti-MIF Ab group,with 10 mice in each group.UC model was established using 5% dextran sulfate sodium in mice.After the modeling,the anti-MIF Ab group was administered transabdominally the anti-MIF Ab.During the period of drug administration,the general situation,disease activity index(DAI) score,gross injury score and histological score of large intestine were evaluated in each group.On the 8th day after modeling,the serum concentrations of MIF,tumor necrosis factor-(TNF-α),interleukin-6(IL-6) were detected.Results Compared to the normal control group,the DAI score,gross injury score and histological score of large intestine were significantly higher in the UC model group or anti-MIF Ab group(P<0.05).Compared to the UC model group,the DAI score,gross injury score and histological score of large intestine were significantly lower in the anti-MIF Ab group(P<0.05).Compared to the normal control group,the concentrations of MIF,TNF-α and IL-6 remarkably increased in the UC model group or anti-MIF Ab group(P<0.05).Compared to the UC model group,the concentrations of MIF,TNF-α and IL-6 decreased in the anti-MIF Ab group(P<0.05).Conclusion Anti-MIF Ab has a strongly inhibitory effect on the levels of serum inflammatory factors in mice with UC and is effective on the treatment of UC to a degree.
Ulcerative colitis,Anti-macrophage migration inhibitory factor antibody,Macrophage migration inhibitory factor,Tumor necrosis factor-α,Interleukin-6,Efficacy,Mouse
广西医疗卫生重点科研课题(重2011018);广西桂林市科学研究与技术开发计划(科技攻关20140120-7-2)
张启芳(1968~),女,博士,教授,硕士研究生导师,主要研究方向:炎症性肠病的基础与临床研究。
R 574.621
A
0253-4304(2016)05-0615-04
10.11675/j.issn.0253-4304.2016.05.04
2015-12-14
2016-03-02)
