下调蛋白磷酸酯酶2A活性对抑郁症大鼠症状改善效果及其作用机制▲
2016-02-17王凯华周欣梅
蒙 冰 任 丁 王凯华 周欣梅
(广西中医药大学附属瑞康医院神经内科,南宁市 530011,E-mail:67232624@qq.com)
论著·基础研究
下调蛋白磷酸酯酶2A活性对抑郁症大鼠症状改善效果及其作用机制▲
蒙 冰 任 丁 王凯华 周欣梅
(广西中医药大学附属瑞康医院神经内科,南宁市 530011,E-mail:67232624@qq.com)
目的 探讨下调蛋白磷酸酯酶2A(PP2A)活性对抑郁模型大鼠症状改善效果及其作用机制。方法 以慢性温和不可预知应激诱导抑郁症大鼠模型30只,分为对照A组、对照B组、低浓度冈田酸(OA)组、中浓度OA组、高浓度OA组及最优浓度OA组各5只;检测对照A组、对照B组、低浓度OA组、中浓度OA组、高浓度OA组PP2A的活性,筛选最优浓度OA;对照A组及对照B组分别从侧脑室微量注射无菌生理盐水5 μl,低浓度OA组、中浓度OA组、高浓度OA组、最优浓度OA组分别从侧脑室注射浓度为5 nmol/L、10 nmmol/L、20 nmol/L及最优浓度OA溶液各5 μl。对对照B组及最优浓度OA组进行蔗糖水消耗试验、旷场试验、体重及水迷宫等行为学测试,检测去甲肾上腺素(NE)、5-羟色胺(5-HT)、皮质醇(CORT)水平,检测脑组织中酪氨酸羟化酶(TH)、细胞外信号激酶(ERK)、丝氨酸-苏氨酸蛋白激酶(AKT)及糖原合酶激酶3β(GSK-3β)的蛋白水平及磷酸化水平检测。结果 OA组的浓度越高PP2A的活性越低(P<0.01),将20 nmol/L OA组设为最优浓度OA组;最优浓度OA组旷野实验的水平及垂直得分均高于对照B组(P<0.05);随观察时间延长,最优浓度OA组的糖水饮用量、体重增加,水迷宫逃避潜伏期缩短(P<0.05),且在给药后第8、15、22天,与对照B组比较,其糖水饮用量、体重均较高,水迷宫逃避潜伏期较短(P<0.05);最优浓度OA组NE、5-HT水平,TH、ERK、AKT蛋白水平以及TH、ERK、AKT、GSK-3β的磷酸化水平均高于对照B组(P<0.05);最优浓度OA组CORT水平以及GSK-3β蛋白水平均低于对照B组(P<0.05)。结论 PP2A的活性随OA浓度升高而降低,下调PP2A活性可能通过调节TH、ERK 以及 AKT/GSK-3β信号途径,从而改善大鼠的抑郁症状。
抑郁症;蛋白磷酸酯酶A;糖原合酶激酶3β;酪氨酸羟化酶;细胞外信号激酶;大鼠
抑郁症作为一种较为多发的精神障碍疾病,随着现代社会的发展和人们精神压力的增大,全球抑郁症患者人数正呈不断增长的趋势,最新的研究表明,全球抑郁症的发病率高达10%~15%[1],已然成为世界第四大疾病,据推算,到2020年,抑郁症极有可能仅次于心脏疾患成为影响人们健康的第二大疾患[2]。抑郁症已经成为当前对人们在生活、工作中的幸福指数造成严重影响的重要不良因素,甚至出现自杀而危及生命。
抑郁症主要表现为情绪障碍、自主神经系统功能障碍、认知功能障碍、运动抑制等。由于目前抑郁症的发病机制尚不完全明确,故缺乏针对该疾病靶点有效的防治措施。因此,进一步明确抑郁症的发病机制,寻找更为切实有效的治疗方法则显得尤为重要。最近,Budziszewska等[3]报告,蛋白磷酸酯酶 2A(protein phosphatase 2A,PP2A) 蛋白水平在产前应激诱导的抑郁症大鼠模型的海马和皮质中明显升高,分别约70%和25%。这提示 PP2A可能参与了抑郁症的发生,但其作用机制目前国内外尚未见类似的研究报告。本文通过研究下调PP2A活性对抑郁症改善作用的分子机制,从而为研制治疗抑郁症药物提供新的靶点和理论支持。
1 材料与方法
1.1 实验动物及分组 成年雄性SD大鼠30只(由广西中医药大学实验动物中心提供,许可证号:SCXK桂2012-0003,体重(230±30)g(普通级),先将其按自然条件饲养7 d以对环境进行适应,进而依照旷野行为学鉴定法[4]进行筛选,垂直方向分数≥10分并且水平方向分数≥30分的大鼠被认定为正常大鼠,将所有正常大鼠采用随机数字法随机分为6组:对照A组(不给药)、对照B组(不给药)、低浓度冈田酸(Okadaic acid,OA)组、中浓度OA组、高浓度OA组、最优浓度OA组(通过PP2A活性的测定结果选取最佳OA浓度),每组5只。
1.2 抑郁症大鼠模型建立 采用慢性温和不可预知应激[5]诱导建立抑郁症大鼠模型。将所有大鼠予以夹尾1 min、禁水24 h、禁食24 h、45℃环境5 min、昼夜颠倒24 h、水平振荡30 min、4℃冰水游泳5 min刺激。将上述7种方法依次标记为1~7,每天采用随机数字法采取1种,共安排21 d,每2种刺激不能连续出现。
1.3 实验仪器及试剂 脑立体定位仪(成都仪器厂,型号:DW-2000),微型电钻(成都仪器厂,型号:XSZ-P-I),微量注射器(5 μl)(上海安亭微量进样器厂,型号:87930),旷野实验用敞箱(广西中医药大学生理学教研室制),Morris水迷宫(成都仪器厂),普通离心机(江苏海门市其林贝尔仪器制造有限公司,型号:SS200),液体闪烁计数器(北京恒昌高科科学技术有限公司,型号:RM-905a),荧光分光光度计(北京海光仪器有限公司,型号:F7001);冈田酸(上海恒远生物科技有限公司,合格证号:78111-17-8),凝胶成像系统(Thermo Scientific公司,批号:4466611),Western Blot电泳仪(北京六一仪器厂,型号:DYCP-37B);磷32标记三磷酸腺苷(32P-adenosine triphosphate,32P-ATP;上海岚派生物科技有限公司,合格证号:67129),磷酸化酶-b(美国Sigma公司,批号:SLBG9973),磷酸化酶激酶(上海维基生物有限公司,批号:23302),蛋白磷酸酯酶-1(protein phosphatase-1,PP-1)特异性抑制剂(美国Sigma公司,批号:SLDG1223),抗酪氨酸羟化酶(anti-tyrosine hydroxylase,anti-TH)抗体(上海康朗生物科技有限公司,批号:10-P1732-1)、抗细胞外信号激酶(anti-extracellular signal regulated kinase,anti-ERK)抗体(北京达科为生物技术有限公司,批号:02-9011-200)、抗丝氨酸-苏氨酸蛋白激酶(anti-serine/threonine protein kinase,anti-AKT)抗体(美国Abcam公司,批号:ab79360)、抗糖原合酶激酶3β(anti-glycogen synthase kinase 3β,anti-GSK-3β)抗体(美国Santa公司,批号:sc-81496),山羊IgG亲和纯化二抗标记( 北京中杉金桥生物公司,批号:SP-9000-D),BeyoECL Plus-超敏ECL化学发光试剂盒(碧云天生物公司,批号:P0018)。
1.4 侧脑室置管注射药物 使用1.5%戊巴比妥钠(0.4 ml/100 g)对需进行侧脑室注射的大鼠进行腹腔内注射麻醉,参照 Paxinos & Watson 大鼠脑立体定位图谱,采用立体定向仪作为引导,于单侧侧脑室上方钻取骨窗,并由此向侧脑室置入注射用套管(AP=0.8 mm,LR=1.6 mm,V=3.5 mm)。完成置入术24 h后,给予对照A组及对照B组分别从侧脑室微量注射无菌生理盐水5 μl,低浓度OA组、中浓度OA组、高浓度OA组、最优浓度OA组分别从侧脑室微量注射浓度为5 nmol/L、10 nmol/L、20 nmol/L及从上述浓度中选取最优浓度的OA溶液各5 μl,其中用无菌生理盐水将OA分别配制成相应浓度。
1.5 行为学测试 对照B组、最优浓度OA组在侧脑室给药后,完成蔗糖水消耗试验、旷场试验、体重测量及水迷宫的测试。
1.5.1 蔗糖水消耗试验[6]:分别在给药后第1天、第8天、第15天、第22天禁水,禁水24 h后次日测定饮用1%蔗糖溶液的量。以蔗糖溶液的饮用量反映了大鼠快感反应。
1.5.2 旷野试验[4]:在侧脑室注射药物后第22天对每只大鼠在相同环境情况下进行旷野试验,记录大鼠运动情况。所用敞箱为长宽均80 cm、高40 cm、内空的立柱体,周壁为黑色,地面用黑线划分为面积相等的25块。以大鼠穿越地面方块数(四爪跨入)作为水平活动得分,以直立次数(两前肢离地1 cm以上)为垂直活动得分。以旷野试验的水平活动反映了大鼠的活动水平,垂直活动的多少则反映其兴趣高低;水平运动减少反映了动物的活动度的降低,垂直运动减少反映了动物对新鲜环境的好奇程度降低。
1.5.3 体重:分别测定给药后第1天、第8天、第15天、第22天大鼠的体重。
1.5.4 水迷宫测试:空间记忆的训练和测试参照水迷宫测试法[7]进行。水温保持在24℃左右,用二氧化钛将水染成白色,从而隐蔽平台。将大鼠背对平台放入水中, 大鼠从入水到找到水下隐蔽的平台所需要的时间为逃避潜伏期,从给药后第1天开始,共历时4 d,每天测试1次,并记录下结果。
1.6 免疫生化水平检测
1.6.1 PP2A活性的测定:在侧脑室注射药物24 h后,处死对照A组、低浓度OA组、中浓度OA组、高浓度OA组大鼠,分别取出海马组织,并低温匀浆以备用。于缓冲液中,用磷酸化酶-b对32P-ATP和磷酸化酶激酶进行中和标记,30℃孵育10 min,经层析后,收集含32P-ATP标记的磷酸化酶-a,作为PP2A的底物。再将该底物与海马组织匀浆提取物及PP-1特异性抑制剂等于常温下反应30 min后终止反应,将反应物于层析纸上,进行闪烁计数分析。
1.6.2 荧光分光光度法:对照B组和最优浓度OA组大鼠在完成行为学检测后采取迅断头采血法,采血5 ml,并进行血清分离,在4℃下按3 000 r/min转速离心15 min,然后取上清液,用荧光分光光度法测去甲肾上腺素(norepinephrine,NE)、5-羟色胺(5-hydroxytryptamine,5-HT)、皮质醇(cortisol,CORT)的水平。
1.6.3 Western Blot方法:获取对照B组和最优浓度OA组大鼠皮质和海马匀浆后(方法同1.6.1),采用 Western Blot 检测皮质和海马的酪氨酸羟化酶(tyrosine hydroxylase,TH)、细胞外信号激酶(extracellular signal regulated kinase,ERK)、丝氨酸-苏氨酸蛋白激酶(serine/threonine protein kinase,AKT )及糖原合酶激酶3β(glycogen synthase kinase 3β,GSK-3β)的蛋白水平及磷酸化水平。
1.7 统计学分析 采用SPSS 21.0软件进行分析,计量资料以(x±s)表示,两组间比较采用独立样本t检验,多组间数据比较采用单因素方差分析,进一步两两比较采用LSD-t检验,重复测量资料采用重复测量方差分析以及多因素方差分析。以P<0.05差异有统计学意义。
2 结 果
2.1 OA对PP2A活性的作用观察 4组间PP2A活性比较,差异有统计学意义(P<0.01)。不同浓度OA组PP2A活性均低于对照A组,但低浓度OA组与对照组A比较,差异无统计学意义(P>0.05),中、高浓度OA组与对照A组比较,差异有统计学意义(P<0.01)。低浓度OA组、中浓度OA组、高浓度OA组的PP2A活性依次下降(P<0.05)。见表1。因此最优浓度OA组大鼠采取高浓度(20 nmol/L)OA进行侧脑室注射。

表1 对照A组与各浓度OA干预组间PP2A活性的比较(x±s)
注:与对照A组比较,#P<0.01;与低浓度OA组比较,*P<0.01;与中浓度OA组比较,▲P<0.05。
2.2 对照B组与最优浓度OA组大鼠蔗糖水实验结果比较 两组饮用蔗糖水量比较,差异有统计学意义(F组间=7.910,P组间=0.023),第8、15、22天,最优浓度OA组均多于对照B组。两组饮用蔗糖水量均有随观察时间变化的趋势(F时间=8.834,P时间=0.016),其中最优浓度OA组的饮用蔗糖水量随时间延长而增加,对照B组的饮用蔗糖水量随时间延长而减少。组间与时间有交互效应(F交互=24.045,P交互=0.001)。见表2。
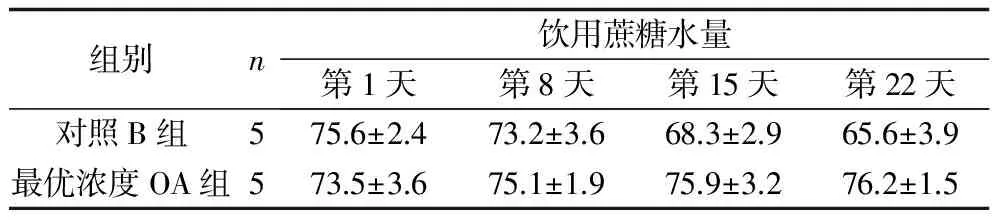
表2 对照B组与最优浓度OA组蔗糖水实验结果(x±s,ml)
2.3 对照B组与最优浓度OA组大鼠旷野试验得分比较 对照B组大鼠水平及垂直得分均低于最优浓度OA组(P<0.05)。见表3。

表3 对照B组与最优浓度OA组旷野实验得分比较(x±s,分)
2.4 对照B组与最优浓度OA组大鼠体重变化比较 两组体重比较,差异有统计学意义(F组间=5.736,P组间=0.044),第8、15、22天,最优浓度OA组的体重均重于对照B组。两组体重均有随观察时间变化的趋势(F时间=14.475,P时间=0.001),其中最优浓度OA组的体重随时间延长而增加,对照B组的体重随时间延长而减少。组间与时间有交互效应(F交互=652.544,P交互<0.001)。见表4。
2.5 对照B组与最优浓度OA组大鼠水迷宫测试结果比较 两组潜伏期比较,差异有统计学意义(F组间=9.812,P组间=0.014 ),第8、15、22天,最优浓度OA组的体重均短于对照B组。两组潜伏期均随观察时间延长而缩短(F时间=2375.770,P时间<0.001)。组间与时间有交互效应(F交互=51.742,P交互<0.001)。见表5。

表4 对照B组与最优浓度OA组不同时间点体重比较(x±s,g)

表5 对照B组与最优浓度OA组水迷宫逃避潜伏期比较(x±s,s)
2.6 对照B组与最优浓度OA组间NE、5-HT、CORT水平比较 最优浓度OA组NE水平、5-HT水平均高于对照B组(P<0.01),而CORT水平低于对照B组(P<0.01)。见表6。

表6 对照B组与最优浓度OA组大鼠NE、5-HT、CORT水平比较(x±s)
2.7 对照B组与最优浓度OA组间TH、ERK、AKT及GSK-3β的蛋白水平比较 最优浓度OA组大鼠TH、ERK、AKT的蛋白水平均高于对照B组,GSK-3β的蛋白水平低于对照B组(P<0.05)。见表7。
2.8 对照B组与最优浓度OA组间TH、ERK、AKT及GSK-3β的磷酸化水平比较 最优浓度OA组TH、ERK、AKT及GSK-3β的磷酸化水平均高于对照B组(P<0.05)。见表8。
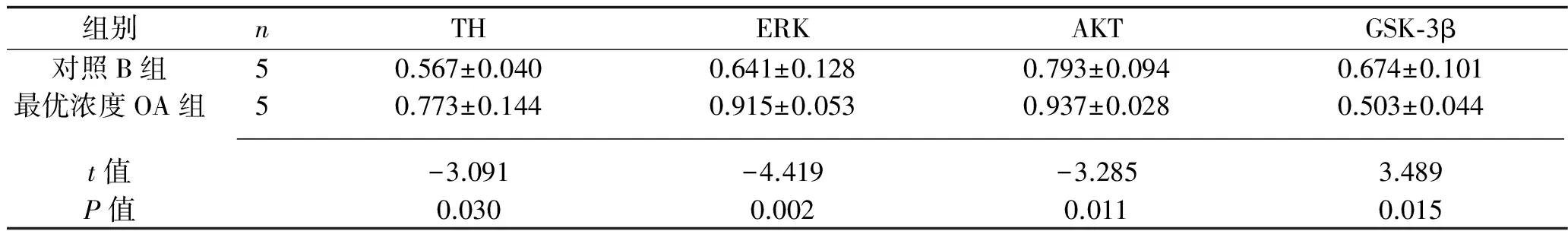
表7 对照B组与最优浓度OA组间TH、ERK、AKT及GSK-3β蛋白水平(相对密度值)比较(x±s)

表8 对照B组与最优浓度OA组间TH、ERK、AKT及GSK-3β磷酸化水平(相对密度值)比较(x±s)
3 讨 论
目前随着针对抑郁症病因靶点研究的日益深入,较高水平的PP2A与抑郁症的正性关系已逐渐为学界所认可,但其作用机制尚未发现有相关的文献报告。本研究采用OA对抑郁症大鼠模型PP2A活性进行抑制,在对不同剂量的OA进行分组对比后发现,PP2A活性受OA的影响,其活性随OA浓度的增加而明显下降(P<0.05)。进一步地我们使用对PP2A影响最大的浓度剂量的OA(最优剂量OA)对抑郁模型大鼠进行干预,行为学检查结果显示,最优浓度OA组旷野实验的水平及垂直得分均高于对照B组(P<0.05);随观察时间延长,最优浓度OA组的糖水饮用量、体重而增加,水迷宫逃避潜伏期缩短(P<0.05),且在给药后第8、15、22天,与对照B组比较,其糖水饮用量、体重均较高,水迷宫逃避潜伏期较短(P<0.05),这提示最优浓度OA组大鼠的抑郁症状表现明显轻于未进行干预的抑郁模型大鼠,说明下调PP2A活性可有效缓解抑郁状态,这与Bauman等[8]的研究结果相类似。并且经过OA干预的抑郁模型大鼠的NE、5-HT明显高于未经处理的抑郁大鼠,而CORT水平则低于后者(P<0.05),这与前者的抑郁症状态得到缓解后,被抑郁状态刺激而兴奋的下丘脑—垂体—肾上腺轴受到抑制而兴奋性下降有关,其中促肾上腺皮质激素释放因子作为下丘脑—垂体—肾上腺轴上关联神经系统与内分泌系统之间的重要神经递质,可调控蓝斑核去甲肾上腺素能神经元、中缝背侧缝核和中缝正中核5-羟色胺能神经元[9],进一步对NE和5-HT水平产生影响;而另一方面,在抑郁状态下高水平的CORT也随着抑郁症状缓解后对肾上腺皮质的兴奋作用的减轻而随之下降。
此外,在PP2A活性下降的同时,经过OA干预的抑郁模型大鼠TH、ERK、AKT、GSK-3β的磷酸化水平升高(P<0.05),从而使得TH、ERK、AKT蛋白水平上升,而GSK-3β蛋白水平则下降(P<0.05)。由此,我们可认为下调PP2A可使ERK、TH、AKT及GSK-3β的磷酸化水平上升,ERK、TH、AKT的功能上调而GSK-3β的功能下降,从而促使5-HT及NE等抗抑郁物质的分泌释放及其相应神经元应答反应功能的改善。
PP2A是一种广泛存在于真核细胞内的蛋白磷酸酯酶,是丝氨酸/苏氨酸磷酸酯酶中极为重要的一种,在细胞功能的诸多方面均起着相当重要的作用,直接或间接参与了细胞的新陈代谢、信号转导、DNA 复制、蛋白合成、生长发育及凋亡等活动方式。脑组织富含的PP2A对神经细胞功能包括可塑性、细胞存活与死亡及信号转导等起重要作用[10]。研究表明, PP2A蛋白水平在产前应激诱导的抑郁症大鼠模型脑组织中明显升高[11]。在本研究中,我们通过OA下调PP2A的活性,使得PP2A通过对底物去磷酸化从而参与细胞功能的能力下降,结果显示TH、ERK、AKT以及GSK-3β的磷酸化水平均明显上升,与此同时,受磷酸化影响的TH、ERK、AKT及GSK-3β的活性也随之改变,前三者活性上调,而后者的活性则下降,这与其他学者的研究报告结果相似[12-15]。这与PP2A作为TH、ERK脱磷酸化修饰的重要的蛋白磷酸酯酶之一有关,由于PP2A活性下调后,TH、ERK的磷酸化水平上升,活性也随之上调,TH作为儿茶酚胺类物质合成的限速酶,其活性在Ser19 位点磷酸化水平上升后得到上调,促使儿茶酚胺类物质的合成,使单胺类神经递质增加,与此同时,在PP2A处于高水平时由于ERK活性下调而出现功能障碍的单胺类神经递质细胞应答反应也因为ERK活性的上调而得到恢复[11,16-17],使得抑郁模型大鼠的抑郁状态得到改善。另一方面,我们通过OA下调PP2A使得AKT的磷酸化水平上升、活性上调;由于在AKT/GSK-3β信号途径中下游的GSK-3β与大多数蛋白激酶不同,去磷酸化时其处于活化状态,作用于静息细胞[18],因此AKT磷酸化水平上升可导致下游的GSK-3β磷酸化水平上升而活性下调[19],除此间接作用之外,下调PP2A活性还可以直接减少其对GSK-3β活性抑制性 Ser9 位点脱磷酸化的催化作用使得GSK-3β的活性下调[20],由于在AKT/GSK-3β信号途径中AKT活性的下降以及GSK-3β活性的明显上升是抑郁症的重要致病环节[21-22],因此通过下调PP2A的活性促使AKT活性上升以及GSK-3β活性下降使得抑郁模型大鼠行为学及血清学指标均显示其抑郁状态得到显著改善。
本研究结果有望为研发治疗抑郁症药物提供新的靶点和理论依据。
[1] Lépine JP,Briley M.The increasing burden of depression[J].Neuropsychiatr Dis Treat,2011,7(Suppl 1):3-7.
[2] Ustün TB,Ayuso-Mateos JL,Chatterji S,et al.Global burden of depressive disorders in the year 2000[J].Br J Psychiatry,2004,184:386-392.
[3] Budziszewska B,Szymanska M,Leskiewicz M,et al.The decrease in JNK- and p38-MAP kinase activity is accompanied by the enhancement of PP2A phosphate level in the brain of prenatally stressed rats[J].J Physiol Pharmacol,2010,61(2):207-215.
[4] Reid I,Forbes N,Stewart C,et al.Chronic mild stress and depressive disorder:a useful new model?[J].Psychopharmacology (Berl),1997,134(4):365-367.
[5] Grippo AJ,Moffitt JA,Johnson AK.Cardiovascular alterations and autonomic imbalance in an experimental model of depression[J].Am J Physiol Regul Integr Comp Physiol,2002,282(5):R1 333-R1 341.
[6] 郝吉莉,周兰兰.黄蜀葵总黄酮对脑卒中后抑郁大鼠下丘脑CRF表达的影响[J].安徽医药,2009,13(9):1 025-1 027.
[7] Morris RGM.Spatial localization does not require the presence of local cues[J].Lea Mot,1981,12(2):239-260.
[8] Bauman AL,Apparsundaram S,Ramamoorthy S,et al.Cocaine and antidepressant-sensitive biogenic amine transporters exist in regulated complexes with protein phosphatase 2A[J].J Neurosci,2000,20(20):7 571-7 578.
[9] Gonzalez MM,Aston-Jones G.Light deprivation damages monoamine neurons and produces a depressive behavioral phenotype in rats[J].Proc Natl Acad Sci U S A,2008,105(12):4 898-4 903.
[10]Metzler M,Gan L,Mazarei G,et al.Phosphorylation of huntingtin at Ser421 in YAC128 neurons is associated with protection of YAC128 neurons from NMDA-mediated excitotoxicity and is modulated by PP1 and PP2A[J].J Neurosci,2010,30(43):14 318-14 329.
[11]Feng P,Guan Z,Yang X,et al.Impairments of ERK signal transduction in the brain in a rat model of depression induced by neonatal exposure of clomipramine[J].Brain Res,2003,991(1-2):195-205.
[12]Saraf A,Oberg EA,Strack S.Molecular determinants for PP2A substrate specificity:charged residues mediate dephosphorylation of tyrosine hydroxylase by the PP2A/B′ regulatory subunit[J].Biochemistry,2010,49(5):986-995.
[13]Sunahori K,Nagpal K,Hedrich CM,et al.The catalytic subunit of protein phosphatase 2A(PP2Ac) promotes DNA hypomethylation by suppressing the phosphorylated mitogen-activated protein kinase/extracellular signal-regulated kinase(ERK)kinase(MEK)/phosphorylated ERK/DNMT1 protein pathway in T-cells from controls and systemic lupus erythematosus patients[J].J Biol Chem,2013,288(30):21 936-21 944.
[14]Hales EC,Orr SM,Larson Gedman A,et al.Notch1 receptor regulates AKT protein activation loop(Thr308) dephosphorylation through modulation of the PP2A phosphatase in phosphatase and tensin homolog(PTEN)-null T-cell acute lymphoblastic leukemia cells[J].J Biol Chem,2013,288(31):22 836-22 848.
[15]宋 哲,薛 超,张小曼,等.脂联素通过激活PP2A减轻H2O2诱导的SH-SY5Y细胞损伤及tau蛋白过度磷酸化[J].中国病理生理杂志,2015,31(2):207-212.
[16]Lou H,Montoya SE,Alerte TN,et al.Serine 129 phosphorylation reduces the ability of alpha-synuclein to regulate tyrosine hydroxylase and protein phosphatase 2A in vitro and in vivo[J].J Biol Chem,2010,285(23):17 648-17 661.
[17]Liu Q,Hofmann PA.Protein phosphatase 2A-mediated cross-talk between p38 MAPK and ERK in apoptosis of cardiac myocytes[J].Am J Physiol Heart Circ Physiol,2004,286(6):H2 204-H2 212.
[18]Cole AR.Glycogen synthase kinase 3 substrates in mood disorders and schizophrenia[J].FEBS J,2013,280(21):5 213-5 227.
[19]Van Kanegan MJ,Adams DG,Wadzinski BE,et al.Distinct protein phosphatase 2A heterotrimers modulate growth factor signaling to extracellular signal-regulated kinases and Akt[J].J Biol Chem,2005,280(43):36 029-36 036.
[20]Giese KP.GSK-3:a key player in neurodegeneration and memory[J].IUBMB Life,2009,61(5):516-521.
[21]Karege F,Perroud N,Burkhardt S,et al.Alteration in kinase activity but not in protein levels of protein kinase B and glycogen synthase kinase-3 beta in ventral prefrontal cortex of depressed suicide victims[J].Biol Psychiatry,2007,61(2):240-245.
[22]Oh DH,Park YC,Kim SH.Increased glycogen synthase kinase--3β mRNA level in the hippocampus of patients with major depression:a study using the stanley neuropathology consortium integrative database[J].Psychiatry Investig,2010,7(3):202-207.
Efficacy and mechanism of down-regulation of protein phosphatase 2A activity for improving symptoms of rats with depression
MENGBin,RENDing,WANGKai-hua,ZHOUXin-mei
(DepartmentofNeurology,RuikangHospitalAffiliatedtoGuangxiUniversityofChineseMedicine,Nanning530011,China)
Objective To explore the efficacy and mechanism of down-regulation of protein phosphatase 2A(PP2A) activity for improving the symptoms of rats with depression.Methods Thirty rat models of depression were established by chronic unpredictable mild stress.And the rats were divided into control group A,control group B,low-concentration Okadaic acid(OA) group,medium-concentration OA group,high-concentration OA group and the optimal concentration OA group,with 5 rats in each group.The PP2A activity was detected in the control group A,control group B,low-concentration OA group,medium-concentration OA group and high-concentration OA group to screen the optimal concentration of OA.The control group A and control group B were injected with 5 μl sterile normal saline into cella lateralis.The low-concentration OA group,medium-concentration OA group and high-concentration OA group were injected into cella lateralis with 5 μl OA at the concentrations of 5 nmol/L,10 nmmol/L and 20 nmol/L respectively,and the optimal concentration OA group with 5 μl OA at the optimal concentration.The praxiology tests including the consumption of sucrose solution,open-field test,weight and Morris water maze were conducted in the control group B and the optimal concentration OA group.And the levels of noradrenaline(NE),5-hydroxytryptamine(5-HT) and cortsol(CORT),the levels of the protein and phosphorylation of tyrosine hydroxylase(TH),extracellular signal-regulated kinase(ERK),serine/threonine protein kinase(AKT) and glycogen synthase kinase 3β(GSK-3β) in brain tissues were detected in the control group B and the optimal concentration OA group.Results The activity of PP2A decreased with the increase of OA concentration(P<0.05),and the 20 nmol/L OA group was defined as the optimal concentration OA group.The horizontal and vertical scores of open-field test in the optimal concentration OA group were higher than those in the control group B(P<0.05).In the optimal concentration OA group,the consumption of sucrose solution and weight increased,and latent period of Morris water maze was shorter over time(P<0.05).Compared to the control group B,the consumption of sucrose solution and weight increased,and latent period of Morris water maze was shorter in the optimal concentration OA group on the 8th,15th and 22nd day after drug administration(P<0.05).The levels of NE,5-HT,TH protein,ERK protein and AKT protein,and phosphorylation levels of TH,ERK,AKT and GSK-3β in the optimal concentration OA group were higher than those in the control group B(P<0.05).The levels of CORT and GSK-3β protein in the optimal concentration OA group were lower than those in the control group B(P<0.05).Conclusion The activity of PP2A reduces with the increase of OA concentration. Down-regulation of PP2A activity might improve the symptoms of rats with depression by adjusting the signal pathways of TH,ERK and AKT/GSK-3β.
Depression,Protein phosphatase A,Glycogen synthase kinase 3β,Tyrosine hydroxylase,Extracellular signal-regulated kinase,Rat
广西自然科学基金(2012GXNSFAA053076);广西自然科学基金青年基金(2012GXNSFBA053082)
蒙冰(1978~),女,硕士研究生,主治医师,研究方向:神经系统疾病的防治。通信作者:任丁(1959~),男,本科,主任医师,硕士研究生导师,研究方向:神经系统疾病的中西医结合防治,E-mail:Dingren2006@163.com。
R 749.42
A
0253-4304(2016)05-0605-06
10.11675/j.issn.0253-4304.2016.05.02
2016-01-19
2016-04-14)
