原花青素B2及黄曲霉毒素B1对人胚胎肝细胞细胞色素P450亚酶1A2、3A4活力及基因表达的影响▲
2016-02-17范秋玉马玲玲肖德强黄东萍刘丹丹邓祥发张勇胜
范秋玉 马玲玲 肖德强 黄东萍 贾 亮 刘丹丹 邓祥发 潘 剑 张勇胜 鲁 力
(1 广西医科大学公共卫生学院,南宁市 530021,E-mail:1220514140@qq.com;2 广西壮族自治区疾病预防控制中心营养与学校卫生所,南宁市 530021;广西医科大学3 护理学院,4 基础医学院,南宁市 530021;5 广西医科大学一附院营养科,南宁市 530021)
论著·基础研究
原花青素B2及黄曲霉毒素B1对人胚胎肝细胞细胞色素P450亚酶1A2、3A4活力及基因表达的影响▲
范秋玉1马玲玲1肖德强1黄东萍1贾 亮2刘丹丹3邓祥发4潘 剑4张勇胜5鲁 力1
(1 广西医科大学公共卫生学院,南宁市 530021,E-mail:1220514140@qq.com;2 广西壮族自治区疾病预防控制中心营养与学校卫生所,南宁市 530021;广西医科大学3 护理学院,4 基础医学院,南宁市 530021;5 广西医科大学一附院营养科,南宁市 530021)
目的 探讨原花青素B2(PC-B2)与黄曲霉毒素B1(AFB1)对人胚胎肝细胞L-02细胞色素P450(CYP)亚酶1A2、3A4活力及其基因表达的影响。方法 L-02细胞体外培养后分空白对照、溶剂对照、AFB1染毒、PC-B2处理和PC-B2干预共5组,其中PC-B2处理分为3个亚组,分别采用3、10、30 μg/ml PC-B2干预,PC-B2干预分为3各亚组,分别采用3、10、30 μg/ml PC-B2预处理12 h后,再加不同浓度PC-B2与AFB1干预24 h。测定各组细胞的CYP1A2、CYP3A4酶活力以及CYP1A2、CYP3A4基因的mRNA表达水平;测定细胞存活率,倒置荧光显微镜观察细胞形态。结果 与空白对照组相比,AFB1染毒组细胞存活率降低(P<0.05),胞膜结构不清,漂浮细胞增多,CYP1A2、CYP3A4酶活力及其mRNA表达水平明显升高(P<0.05)。与空白对照组相比,3、10 μg/ml PC-B2处理组细胞相关指标无明显变化,但30 μg/ml PC-B2处理组的细胞存活率升高,CYP1A2、CYP3A4酶活力下降(P<0.05)。与AFB1染毒比较,30 μg/ml PC-B2干预组的细胞存活率升高(P<0.05),各浓度PC-B2干预组的细胞CYP1A2、CYP3A4酶活力及基因表达均降低(P<0.05),且干预浓度越高,CYP1A2、CYP3A4酶活力及基因表达越低(P<0.05)。结论 AFB1能明显诱导肝细胞CYP1A2、CYP3A4酶活力及其mRNA表达,促使肝细胞凋亡,PC-B2干预可促进肝细胞生长并抑制上述CYP二个亚酶的活力及其基因表达,提示PC-B2可能通过抑制I相代谢酶CYP对AFB1的活化而对肝细胞有良好保护作用。
原花青素B2; 黄曲霉毒素B1; 人胚胎肝细胞;细胞色素P450酶
黄曲霉毒素(aflatoxin,AFT)被世界卫生组织癌症研究机构划定为I类致癌物,是一种毒性极强的剧毒物质。AFT主要污染粮油食品、动植物食品等,尤其在我国南方,由于其地理气候条件,食物如玉米、花生、大米及其制品更易受黄曲霉毒素B1(aflatoxin B1,AFB1)污染[1-2]。AFT的危害性在于对人及动物的肝脏组织有明显破坏作用,严重时可导致肝癌甚至死亡[3]。AFB1为前致癌物,在人体内可代谢活化为终致癌物,其代谢过程受各种代谢酶功能状态的影响[4]。原花青素广泛存在于葡萄籽、柏树、松树、银杏中,近年来,已有研究表明原花青素具有多种生物活性,对酒精、对乙酰氨基酚等多种化学物质引起的肝损伤均具有一定保护作用[5-6]。进一步研究原花青素对AFB1所致的肝损伤是否具有干预作用及其机制,对于AFB1高污染地区人群的肝癌预防有重要意义。
1 材料与方法
1.1 主要材料 原花青素B2(procyanidin B2,PC-B2)、AFB1、二甲基亚砜(dimethyl sulfoxide,DMSO)(美国Sigma公司);人胚胎肝细胞L-02(华中科技大学);RPIM 1640培养液、胎牛血清(美国Gibco公司);GENMED细胞色素P450(cytochrome P450,CYP)亚酶1A2和3A4活性荧光定量检测试剂盒(上海杰美基因,批号:1-423517-10、8-251531-10);RNAiso Plus、PrimeScript RT reagent Kit with gDNA Eraser试剂盒和SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)(日本Takara,批号:AA1302-1、AK3001、AK6801)。
1.2 细胞培养及实验分组 (1)复苏L-02细胞,用含10%胎牛血清和1%青链霉素混合液的RPMI-1640培养基,于37℃、5% CO2条件下培养,正常培养3代后,用于后续实验。(2)细胞分组处理:将细胞分为空白对照组、AFB1染毒组、PC-B2处理组(包括3、10、30 μg/ml PC-B2 3个亚组)及PC-B2干预组(包括3、10、30 μg/ml PC-B2 3个亚组),同时设置溶剂对照组(0.5% DMSO)。AFB1染毒组细胞用含30 μg/ml AFB1的培养基孵育24 h;PC-B2处理组分别用含3、10、30 μg/ml PC-B2的培养基孵育24 h;PC-B2干预组先分别用含3、10、30 μg/ml PC-B2的培养基孵育12 h,磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗后,再加相应浓度PC-B2与30 μg/ml AFB1共孵育24 h。孵育在37℃、5% CO2的培养箱中进行。
1.3 四甲基偶氮唑盐法测定细胞存活率 取对数生长的细胞,以5×104/ml的浓度接种于96孔板,每孔100 μl,待细胞贴壁后,按实验分组进行处理,各组设5个复孔。培养结束后,先将细胞置于倒置荧光显微镜下观察细胞形态,随后各孔加入10 μl 四甲基偶氮唑盐,孵育4 h后,吸弃原培养液,每孔加入150 μl DMSO,37℃恒温震荡孵育10 min,490 nm波长处用Multiskan GO全波长酶标仪测A值。定义空白对照组细胞存活率为100%,其余各组细胞存活率计算公式如下:细胞存活率(%)=A实验组/A空白对照×100%。
1.4 细胞CYP1A2、CYP3A4酶活性测定 (1)样本制备:取对数生长的细胞,接种于25 cm2培养瓶,每瓶4 ml,培养24 h细胞贴壁后,按实验分组进行处理。培养结束后,PBS洗3次,细胞刮刀将细胞刮离下来,PBS稀释细胞悬液,使细胞浓度达到1×106/ml左右。通过反复冻融,以使细胞破坏并放出细胞内成分。3 000 r/m离心20 min,仔细收集上清为待测样品。二喹啉甲酸法测定蛋白浓度,调整蛋白浓度为100~200 μg/100 μl。(2)细胞CYP1A2酶活性测定:按照CYP1A2活性荧光定量检测试剂盒说明书,用荧光酶标仪在激发波长530 nm,散发波长590 nm处测量样品的荧光强度。(3)细胞CYP3A4酶活性测定:实验步骤按照CYP3A4活性荧光定量检测试剂盒说明书,用荧光酶标仪在激发波长410 nm,散发波长538 nm处测量样品的荧光强度。
1.5 细胞CYP1A2、CYP3A4的mRNA表达水平测定 取对数生长的细胞以1×105个/孔的浓度接种于6孔板,待细胞贴壁后,按实验分组进行干预,干预结束后弃去培养液,1×PBS洗3次,各孔加入1 ml RNAiso Plus提取RNA。应用PrimeScript RT reagent Kit with gDNA Eraser试剂盒反转录合成cDNA。应用SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)扩增目的基因。PCR扩增条件:95℃预变性30 s,95℃变性3 s,60℃退火及延伸30 s,进行45个循环。以泛素(ubiquitin,UBC)作为内参照。RNA提取质量及PCR产物进行3%琼脂糖-TBE胶鉴定。PCR引物序列见表1。

表1 PCR引物序列
1.6 统计学分析 应用SPSS 17.0软件进行分析,计量资料以(x±s)表示,采用单因素方差分析,两两比较采用LSD-t法。以P<0.05为差异有统计学意义。
2 结 果
2.1 PC-B2和AFB1对L-02肝细胞存活率及形态的影响 空白对照组正常L-02细胞呈三角形或多边形,贴壁生长,细胞饱满,边界清晰,细胞有重叠性生长,几乎没有脱落。3 μg/ml、10 μg/ml PC-B2处理组细胞形态无明显变化,与空白对照比,30 μg/ml PC-B2处理组细胞存活率升高(P<0.05),约升高11.8%。用30 μg/ml AFB1染毒24 h后,细胞密度减小,胞膜结构不清,培养基中漂浮细胞增多,L-02细胞存活率较空白对照组降低(P<0.05),约降低31%。3 μg/ml、10 μg/ml、3 010 μg/ml的PC-B2处理组细胞存活率均高于空白对照组及溶剂对照组(P<0.05),提示PC-B2干预后能提高细胞存活率;且30 μg/ml PC-B2干预组细胞存活率高于AFB1染毒组(P<0.05)。见表2及图1。

表2 各组细胞存活率比较(x±s,%)
注:与空白对照组比较,aP<0.05;与溶剂对照组比较,bP<0.05;与AFB1染毒组比较,cP<0.05。

2.2 PC-B2和AFB1对L-02肝细胞CYP1A2、CYP3A4酶活性的影响 与空白对照组相比,PC-B2处理组CYP1A2、CYP3A4酶活力均有降低,但仅30 μg/ml浓度处理组差异有统计学意义(P<0.05)。30 μg/ml AFB1染毒组L-02细胞CYP1A2、CYP3A4酶活力较空白对照组及溶剂对照组明显升高(P<0.05),而PC-B2干预组CYP1A2、CYP3A4酶活力AFB1染毒组降低(P<0.05),且随干预浓度增大,酶活性越低(P<0.05)。见表3。 注:A 空白对照组;B 3 μg/ml PC-B2处理组;C 10 μg/ml PC-B2处理组;D 30 μg/ml PC-B2处理组:E 溶剂对照组;F 30 μg/ml AFB1染毒组;G 3 μg/ml PC-B2干预组;H 10 μg/ml PC-B2干预组;I 30 μg/ml PC-B2干预组。

图1 各组L-02细胞形态学观察(40×)
注:与空白对照组比较,aP<0.05;与溶剂对照组比较,bP<0.05;与AFB1染毒组比较,cP<0.05;#各浓度PC-B2干预组两两比较,P均<0.05。
2.3 PC-B2和AFB1对L-02肝细胞CYP1A2、CYP3A4基因表达的影响 与空白对照组及溶剂对照组比较,AFB1作用24 h后L-02细胞CYP1A2、CYP3A4基因表达升高(P<0.05)。PC-B2干预组细胞CYP1A2、CYP3A4基因表达较AFB1染毒组明显降低,且随PC-B2干预浓度CYP1A2、CYP3A4基因表达越低(P<0.05)。PC-B2处理组基因表达水平有所升高,但差别无统计学意义(P>0.05)。见表4。
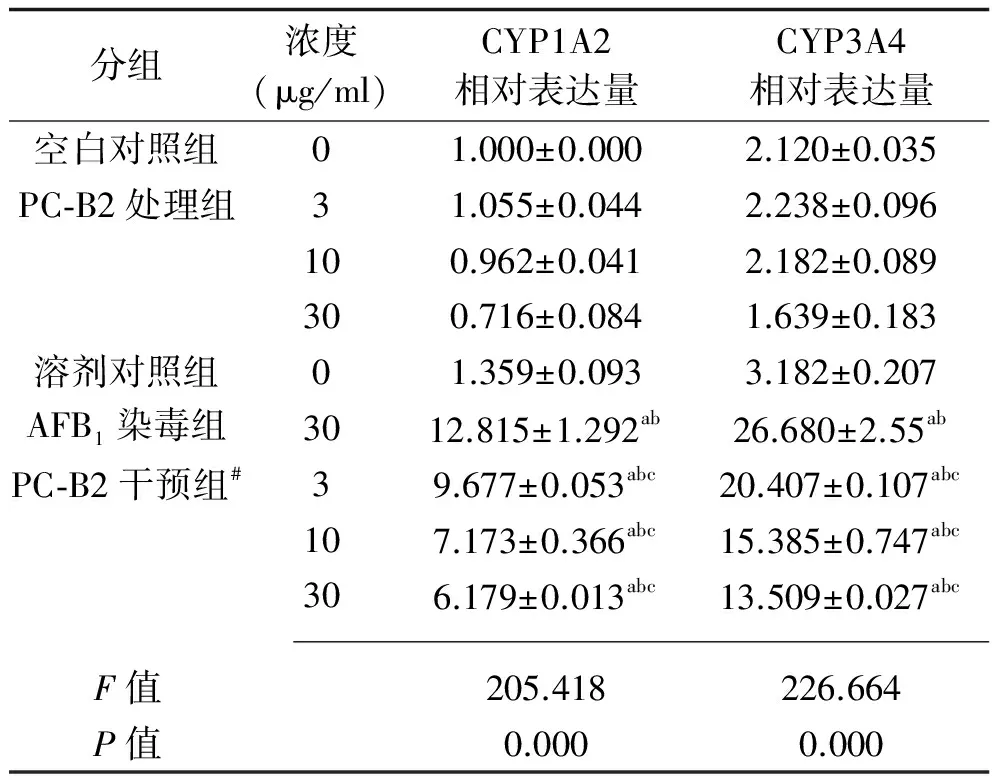
表4 PC-B2和AFB1对L-02肝细胞CYP1A2、CYP3A4基因表达的影响(n=2,x±s)
注:与空白对照组比较,aP<0.05;与溶剂对照组比较,bP<0.05;与AFB1染毒组比较,cP<0.05;#各浓度PC-B2干预组两两比较,P均<0.05。
3 讨 论
AFB1为前致癌物,在没有经过代谢活化之前无致癌性,它须通过体内的生物转化形成活性中间体才具有致癌性。AFB1的代谢活化主要发生在肝脏,通过I相代谢的主要酶系CYP的代谢形成有毒性和致癌性的AFB1-8,9-环氧化物(AFB1-8,9-epoxide,AFBO)。CYP有多个亚族,促进AFB1代谢形成AFBO最重要的CYP亚酶是CYP1A2和CYP3A4[7-8],它们在肝脏中含量不仅多且活性高,同时,CYP还可被多种化学物质诱导表达,使其代谢活性进一步增强。
近年对食物中活性成分的研究结果显示,很多植物化学物具有多种生物学功能[9],天然食品中某些活性成分通过调节CYP活性而产生的防癌作用也逐步引起人们的关注。郑海平等[10]用银杏叶提取物EGb761干预AFB1诱发大鼠肝癌的过程,结果表明EGb761可抑制大鼠肝组织CYP3A4活性,从而减少前致癌物的代谢活化,降低AFB1致癌性及其化学性肝损伤达到保护肝脏的作用。原花青素是一种在植物中广泛存在的多酚类化合物,对酒精、CCl4等多种外源性物质引起的肝细胞损伤有一定保护作用[5,11]。本次实验结果显示,低、中两个剂量PC-B2单纯处理对肝细胞存活率及CYP酶活力未见有明显影响,而高剂量PC-B2处理能明显增加肝细胞存活率、降低CYP1A2和CYP3A4酶活力(P<0.05),相应基因表达有所下降,但差别无统计学意义。这提示原花青素PC-B2具有良好的保护肝细胞的作用,可促进肝细胞生长。而采用AFB1染毒后肝细胞CYP1A2、CYP3A4酶活力及基因表达均升高(P<0.05),提示AFB1在肝细胞内代谢,这可致AFBO形成增多,同时培养基中漂浮细胞增多,细胞密度减小,胞膜结构不清,也提示肝细胞出现损伤。同时本实验以原花青素中活性最强的PC-B2干预L-02细胞CYP酶对AFB1的活化,结果显示PC-B2干预后细胞存活率有所恢复,凋亡细胞减少,CYP1A2、CYP3A4酶活力及基因表达相较AFB1染毒组明显降低(P<0.05),且随PC-B2干预浓度增大作用越明显。由此可见,PC-B2可能抑制或延缓AFB1诱导肝细胞损伤的进程。
综上所述,AFB1能明显诱导肝细胞CYP1A2、CYP3A4酶活力及其mRNA表达,促使肝细胞凋亡;PC-B2干预可促进肝细胞生长并抑制上述CYP两个亚酶的活力及其基因表达。这提示PC-B2可能通过抑制Ⅰ相代谢酶CYP对AFB1的活化而对肝细胞有良好保护作用。
[1] 刘 辉,张 燕,熊 波,等.食用油中黄曲霉毒素B1的污染调查[J].广东化工,2015,42(4):29-30.
[2] 张维蔚,何洁仪,李迎月,等.2009-2013年广州市市售粮油食品黄曲霉毒素B1调查[J].中国食品卫生杂志,2015,27(3):291-294.
[3] 方宁烨,刘丹丹,肖德强,等.黄曲霉毒素B1致体外人胚肝细胞DNA损伤的初步研究[J].应用预防医学,2012,18(4):200-203.

[5] 陈 欢,马 磊,黄 茹,等.原花青素在对乙酰氨基酚诱导的急性肝损伤中的保护作用及机制[J].重庆医科大学学报,2015,40(3):358-361.
[6] 王 萌,马艺萍,李亚伟,等.葡萄籽寡聚体原花青素对大鼠酒精性肝损伤及脑功能障碍的保护作用[J].世界华人消化杂志,2013,21(16):1 480-1 486.
[7] 蒿艳蓉,苏建家.黄曲霉毒素B1(AFB1)体内代谢研究进展[J].现代预防医学,2009,36(1):146-149.
[8] Gallagher EP,Wienkers LC,Stapleton PL,et al.Role of human microsomal and human complementary DNA-expressed cytochromes P4501A2 and P4503A4 in the bioactivation of aflatoxin B1[J].Cancer Res,1994,54(1):101-108.
[9] Gross-Steinmeyer K,Eaton DL.Dietary modulation of the biotransformation and genotoxicity of aflatoxin B1[J].Toxicology,2012,299(2-3):69-79.
[10]郑海平,欧 超,曹 骥,等.银杏叶提取物对AFB1诱发大鼠肝癌过程中CYP3A4活性的影响[J].时珍国医国药,2012,23(7):1 656-1 658.
[11]邹金发,刘晓光,齐凤杰,等.葡萄籽原花青素减轻小鼠急性化学性肝损伤[J].基础医学与临床,2012,32(10):1 198-1 201.
Effects of procyanidin B2 and aflatoxin B1on activity and gene expressions of cytochrome P450 1A2 and 3A4 in human embryonic stem cells
FANQiu-yu1,MALing-ling1,XIAODe-qiang1,HUANGDong-ping1,JIALiang2,LIUDan-dan3,DENGXiang-fa4,PANJian4,ZHANGYong-sheng5,LULi1
(1SchoolofPublicHealth,GuangxiMedicalUniversity,Nanning530021,China;2NutritionandSchoolHealth-Center,GuangxiCenterforDiseasePreventionandControl,Nanning530021,China;3SchoolofNursing,4SchoolofBasicMedicine,GuangxiMedicalUniversity,Nanning530021,China;5DepartmentofNutrition,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Objective To investigate the effects of procyanidin B2(PC-B2) and aflatoxin B1(AFB1) on the activity and gene expressions of the cytochrome P450(CYP) 1A2 and CYP3A4 in human embryonic stem cells(L-02).Methods After culture in-vitro,L-02 cells were divided into 5 groups including blank control group,solvent control group,AFB1exposure group,PC-B2 exposure group and PC-B2 intervention group.PC-B2 exposure group was divided into 3 subgroups,and these 3 subgroups were treated with PC-B2 with the concentrations of 3,10 and 30 μg/ml separately for 12 hours.PC-B2 intervention group was divided into 3 subgroups,and these 3 subgroups were treated with PC-B2 with the concentrations of 3,10 and 30 μg/ml separately for 12 hours,then were treated with PC-B2 with different concentrations and AFB1for 24 hours.The enzyme activities and mRNA expressions of CYP1A2 and CYP3A were detected in each group.And the survival rate of the cells was also measured.The morphological changes of the cells were observed by fluorescent microscope.Results Compared to blank control group,the cell survival rate decreased(P<0.05),the structure of cytomembrane was unclear and floating cells increased,CYP1A2 and CYP3A4 enzyme activities and mRNA expression levels increased significantly in AFB1exposure group(P<0.05).No significant changes in the indices of 3 μg/ml and 10 μg/ml PC-B2 exposure groups were observed compared to blank control group.But the cell survival rate increased,CYP1A2 and CYP3A4 enzyme activities decreased significantly in 30 μg/ml PC-B2 exposure group compared to blank control group(P<0.05).Compared to AFB1exposure group,the cell survival rate of 30 μg/ml PC-B2 intervention group increased(P<0.05),CYP1A2 and CYP3A4 enzyme activities and mRNA expressions decreased significantly in all PC-B2 intervention groups(P<0.05).And CYP1A2 and CYP3A4 enzyme activities and mRNA expressions decreased with the increase of concentration for intervention(P<0.05).Conclusion AFB1can induce the enzyme activities and mRNA expressions of CYP1A2 and CYP3A4 enzyme,and can promote the apoptosis of hepatic cells.Intervention with PC-B2 can promote the growth of liver cells,and can inhibit the activity and gene expression of the two CYP subenzymes.The results indicate that the protective effect of PC-B2 on hepatic cells might be mediated by inhibiting the activation of AFB1by CYP.
Procyanidin B2,Aflatoxin B1,Human embryonic stem cells,Cytochrome P450 enzyme
国家自然科学基金(31360383)
范秋玉(1986~),女,在读硕士研究生,研究方向:营养与食品卫生。
鲁力(1960~),男,硕士,教授,研究方向:营养与健康、食品安全,E-mail:luligx@163.com。
R 329.2
A
0253-4304(2016)05-0601-04
10.11675/j.issn.0253-4304.2016.05.01
2016-01-26
2016-04-11)
