细菌脂肪酸合成多样性的研究进展
2016-02-13余永红马建荣王海洪
余永红,马建荣,王海洪
(1.广东食品药品职业学院,广东广州510520;2.华南农业大学生命科学学院/广东省农业生物蛋白质功能与调控重点实验室,广东广州510642)
细菌脂肪酸合成多样性的研究进展
余永红1,马建荣1,王海洪2*
(1.广东食品药品职业学院,广东广州510520;2.华南农业大学生命科学学院/广东省农业生物蛋白质功能与调控重点实验室,广东广州510642)
与哺乳动物、真菌采用I型脂肪酸合成系统不同,细菌采用II型脂肪酸合成系统,每步反应都由独立的酶催化,因此细菌脂肪酸合成酶是研究抗菌药物的优良靶标。研究表明,在不同细菌中参与脂肪酸合成的酶都具有较高的多样性,而脂肪酸种类不同,合成方式也不尽相同,本文对此进行了总结。
脂肪酸合成;多样性;不饱和脂肪酸;支链脂肪酸
生物体能以乙酰辅酶A(CoA)作为前体物质,通过聚合、还原、脱水和再还原4步循环反应合成脂肪酸。在哺乳动物、真菌以及分枝杆菌中,这四步反应由多功能蛋白(脂肪酸合酶)的不同结构域催化完成,脂肪酸合酶中一个结构域具有酰基载体蛋白(Acyl carrier protein,ACP)功能,延伸的脂酰链始终与ACP连接,被称作I型脂肪酸合成系统。细菌采用II型脂肪酸合成系统从头合成脂肪酸,其特点是每步生化反应都由独立的酶催化完成[1]。虽然两种途径的化学反应机制相似,但催化酶的蛋白序列和结构迥然不同。研究细菌脂肪酸合成代谢,寻找新的抗菌药物作用靶点,开发新的抗菌药物是微生物学研究的热点领域[2]。本文将综述细菌脂肪酸合成酶以及不同脂肪酸合成的多样性。
1 细菌脂肪酸的合成途径及其功能
以大肠埃希菌(Escherichi coli)作为模式菌株,对Ⅱ型脂肪酸合成系统已进行了深入的研究。在大肠埃希菌中,脂肪酸合成包括起始反应和循环反应两部分,如图1所示。起始反应由乙酰辅酶A羧化酶(Acc)催化乙酰-CoA和二氧化碳(CO2)合成丙二酸单酰-CoA;接着在丙二酸单酰辅酶A:ACP转酰基酶(FabD)的催化下生成丙二酸单酰ACP;然后由3-酮脂酰ACP合成酶III (FabH)催化丙二酸单酰ACP和乙酰-CoA缩合,生成3-酮基丁酰ACP,完成脂肪酸合成起始反应。循环反应中首先由3-酮脂酰ACP合成酶I或II (FabB或FabF)催化脂酰ACP与丙二酸单酰ACP缩合,生成3-酮脂酰ACP;进一步被3-酮脂酰ACP还原酶(FabG)催化,生成3-羟脂酰ACP;然后由3-羟脂酰ACP脱水酶(FabA或FabZ)催化生成烯脂酰ACP;最后被烯酰ACP还原酶(FabI)催化生成新的脂酰ACP,并进入新的循环反应。每一次循环脂酰链增加两个碳原子,直到形成16到18碳链的饱和脂酰ACP[3]。

图1 细菌脂肪酸合成途径[3]Fig.1Fatty acid synthesis in bacteria
脂肪酸是细胞膜的主要组分,细菌通过调节脂肪酸的种类和组成,调节细胞膜的流动性,维持膜的稳定性及正常生理功能,适应不同逆境生长[4]。细菌脂肪酸合成系统提供的3-羟基脂肪酸前体,参与革兰阴性细菌外膜类脂A(lipid A)的合成[5],而类脂A引起致病效应,是免疫细胞识别的相关分子。革兰阴性细菌的群体感应(Quorum sensing,QS)信号分子是脂肪酸衍生物,其中最常见的N-酰基高丝氨酸内酯类(AHLs)是以脂肪酸合成途径中的脂酰ACP和S-腺苷甲硫氨酸为底物合成的[6];扩散信号分子(Diffusible signal factor,DSF)是一类新型QS信号分子,为长链不饱和脂肪酸,也是以脂肪酸合成途径的中间代谢产物为前体合成的[7-8]。脂肪酸还为其他活性物质的合成提供原料,包括硫辛酸(lipoic acid)、生物素[9]、鼠李糖酯[10]、聚羟基脂肪酸(PHA/PHB)等。另外,外源脂肪酸可被细菌吸收利用,通过脂肪酸的β-氧化途径合成大量ATP,为细胞提供大量的能量及小分子前体物质[11]。
2 细菌脂肪酸合成酶的多样性
虽然细菌脂肪酸合成机制高度保守,脂肪酸合成相关酶的蛋白序列具有同源性,但是细菌间也存在着差异,表现出较高的多样性。
2.1 长链3-酮脂酰ACP合成酶的多样性
长链3-酮脂酰ACP合成酶分I和II两种类型,在不同细菌中长链3-酮脂酰ACP合成酶的种类和酶学特性存在差异,表现出较为复杂的多样性。
大肠埃希菌含有2种典型的长链3-酮脂酰ACP合成酶:FabB(3-酮脂酰ACP合成酶I)和FabF(3-酮脂酰ACP合成酶II)。研究表明这2种酶都具有催化饱和脂肪酸合成的能力,但在不饱和脂肪酸合成中表现出明显的差异。FabB负责不饱和脂肪酸的从头合成,主要产生棕榈油酰ACP,而FabF受温度调控,负责棕榈油酰ACP的延伸,形成顺-11-十八烯酰ACP,用于调节膜磷脂中脂肪酸组成。植物病原菌野油菜黄单胞菌(Xanthomonas campestris)中也具有类似功能的同源蛋白FabB和FabF1,而FabF2不参与脂肪酸合成[12]。
嗜血流感细菌(Haemophilus influenzae)仅有3-酮脂酰ACP合成酶I:FabB。研究发现FabB参与该菌不饱和脂肪酸的从头合成,但不具有延伸棕榈油酰ACP形成顺-11-十八烯脂酰ACP的能力。茄科雷尔氏菌(Ralstonia solanacearum)[3]、乳酸乳球菌(Lactococcus lactis)、丙酮丁醇梭菌(Clostridium acetobutylicium)[13]、粪肠球菌(Enterococcus faecalis)基因组中都没有FabB同源蛋白,但其FabF同源蛋白都具有3-酮脂酰ACP合成酶I和II的双功能。但这一现象并不普遍,马金成等[14]研究了枯草芽胞杆菌(Bacillus subtilis)、中华苜蓿根瘤菌(Sinorhizobiummeliloti)、霍乱弧菌(Vibrio cholera)和铜绿假单胞菌(Pseudomonas aeruginosa)来源的FabF同源蛋白,结果显示只有铜绿假单胞菌FabF2具有类似于大肠埃希菌FabB和FabF的双功能,而其他的FabF都不具有3-酮脂酰ACP合成酶I的活性。
2.23 -酮脂酰ACP合成酶III的多样性
3-酮脂酰ACP合成酶III(FabH)催化脂肪酸合成的起始步骤,是细菌脂肪酸合成的关键酶,已成为重要的抗菌药物筛选靶点[2]。不同种属的FabHs都含有Cys-His-Asn催化三联体结构,但其酰基结合口袋大小和性状不同,使得FabH对不同链长的脂酰-CoA具有底物特异性。其中大肠埃希菌FabH仅对乙酰-CoA活性高,枯草芽胞杆菌FabH对支链脂酰-CoA活性高,对C4~C8的脂酰-CoA也有活性,结核分枝杆菌(Mycobacterium tuberculosis)FabH对长链(C10~C16)脂酰-CoA活性较高,而对短链脂酰-CoA没有活性。
铜绿假单胞菌基因组中没有fabH同源基因,但能利用FabY(PA5174)催化脂肪酸合成起始。FabY的结构与3-酮脂酰ACP合成酶I和II类似,但能催化乙酰-CoA与丙二酸单酰ACP缩合,催化脂肪酸起始反应。FabY对丁酰-CoA和己酰-CoA也具有活性,但不能利用长链脂酰-CoA进行脂肪酸的合成[15]。另外,铜绿假单胞菌编码的PA3286也具有3-酮脂酰ACP合成酶III的活性。PA3286具有FabH结构域,但其分子量比FabH大,能利用中长链脂酰-CoA(辛脂酰-CoA等)起始脂肪酸的合成。研究认为,PA3286是铜绿假单胞菌中连接脂肪酸分解代谢和合成代谢的桥梁[16]。
茄科雷尔氏菌基因组中除编码大肠埃希菌FabH同源蛋白RsFabH之外,还编码新型3-酮脂酰ACP合成酶III——RsFabW。RsFabW是PA3286同源蛋白,但能利用中短链(C2~C10)脂酰-CoA起始脂肪酸合成。另外,RsFabW还能催化脂酰ACP(C4-ACP~C8-ACP)与丙二酸单酰-ACP缩合,合成新的脂肪酸链,推测RsFabW在茄科雷尔氏菌的脂肪酸合成中发挥特殊作用[17]。
2.3 烯脂酰ACP还原酶的多样性
烯脂酰ACP还原酶催化反-2-烯脂酰ACP还原生成饱和脂肪酸,是脂肪酸合成循环的最后一步反应,也是脂肪酸合成调节的关键步骤,因此该酶也是抗菌药物筛选的重要靶点。目前已经发现的烯脂酰ACP还原酶有4种类型,不同类型的酶学特征存在差异,表现出较为复杂的多样性(如表1)。

表1 不同类型的烯脂酰ACP还原酶比较Table 1Comparison of different types of enoyl-ACP reductase
2.3.1 烯脂酰ACP还原酶I(FabI)FabI是最早发现的烯脂酰ACP还原酶。许多细菌都编码FabI,序列上有较高的相似性(>40%),都含有保守的Tyr-(Xaa)6-Lys催化活性中心序列。FabI催化活性依赖于辅因子NADH,受到三氯生等抑制。流产布氏杆菌基因组中有2个fabI同源基因,所编码蛋白都具有催化活性中心Tyr-(Xaa)6-Lys序列,体内、体外酶学分析都表现出烯脂酰ACP还原酶活性,参与细菌脂肪酸合成[18]。
2.3.2 烯脂酰ACP还原酶II(FabK)FabK是在肺炎链球菌(Streptococcus pneumoniae)中发现的。FabK与大肠埃希菌FabI没有序列同源性,是包含FAD的NADH依赖的烯脂酰ACP还原酶,活性不被三氯生抑制[19]。粪肠球菌同时编码FabI和FabK,但fabK基因缺陷株能正常生长,说明FabK在脂肪酸合成过程作用不大,主要用于调节脂肪酸的组成,同时FabK也不是粪肠球菌对三氯生耐受的原因[19]。
2.3.3 烯脂酰ACP还原酶III(FabL)枯草芽胞杆菌不仅编码FabI,还编码另一种烯脂酰ACP还原酶FabL,其序列与大肠埃希菌FabI相似度较低,但具有相同的催化活性中心Tyr-(Xaa)6-Lys。FabL对三氯生耐受(>2 000 μg/mL),催化反应以NADPH为辅因子[20]。
2.3.4 烯脂酰ACP还原酶IV(FabV)第4种烯脂酰ACP还原酶FabV是从霍乱弧菌中发现的[21]。FabV与FabI、FabL类似,都属于短链脱氢酶(SDR)家族,以NADH为催化辅因子。但FabV与FabI、FabL序列相似性很低,催化活性中心也不同(Tyr-(Xaa)8-Lys)[22]。铜绿假单胞菌基因组编码FabI和FabV,而FabV是其对三氯生高度耐受(>2 000 μg/mL)的原因[23]。同时铜绿假单胞菌FabV影响QS信号分子的合成,与细胞黏附、致病力等紧密相关,认为是控制铜绿假单胞菌感染的重要靶点[24]。
2.43 -酮脂酰ACP还原酶的多样性
3-酮脂酰ACP还原酶(FabG)催化酮脂酰ACP还原为3-羟脂酰ACP,是脂肪酸合成的关键还原反应。细菌中FabG高度保守,认为是重要的药物作用靶点,但3-酮脂酰ACP还原酶的多样性报道较少。在中华苜蓿根瘤菌中,与节瘤相关的基因簇中nodG基因与大肠埃希菌fabG同源,体外活性研究显示其编码产物具有FabG活性,但体内需过表达nodG才能代替fabG(未发表数据)。同源性分析发现,茄科雷尔氏菌基因组中含有多个fabG同源基因,体外酶活测定结果显示其编码产物都具有酮脂酰ACP还原酶活性,但只有FabG1参与菌体脂肪酸的合成,其他基因的生物功能还不清楚。野油菜黄单胞菌中也有多个大肠埃希菌fabG的同源基因,异体遗传互补和体外活性检测结果显示,其编码产物具有3-酮脂酰ACP还原酶活性,但在脂肪酸合成中的具体功能还有待研究。
3 不饱和脂肪酸合成的多样性
不饱和脂肪酸(UFA)具有较低的熔点,其相对含量直接影响细胞膜的物理性质,是细菌细胞调节膜流动性的重要分子。不同细菌也采用不同的方式合成不饱和脂肪酸,主要分为厌氧途径和需氧途径。
3.1 不饱和脂肪酸合成的厌氧途径
大肠埃希菌采用厌氧途径合成不饱和脂肪酸,由3-羟基癸脂酰ACP脱水异构酶(FabA)和3-酮脂酰ACP聚合酶I(FabB)2个关键酶参与。脂肪酸合成循环反应中3-羟基癸脂酰ACP被FabA脱水异构生成顺-3-癸烯脂酰ACP,该产物不能被FabI催化,从而跳过还原步骤,直接在FabB催化下进入下个循环反应,最终保留双键形成棕榈油酸(C16:1)或顺型异油酸(C18:1) (如图2)。
但FabA-FabB途径仅存在于变形杆菌(Proteobacteria)α和γ类群中,而在革兰阳性菌如链球菌、梭菌基因组中没有fabA-fabB同源基因。在乳酸乳球菌中,FabZ1类似于大肠埃希菌FabA,具有脱水异构功能,是不饱和脂肪酸合成的关键酶,而FabZ2类似于FabZ只有脱水功能[25]。在粪肠球菌中,FabZ1类似于FabZ,但具有3-羟基癸脂酰ACP脱水酶和异构酶的双重活性,FabF1则将顺-3-癸烯酰ACP延伸,合成不饱和脂肪酸(如图2)。肺炎链球菌编码的反-2-顺-3-烯酰ACP异构酶FabM,能将由FabZ催化脱水产生的反-2-癸烯酰ACP异构化,生成顺-3-癸烯酰ACP,进一步在FabF催化下延伸合成不饱和脂肪酸(如图2)。
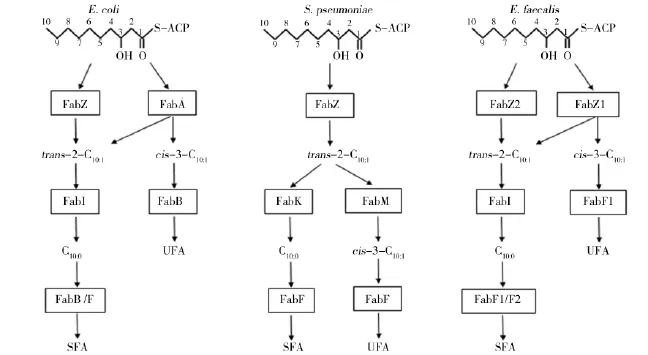
图2 大肠埃希菌、肺炎链球菌、粪肠球菌不饱和脂肪酸合成的多样性Fig.2The variations of UFA synthesis in E.coli,S.pneumoniae and E.faecalis
绿浅气球菌(Aerococcus viridans)中只有一个fabA/fabZ的同源基因fabQ,在不饱和脂肪酸合成中FabQ还具有异构化功能。体内和体外实验都证明,在FabQ和FabF共同作用下,顺-3-月桂烯酰ACP被进一步延伸,最终合成不饱和脂肪酸。当合成过程中3-羟基脂酰ACP再次在FabQ作用下脱水、异构,并在大肠埃希菌FabB催化下聚合延伸,从而生产多不饱和脂肪酸,提供了一种在细菌中合成多不饱和脂肪的途径[26]。
3.2 不饱和脂肪酸合成的需氧途径
细菌中不饱和脂肪酸合成的需氧途径最早是在枯草芽胞杆菌中报道的。通过冷诱导枯草芽胞杆菌的脱饱和酶基因desA表达,使膜磷脂中棕榈酸Δ5位脱饱和,生成顺-5-十六烯酸,提高不饱和脂肪酸含量。铜绿假单胞菌有2条不饱和脂肪酸合成的需氧途径——DesA和DesB,其中DesA能催化膜磷脂中2位脂肪酸发生脱饱和(Δ9),生成不饱和脂肪酸;DesB是一个诱导型的脂酰-CoA脱饱和酶(Δ9),其表达受到DesT的调节抑制[27]。
蜡样芽胞杆菌(Bacillus cereus)合成Δ5、Δ10不饱和脂肪酸,以及Δ5Δ10双不饱和脂肪酸,编码两种脂酰-酯脱饱和酶DesA(BC2983,Δ5)和DesB(BC0400,Δ10)。其中DesA以铁氧化蛋白和黄素氧化蛋白(Fld)为电子供体,而DesB以Fld为电子供体,低温处理诱导desA和desB基因的表达,可提高不饱和脂肪酸含量[28]。苜蓿中华根瘤菌编码脱饱和酶SmDesA,能将饱和脂肪酸脱饱和,但SmDesA参与的脱饱和途径可能是苜蓿中华根瘤菌不饱和脂肪酸合成的补偿途径,但在应对逆境胁迫和共生结瘤中具有重要的生物学功能[29]。
4 支链脂肪酸合成的多样性
支链脂肪酸含有末端甲基,影响磷脂堆积,降低分子间范德华力及细胞膜相变温度,因此改变细胞膜中支链脂肪酸含量是一些细菌应对低温等逆境的常用方式。
研究表明,细菌能否合成支链脂肪酸,与其脂肪酸合成系统中3-酮脂酰ACP合成酶III(FabH)的底物专一性有关。大肠埃希菌FabH对乙酰-CoA具有很高的活性,而对支链脂酰-CoA没有活性,最终只合成直链脂肪酸而不合成支链脂肪酸(如图3)。但枯草芽胞杆菌FabH对乙酰-CoA活性不高,而对支链脂酰-CoA前体(包括异丁酰-CoA、异戊酰-CoA和2-甲基丁酰-CoA)活性高,最终合成大量的支链脂肪酸,而直链脂肪酸含量很低(如图3)。革兰阳性细菌如天蓝色链霉菌、金黄色葡萄球菌以及单增李斯特菌的FabHs也都具有类似的底物选择性,因此最终主要合成支链脂肪酸[30]。

图3 支链脂肪酸与直链脂肪酸合成前体的差别Fig.3Different primers for branched and straight-chain fatty acids biosynthesis
支链脂肪酸的合成还与支链脂酰-CoA前体的产生有关。支链氨基酸(缬氨酸、亮氨酸和异亮氨酸)在支链氨基酸氨基转移酶催化下,生成相应的α-酮基支链羧酸,进一步在脱氢酶催化下生成支链脂酰-CoA,用于支链脂肪酸的合成。变异链球菌(Streptococcus mutans)中氨基转移酶失活后,影响菌体的生长和支链脂肪酸的合成[31]。
5 问题与展望
经过几十年的研究,细菌脂肪酸的合成机制已基本清晰。关于不同细菌间脂肪酸合成代谢多样性的报道也越来越多,引起研究者的重视,尤其是致病性细菌的脂肪酸合成代谢多样性已成为研究热点。
细菌脂肪酸合成代谢调控也是未来重点研究的领域,目前报道较多的是关于FadR和FabR对细菌脂肪酸降解与合成的调控。FadR在大肠埃希菌脂代谢中发挥重要作用,抑制脂肪酸的降解代谢,同时活化脂肪酸合成的FabA-FabB途径;而FabR是转录调控蛋白,调节相关基因的表达,平衡不饱和脂肪酸与饱和脂肪酸比例[32]。但细菌脂肪酸合成途径中关键步骤是如何被调控的,脂肪酸合成代谢与其他基础代谢是如何关联与调控的,以及培养条件等因素是如何影响细菌脂肪酸代谢等问题,都需进一步深入研究。
细菌脂肪酸合成酶系与真核生物不同,以此作为潜在的药物作用靶点,筛选出克服耐药性、选择性高、毒性低的靶点抑制剂,已成为抗菌药物研发的热点领域。细菌脂肪酸合成酶系中有多个靶点,包括乙酰辅酶A羧化酶、脂肪酸缩合酶、脂酰转移酶、烯脂酰ACP还原酶等。尽管已有很多靶点抑制剂的研究报道,如FabI抑制剂异烟肼(isoniazid)是临床治疗结核病的常用药物,但针对脂肪酸合成体系,开发出新的抗菌药物仍具有广阔前景[33]。细菌脂肪酸合成代谢机制高度保守,可研发出广谱抗菌药物;而细菌间催化个别反应的酶也存在多样性,又为开发特异性抗菌药物提供了可能。
群体感应是细菌间交流的一种重要方式。研究表明,革兰阴性细菌的脂肪酸合成代谢为群体感应信号分子的合成提供前体。但群体感应信号分子的合成机制,以及与脂肪酸合成代谢之间的调控等问题,还有待进一步探索。另外,群体感应对细菌的致病性有重要作用,筛选抑制群体感应信号分子合成的化合物,也成为新型抗菌药物的研究方向。
聚酮体合成途径与脂肪酸合成途径相似性很高,但两者利用不同的催化酶体系。深入研究链霉菌的脂肪酸合成机制以及聚酮体合成途径,将有利于通过基因改造的方法提高通过聚酮体途径合成的次级代谢产物(如大环内酯类抗生素等)产量。
通过利用、改造细菌脂肪酸合成途径,获得具有商业价值的工程菌将是另一个研究方向。R-3-羟基脂肪酸含有一个手性中心和2个容易被修饰的功能基团(-OH和-COOH),可用作精细化工产品的前体,用于合成如抗生素、维生素、芳香剂等多种化学品,具有重要的价值,但化学合成R-3-羟基脂肪酸工艺复杂,成本高,生物合成克服了以上缺点。细菌脂肪酸代谢过程中产生大量的R-3-羟基脂肪酸中间产物,以胞外分泌物组分(如鼠李糖脂)和胞内碳源(能量)的贮藏物质(如聚羟基脂肪酸酯,简称PHA)等形式存在。通过基因重组技术利用大肠埃希菌生产PHA等已有报道,但要获得不同链长的单一组分R-3-羟基脂肪酸还需要深入研究。
随着化学能源的日益枯竭,生物燃料逐渐被重视。当前,通过基因工程手段,改造大肠埃希菌脂肪酸代谢系统以及相关的分泌系统等,获得能产生大量自由脂肪酸(FFA)及其衍生物的工程菌,为生产新一代生物材料提供了可能[34]。如何更优化地改造脂肪酸代谢系统,通过调控方法提高脂肪酸产量,利用更廉价的原料获得更高的产出等问题,将是生物能源领域未来研究的重点方向。
[1]Parsons J B,Rock C O.Bacterial lipids:metabolism and membrane homeostasis[J].Prog Lipid Res,2013,52(3): 249-276.
[2]Song H,Ao G-Z,Li H-Q.Novel FabH inhibitors:an updated article literature review(July 2012 to June 2013)[J].Expert opinion on therapeutic patents,2014,24(1):19-27.
[3]Cheng J,Ma J,Lin J,et al.Only One of the Five Ralstonia solanacearum Long-Chain 3-Ketoacyl-Acyl Carrier Protein Synthase Homologues Functions in Fatty Acid Synthesis[J].Appl Environ Microb,2012,78(5):1563-1573.
[4]Zhang Y M,Rock C O.Membrane lipid homeostasis in bacteria[J].Nat Rev Microbiol,2008,6(3):222-233.
[5]Wang X,Quinn P J.Lipopolysaccharide:Biosynthetic pathway and structure modification[J].Prog Lipid Res,2010,49(2): 97-107.
[6]Geske G D,O'Neill J C,Miller D M,et al.Comparative analyses of N-acylated homoserine lactones reveal unique structural features that dictate their ability to activate or inhibit quorum sensing[J].Chembiochem,2008,9(3):389-400.
[7]Bi H,Christensen Q H,Feng Y,et al.The Burkholderia cenocepacia BDSF quorum sensing fatty acid is synthesized by a bifunctional crotonase homologue having both dehydratase and thioesterase activities[J].Mol Microbiol,2012,83(4):840-855.
[8]Zhou L,Yu Y,Chen X,et al.The Multiple DSF-family QS Signals are Synthesized from Carbohydrate and Branched-chain Amino Acids via the FAS Elongation Cycle[J].Scientific reports,2015,5:13294.
[9]Lin S,Cronan J E.Closing in on complete pathways of biotin biosynthesis[J].Mol Biosyst,2011,7(6):1811-1821.
[10]Zhu K,Rock C O.RhlA converts beta-hydroxyacyl-acyl carrier protein intermediates in fatty acid synthesis to the beta-hydroxydecanoyl-beta-hydroxydecanoate component of rhamnolipids in Pseudomonas aeruginosa[J].J Bacteriol,2008,190(9): 3147-3154.
[11]Joseph J.Fattening by deprivation:methyl balance and perinatal cardiomyopathy[J].J Pathology,2011,225(3):315-317.
[12]董会娟,余永红,王海洪,等.野油菜黄单胞菌中长链3-酮脂酰ACP合成酶的鉴定[J].华南农业大学学报,2015,36(2):49-54.
[13]Zhu L,Cheng J,Luo B,et al.Functions of the Clostridium acetobutylicium FabF and FabZ proteins in unsaturated fatty acid biosynthesis[J].BMC Microbiol,2009,9:119-130.
[14]马金成,邓丽婷,童文华,等.五个3-酮脂酰ACP合成酶同源蛋白的功能鉴定[J].生物化学与生物物理进展,2014,41(9):887-895.
[15]Yuan Y,Sachdeva M,Leeds J A,et al.Fatty acid biosynthesis in Pseudomonas aeruginosa is initiated by the FabY class of beta-ketoacyl acyl carrier protein synthases[J].J Bacteriol,2012,194(19):5171-5184.
[16]Yuan Y,Leeds J A,Meredith T C.Pseudomonas aeruginosa directly shunts beta-oxidation degradation intermediates into de novo fatty acid biosynthesis[J].J Bacteriol,2012,194(19): 5185-5196.
[17]Ya-Hui Mao J-C M,Feng Li,et al.Ralstonia solanacearum RSp0194 Encodes a Novel 3-Keto-Acyl Carrier Protein Synthase III[J].Plos One,2015,10(8):e0136261.
[18]雷鸣,马金成,王海洪.流产布氏杆菌烯脂酰ACP还原酶的鉴定[J].生物化学与生物物理进展,2012,39(5): 464-471.
[19]Zhu L,Bi H,Ma J,et al.The Two Functional Enoyl-Acyl Carrier Protein Reductases of Enterococcus faecalis Do Not Mediate Triclosan Resistance[J].mBio,2013,4(5):e00613-13.
[20]Kim K H,Ha B H,Kim S J,et al.Crystal structures of Enoyl-ACP reductases I(FabI)and III(FabL)from B.subtilis[J].J Mol Biol,2011,406(3):403-415.
[21]Massengo-Tiasse R P,Cronan J E.Vibrio cholerae FabV defines a new class of enoyl-acyl carrier protein reductase[J].J Biol Chem,2008,283(3):1308-1316.
[22]Li H,Zhang X,Bi L,et al.Determination of the crystal structure and active residues of FabV,the enoyl-ACP reductase from Xanthomonas oryzae[J].PLoS One,2011,6(10):e26743.
[23]Zhu L,Lin J,Ma J,et al.Triclosan resistance of Pseudomonas aeruginosa PAO1 is due to FabV,a triclosan-resistant enoyl-acyl carrier protein reductase[J].Antimicrob Agents Chemother,2010,54(2):689-698.
[24]Mou R,Bai F,Duan Q,et al.Mutation of pfm affects the adherence of Pseudomonas aeruginosa to host cells and the quorum sensing system[J].FEMS microbiol lett,2011,324(2): 173-180.
[25]Bushby K,Finkel R,Wong B,et al.Ataluren treatment of patients with nonsense mutation dystrophinopathy[J].Muscle&nerve,2014,50(4):477-487.
[26]Bi H,Wang H,Cronan J E.FabQ,a dual-function dehydratase/isomerase,circumvents the last step of the classical fatty acid synthesis cycle[J].Chem Biol,2013,20(9):1157-1167.
[27]Zhu K,Choi K H,Schweizer H P,et al.Two aerobic pathways for the formation of unsaturated fatty acids in Pseudomonas aeruginosa[J].Mol Microbiol,2006,60(2):260-273.
[28]Chazarreta Cifre L,Alemany M,de Mendoza D,et al.Exploring the biosynthesis of unsaturated fatty acids in Bacillus cereus ATCC 14579 and functional characterization of novel acyl-lipid desaturases[J].Appl Environ Microbiol,2013,79(20): 6271-6279.
[29]马金成,周俊超,吴楚云,等.苜蓿中华根瘤菌desA基因功能的鉴定[J].生物化学与生物物理进展,2015,42(8): 740-749.
[30]Singh A K,Zhang Y M,Zhu K,et al.FabH selectivity for anteiso branched-chain fatty acid precursors in low-temperature adaptation in Listeria monocytogenes[J].FEMS Microbiol Lett,2009,301(2):188-192.
[31]Santiago B,Marek M,Faustoferri R C,et al.The Streptococcus mutans aminotransferase encoded by ilvE is regulated by CodY and CcpA[J].J Bacteriol,2013,195(16):3552-3562.
[32]Feng Y,Cronan J E.The Vibrio cholerae fatty acid regulatory protein,FadR,represses transcription of plsB,the gene encoding the first enzyme of membrane phospholipid biosynthesis[J].Mol Microbiol,2011,81(4):1020-1033.
[33]Parsons J B,Rock C O.Is bacterial fatty acid synthesis a valid target for antibacterial drug discovery[J].Curr Opin Microbiol,2011,14:1-6.
[34]Helge Jans Janen,Steinbüchel A.Fatty acid synthesis in Escherichia coli and its applications towards the production of fatty acid based biofuels[J].Biotechnol for Biofuels,2014,7(7): 1-26.
Advances in Fatty Acid Biosynthetic Diversity in Bacteria
YU Yong-hong1,MA Jian-rong1,WANG Hai-hong2
(1.Guangdong Food&Drug Vocational Coll.,Guangzhou 510520;2.Coll.of Life Sci.,S.China Agric.Uni./Guangdong Prov.Key Lab.of Protein Funct’n&Regulat’n in Agric.Organisms,Guangzhou 510642)
Differ from mammalian and fungal system(FAS I)adopting type I fatty acid synthetic system,bacteria adopt type II fatty acid synthetic system,each step of the reactions is catalyzed by independent enzymes,therefore,the synthetic enzyme of bacterial fatty acid is a fine target to study antibiotic medicine.The studies have showed that fatty acid synthetic enzymes take part in different bacteria all have relatively high diversity,and different kinds of fatty acid,the synthetic forms are not fully the same.These respects were summarized in this paper.
fatty acids synthesis;diversity;unsaturated fatty acids;branched-chain fatty acids
Q93
A
1005-7021(2016)04-0076-08
10.3969/j.issn.1005-7021.2016.04.014
国家重点基础研究发展计划973项目(2015CB150604);广东省自然科学基金自由申请项目(1414050001652);广东食品药品职业学院院级课题(2015YZ006)
余永红男,讲师。研究方向为微生物基因功能与调控。E-mail:yuyongh1228@163.com
*通讯作者。男,教授,博士生导师。研究方向为微生物脂肪酸合成相关生理代谢。E-mail:wanghh36@scau.edu.cn
2015-09-06;
2015-09-28