Hg2+对花翅摇蚊Chironomus kiiensis幼虫口器致畸作用及抗氧化酶活性的影响
2016-02-07陈菲刘曼红蔡艳马玉堃
陈菲,刘曼红,蔡艳,马玉堃
(东北林业大学野生动物资源学院,黑龙江 哈尔滨 150040)
Hg2+对花翅摇蚊Chironomus kiiensis幼虫口器致畸作用及抗氧化酶活性的影响
陈菲,刘曼红,蔡艳,马玉堃
(东北林业大学野生动物资源学院,黑龙江 哈尔滨 150040)
在水温(17.0±1.0)℃和16h光∶8h暗的光周期下,采用加标于沉积物法研究Hg2+对花翅摇蚊Chironomus kiiensis幼虫口器的致畸作用和抗氧化酶活性的慢性毒性影响。将4龄摇蚊幼虫暴露于0.002mg· L-1、0.004 mg·L-1、0.008mg·L-1、0.016mg·L-1、0.032mg·L-1、0.064mg·L-1、0.128mg·L-1和0.256mg·L-18个Hg2+浓度梯度下,测定摇蚊幼虫组织匀浆超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性。结果表明:Hg2+显著影响花翅摇蚊幼虫体组织SOD和CAT活性,且与Hg2+暴露浓度呈显著浓度-效应关系(P<0.05)。Hg2+暴露30d后,摇蚊幼虫的大颚长度与Hg2+暴露浓度之间也呈极显著正相关性(P<0.01)。该结果说明在低浓度Hg2+的胁迫下,摇蚊幼虫形态结构、生理功能发生了显著改变,可用该幼虫的形态结构、生理功能指标作为监测水体Hg2+污染及判定水环境质量的生物学指标。
Hg2+;花翅摇蚊幼虫;抗氧化酶;致畸作用
大气和土壤中的Hg2+可通过干湿沉降以及地表径流等进入水体中而普遍存在[1],再通过生态系统食物链逐级传递,影响水的质量、水生生物包括鱼类的生存,威胁到人类的健康。因此,检测水体中Hg2+的存在及其在环境中的影响尤为重要。
研究表明,可以用水生生物的形态结构和生理特征等生物学指标的变化来评估水生生态环境的污染情况[2,3]。底栖动物是水生生物的重要组成类群,在水生生态系统中发挥重要作用,它们的形态结构和生理指标能反应水体环境健康状况。张传永等[4]研究发现,水生动物通过呼吸、摄食、体表与水体的渗透交换富集水体重金属。底栖动物常受水体污染的影响[5],形态结构和生理特征产生相应变化,因此,通常用水生生物监测环境。摇蚊幼虫是淡水生态系统中最常见的底栖动物,在激流和静水的底栖生物群落环境中占主导地位[6],是其他水生生物的主要食物来源[7]。摇蚊幼虫体内的重金属可以通过食物链传递给下一营养级,生物放大作用使水生生态系统中的高位营养级生物体内重金属含量增多,使生物体生理受阻、发育停滞,甚至死亡,最后造成整个水生生态系统的结构和功能受损和崩溃[8]。因此,摇蚊幼虫在水生生态系统中居基础地位,研究摇蚊幼虫对水体Hg2+胁迫的响应,有助于对水体Hg2+污染做出快速反应,以免危害水生生物以及人类健康。
摇蚊幼虫对水质变化较敏感,污染使口器或触角发生形态变化[9],可在高污染环境下生存[10]。因此,摇蚊幼虫是水生态毒理实验重要的研究对象,也是监测河流和湖泊水质的重要指示生物之一[9,11]。其中,花翅摇蚊Chironomus kiiensis幼虫是研究应对不同曝光时间层次的重金属污染的好材料[12],尤其是对水体Hg2+浓度的变化。
目前关于摇蚊幼虫的慢性毒理实验鲜见研究。闫宾萍等[13]研究了Ni2+、Hg2+和五氯酚对羽摇蚊Chironomus plumosus幼虫的急性毒性。李浩等[14]研究了Cu2+对羽摇蚊幼虫口器致畸作用和抗氧化酶活性的急性毒理性。刘曼红等[15]研究了Hg2+慢性胁迫对花翅摇蚊幼虫组织三种酶活性的影响。本研究采用低剂量Hg2+(浓度小于0.729mg·L-1)慢性毒物暴露实验方法,进一步探测亚致死剂量的Hg2+暴露对花翅摇蚊幼虫口器致畸及体内超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性的影响,为水环境Hg2+污染的早期诊断及生态风险评价提供参考。
1 材料与方法
1.1 材料
供试花翅摇蚊幼虫由东北林业大学野生动物资源学院水生生物学实验室室内长期培养。实验用水为人工介质M4[8],水温为(17.0±1.0)℃。选取个体活泼、体长一致的3~4龄幼虫,在人工介质M4中驯养24h后进行急性毒性实验,以此确定慢性毒理实验中Hg2+的安全浓度。在慢性毒理实验中,供试花翅摇蚊幼虫卵带与上述幼虫选自同一培养箱内,选取完整的卵带3条,投入附水沉积物[8]即模拟水生态系统中进行毒理实验。
1.2 方法
1.2.1 安全浓度的确定
参照《化学品沉积物-水系统中摇蚊毒性实验加标于沉积物法》[8]进行暴露。用人工介质M4配制实验溶液,在预实验基础上设置1.0mg·L-1、1.4mg· L-1、1.8mg·L-1、2.2mg·L-1、2.6mg·L-1和3.0mg·L-16个Hg2+质量浓度组。每组设三个平行,设空白对照组。实验期间给摇蚊幼虫投喂金鱼幼鱼饲料,水环境pH(6.0±0.5),水温为(17.0±1.0)℃,t(光)∶t(暗)=16h∶8h。观察各实验组摇蚊幼虫存活情况,挑出死亡个体,统计死亡率。摇蚊幼虫死亡标准为:用玻璃棒轻压尾部3次后无“8”字扭动运动现象。用线性回归法[17]计算暴露24h时Hg2+对花翅摇蚊幼虫的半数有效浓度(EC50)。
根据安全浓度(ρS)计算公式ρS=ρ(24h,EC50)×0.1[18]和急性毒性实验的半数有效浓度(EC50),确定慢性毒性实验中Hg2+的安全浓度。参照花翅摇蚊幼虫的ρ(24h,EC50)值,慢性实验中设0.002mg·L-1、0.004mg·L-1、0.008mg·L-1、0.016mg·L-1、0.032mg·L-1、0.064mg·L-1、0.128mg·L-1和0.256mg·L-18个Hg2+浓度梯度,每组设三个平行,设空白对照组。实验期间不投饵,水环境中的沉积物为摇蚊幼虫的食物来源。水pH(6.0±0.5),水温(17.0±1.0)℃,t(光)∶t(暗)=16h∶8h,用空气泵充气以保证水环境内氧气充足。
1.2.2 抗氧化酶活性的测定
花翅摇蚊幼虫在不同浓度Hg2+中暴露30d后,每组随机选取10只活泼、体长一致的4龄幼虫,用预冷的蒸馏水冲洗干净,滤纸吸干体表水分。采用南京建成生物工程研究所的试剂盒测定花翅摇蚊幼虫组织均浆液的SOD和CAT活性。
1.2.3 Hg2+对摇蚊幼虫口器结构的影响
在摇蚊幼虫发育为4龄幼虫后,选取大小相近的活泼个体,用沸水烫死,剥离幼虫头部进行镜检,利用Motic Images Plus 2.0拍摄,测量其大颚长度。
采用SPSS16.0统计软件对各组间各指标作单因素方差分析(ANOVA),采用t检验法分析各浓度组与对照组间的差异显著性。所有数据处理和作图均采用SPSS16.0统计软件和Excel软件。
2 结果与分析
2.1 不同浓度Hg2+胁迫对花翅摇蚊幼虫体组织中SOD活性的影响
由图1可知,花翅摇蚊卵带在Hg2+中暴露30d后,随着Hg2+浓度的升高,SOD活性先快速降低,显著低于对照组;但从0.002mg·L-1组开始,各浓度组SOD活性开始缓慢上升,0.016mg·L-1组显著高于对照组,受诱导显著(P<0.05);0.064mg·L-1Hg2+暴露组SOD活性达峰值,受诱导极显著(P<0.01)。随Hg2+浓度的继续升高(0.128mg·L-1),SOD活性开始下降,不同处理组之间差异显著(P<0.05)。
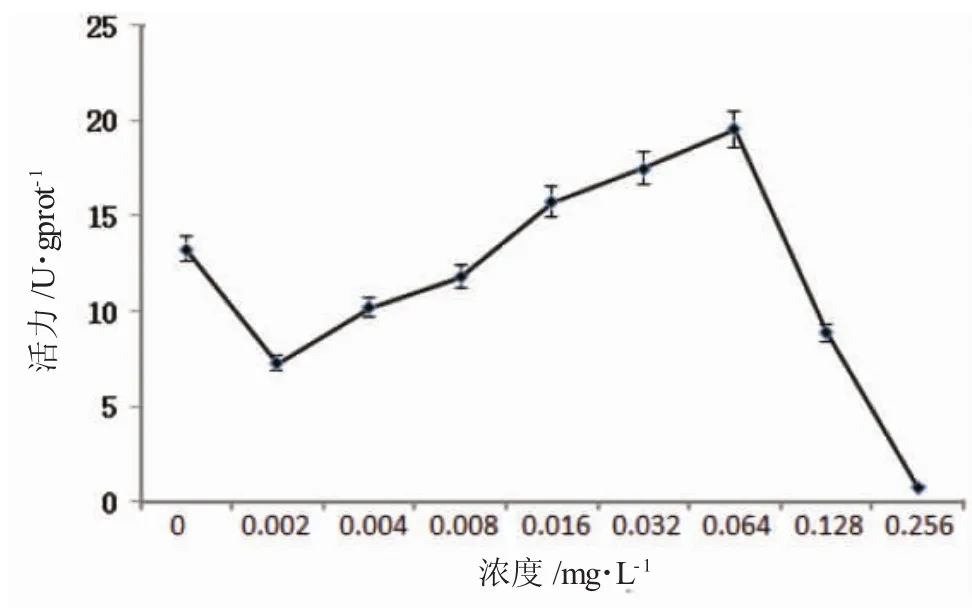
图1 Hg2+对花翅摇蚊幼虫体组织中SOD活性的影响Fig.1 Effect of Hg2+on SOD activity in tissues of larval chironomus Chironomus kiiensis
2.2 不同浓度Hg2+胁迫对花翅摇蚊幼虫体组织中CAT活性的影响
花翅摇蚊卵带经Hg2+暴露30d后,随着Hg2+浓度的升高,CAT活性快速升高,显著高于对照组,受诱导显著(P<0.05),在0.004mg·L-1Hg2+组达到峰值,随后活性开始缓慢下降,CAT活性从0.008mg·L-1Hg2+组开始显著低于对照组,差异显著(P<0.05)。随后,CAT活性随着 Hg2+浓度增加逐渐降低,0.256mg·L-1Hg2+组下降到最低(图2)。
2.3 Hg2+胁迫对花翅摇蚊幼虫口器畸变的影响
经不同浓度Hg2+暴露后,花翅摇蚊幼虫颏部未发生畸变,但是大颚的齿部长度随着Hg2+浓度的升高而变长(图3)。在显微镜下,测定各处理组摇蚊幼虫大颚长度,利用SPSS16.0将大颚长度(y)与各处理组Hg2+浓度进行线性回归分析,其回归方程为:y(μm)=0.985+2.443x(mg·L-1)(R2=0.754)。结果表明,大颚长度(y)与Hg2+暴露浓度(x)之间呈极显著正相关关系(P<0.01)。
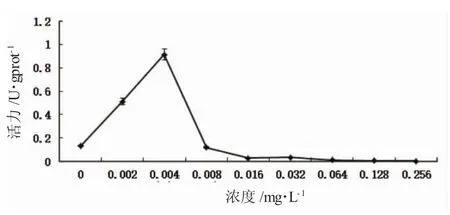
图2 Hg2+对花翅摇蚊幼虫体组织中CAT活性的影响Fig.2 Effect of Hg2+on CAT activity in tissues of larval chironomus Chironomus kiiensis
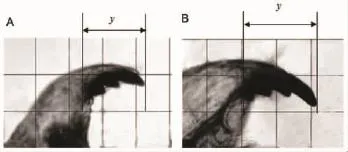
图3 正常(A)和汞作用下(B)花翅摇蚊幼虫大颚(200×)Fig.3 The mandibles of normal(A)and exposed to Hg2+(B)larval chironomus Chironomus kiiensis(200×)
3 讨论
3.1 Hg2+对花翅摇蚊幼虫体组织抗氧化酶活性的影响
Hg2+是外源毒物,会使DNA、酶、功能蛋白分子等结构破坏和活性失活等[4],如诱导超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等的活性变化,间接反映了环境中氧化应激的存在,可以作为环境污染胁迫的指标[14]。Michailova等[19]研究表明,生化标志物是摇蚊幼虫敏感的毒性标志物,提供环境中污染物的早期预警指标。其次,重金属可以产生活性氧,诱导氧化应激,刺激抗氧化酶参与细胞的防御机制[16],而Hg是机体的非必需元素,不参与抗氧化应激,会引起SOD和CAT等酶的活性规律性变化。SOD和CAT可以有效地清除生物体内过多的超氧阴离子自由基,降低氧自由基对有机体的伤害[20],减少其对细胞的过氧化伤害[21]。由此可见,SOD和CAT共同在生物体内建立了一个功能一致且相互配合的抗氧化网络,保护机体。
在低浓度Hg2+实验组中,Hg2+诱导机体SOD和CAT的表达和活性上升,机体内抗氧化酶的活性显著增加,以降低活性氧自由基的损伤;随着Hg2+浓度的升高,大量的Hg2+进入机体内,机体内自由基处于一种较高的状态,机体内抗氧化酶活性也一直高于对照组。随着浓度的继续升高,机体受到重度逆境胁迫,Hg2+抑制机体的抗氧化酶活性,抗氧化酶活性逐渐降低。张清顺等[21]对梨形环棱螺Bellamya purificata的研究也证实了这一点。
刘曼红等[15]研究发现,SOD和CAT活性随Hg2+浓度增加而逐渐升高,其浓度范围较宽泛(0mg·L-1、0.003mg·L-1、0.009mg·L-1、0.027mg·L-1、0.081mg·L-1、0.243mg·L-1和0.729mg·L-1),不能表现出低剂量下摇蚊幼虫抗氧化酶活性的波动,在试验过程中投喂金鱼幼鱼颗粒饲料,而摇蚊幼虫以沉积物为食,沉积物内有大量的Hg2+,如果投喂饲料,可能会降低摇蚊幼虫对沉积物的摄入,使摇蚊体内的Hg2+含量低于直接以沉积物为食的摇蚊体内Hg2+的含量,影响到Hg2+暴露对摇蚊幼虫的毒性效应。其次,其实验温度(26.0~28.0℃)比本实验温度(17.0±1.0)℃高。在16.0~28.0℃范围内,温度越高,越适合摇蚊幼虫生长发育。而本实验中,浓度范围较窄(最高浓度为0.256mg·L-1),抗氧化酶活性波动更加明显。
本文研究了Hg2+对摇蚊幼虫生物抗氧化酶活性的影响,并未涉及神经递质,研究内容还不够全面,在以后的研究中应补充这一部分。
3.2 Hg2+胁迫对花翅摇蚊幼虫口器结构的影响
在毒物的不断刺激下生物会加强对能量的利用,产生不同的反应,使细胞的形态和功能发生改变。不同发育阶段的机体,对毒物的反应不同[12]。一些有毒物质能影响水生生物捕食所需的时间,影响试图捕捉食物所需的次数,或者影响其是否能吞咽食物[12]。生物体畸形可以作为有毒物质影响生物行为的一种表现。畸形的简单性和快速性也使得畸形程度的评估已成为沉积物质量的生物标志物,因此研究重金属对摇蚊幼虫的致畸作用具有重要意义。
水生生物可重将金属吸附在器官表面,影响器官的正常生理功能,诱发细胞畸型[4]。Hg2+对摇蚊幼虫的致畸作用主要是口器畸型,影响摇蚊幼虫的摄食和生长发育。许多研究已证实,重金属如Hg2+[13]和Cu2+[14]对摇蚊幼虫口器的致畸作用。据闫宾萍和宋志慧[13]报道,0.01mg·L-1Hg2+急性毒性作用下羽摇蚊幼虫口器变脆,下唇板上的牙齿不对称,中间牙齿磨损,绝大多数大颚牙齿数减少。本实验中,未发现Hg2+对花翅摇蚊幼虫下唇板的致畸作用,说明急性和慢性毒性试验中Hg2+对摇蚊幼虫的致畸部位不同。目前,重金属致口器畸型的作用机理尚未明确,但许多研究证实,重金属浓度及暴露时间与致畸率之间存在线性关系,因而摇蚊幼虫的致畸率及致畸部位成为水环境评价的重要参数之一。本实验中未观察到摇蚊幼虫形态结构更加细微的畸型,还有待进一步研究。
本实验结果表明:摇蚊幼虫对水体Hg2+污染能做出显著的形态和生理响应,可以将摇蚊幼虫形态特征和生理特征作为检测水体Hg2+污染的重要生物监测指标。这为研究水体Hg2+对水生生物影响以及完善生物监测指标提供了参考。
致谢:感谢东北林业大学野生动物资源学院孙雅薇在试验过程中给予的帮助,感谢林学院闫国永在文章修改中给予的帮助。
[1]Azevedo-Pereira H MV S and Soares A MV M.Effects of mercury on growth,emergency,and behavior of Chironomus riparius Meigen(Diptera:Chironomidae)[J].Archives of Environmental Contamination and Toxicology,2010,59: 216-224.
[2 Ghedira J,Jebali J,Bouraoui Z,et al.Acute effects of chlorpyryphos-ethyl and secondary treated effluents on acetylcholinesterase and butyrylcholinesterase activities in Carcinus maenas[J].Journal of Environmental Sciences, 2009,21(10):1467-1472.
[3]Meng W,Zhang N,Zhang Y,et al.Integrated assessment of river health based on water quality,aquatic life and physical habitat[J].Journal ofEnvironmental Sciences,2009,21(8):1017-1027.
[4]张传永,刘庆,陈燕妮.重金属对水生生物毒性作用研究进展[J].生命科学仪器,2008,6(11):3-7.
[5]MinutoliR,Granata Aand GugliemoL.Potential use ofecotoxicologicalbiomarkersinSerratellaignita(Ephemeroptera)larvaeforAlcantarariver(Sicily,Italy)waterqualityassessment[J].JournalofLimnology,2013,72:394-399.
[6]PéryAR R,Mons R,Flanmmarion P,et al.Amodelingapproach to link food availability,growth,emergency,and reproduction for the midge Chironomus riparius[J].EnvironmentalToxicologyandChemistry,2002,21(11):2507-2513.
[7 García-Berthou E.Food of introduced mosquitofish:ontogenetic diet shift and prey selection[J].Journal ofFish Biology,1999,55(1):135-147.
[8]中国检验检疫科学研究院.GB/T 27859-2011化学品沉积物-水系统中摇蚊毒性实验加标于沉积物法[S].北京:中国标准出版社,2012.
[9]Faria MS,Ré A,Malcato J,et al.Biological and functional responses of in situ bioassays with Chironomus ripariaus larave to assess river water quality and contamination[J]. Science ofthe Total Environment,2006,371:125-137.
[10]Al-Shami S,Rawi C S M,Nor S A M,et al.Morphological deformities in Chironomus spp.(Diptera:Chironomidae)larvae as a tool for impact assessment of anthropogenic and environmental stresses on three rivers in the Juru River system,Penang,Malaysia[J].Environmental Entomology,2010,39(1):210-222.
[11]CastroB B,Guilhermino L and Ribeiro R.In situ bioassay chamber and procedures for assessment ofsediment toxicitywith Chironomus riparius[J].Environmental Pollution, 2003,125(3):325-335.
[12]Mikko N.An introduction to aquatic toxicology[M].Manhattan,NewYork:Academic Press,2014:143-175.
[13]闫宾萍,宋志慧.Ni2+、Hg2+和五氯酚对羽摇蚊幼虫(Chironomus plumosus)的毒性和生物浓缩[J].青岛科技大学学报:自然科学版,2006,27(5):411-414.
[14]李浩,王琴,邓金钗,等.Cu2+对羽摇蚊幼虫(Chironomus plumosus)口器致畸作用和抗氧化酶活性的影响[J].生态与农村环境学报,2012,28(2):203-208.
[15]刘曼红,张译文,汤颖,等.Hg2+胁迫对花翅摇蚊(Chironomus kilensis)幼虫组织三种酶活性影响[J].东北农业大学学报,2016,47(2):61-66,95.
[16]KimB M,Rhee J S,JeongC B,et al.Heavy metals induce oxidative stress and trigger oxidative stress-mediated heat shock protein(hsp)modulation in the intertidal copepod Tigriopus japonicus[J].Comparative Biochemistry and Physiology,Part C:Toxicology&Pharmacology,2014, 166:65-74.
[16]李翠萍,吴民耀,王宏元.3种半数致死浓度计算方法之比较[J].动物医学进展,2012,33(9):89-92.
[17]明道续.兽医统计方法[M].四川:成都科技大学出版社,1991:200-203.
[18]Elias P Svensson.Aquatic toxicology research focus[M]. Hauppauge,New York:Nova Science Publishers Inc., 2008:1-29.
[19 Michailova P,Ilkova J,Duran M,et al.Structural and functional alterations in salivary gland chromosomes and enzyme activity of Chironomus riparius Mg.(Diptera, Chironomidae)from anthropogenically polluted sites in BulgariaandTurkey[J].Caryologia,2012,65(2):157-169.
[20]杨节.茶树中过氧化氢酶的初步研究[D].杭州:浙江大学,2014.
[21]张清顺,侯建军,刘香江,等.铜对梨形环棱螺抗氧化酶活性和金属硫蛋白含量的影响[J].水生生物学报,2009, 33(4):717-725.
Effect of Hg2+Exposure on Teratogenesis Mouthparts and Antioxidant Enzyme Activity in Larval Chironomus Chironomus kiiensis
CHEN Fei,LIU Man-hong,CAI Yan,MA Yu-kun
(College of Wildlife Resources,Northeast Forestry University,Harbin 150040,China)
Chronic toxicity of mercury to larvae of chironomus Chironomus kiiensis was studied by using standard-sediment method in a laboratory.The activities of superoxide dismutase(SOD)and catalase(CAT)related to antioxidant enzymes and teratogenic mouthparts were monitored in the homogenate of tissues in the 4 instar larvae of the chironomus exposed to Hg2+concentrations of 0.002 mg· L-1,0.004 mg·L-1,0.008 mg·L-1,0.016 mg·L-1,0.032 mg·L-1,0.064 mg·L-1,0.128 mg·L-1and 0.256 mg·L-1.The results showed that Hg2+led to obvious effects on the activities of SOD and CAT,with significant concentration-response relationship(P<0.05).The chironomus larvae exposed to Hg2+for 30 d showed a significant positive correlation between the mandibular length in mouthparts and the exposure concentration of Hg2+(P<0.01).The findings indicate that the morphological structure and physiological function of chironomus larvae can be used as an important biological indicator for monitoring of water pollution of Hg2+since the low concentration of Hg2+stress has led to significantly change in morphology and physiology of chironomus larvae.
Hg2+;Chironomus kiiensis;antioxidant enzyme;terotagenesis
X835
A
1005-3832(2016)05-0055-05
2016-06-07
中央高校基本科研业务费专项资金资助(2572014EA07-03).
陈菲(1992-),女,硕士研究生,水生生物学专业.
马玉堃(1962-),男,博士,硕士研究生导师,从事水环境生物学研究.E-mail:mayukun66@126.com
