定量磁共振灌注成像用于评价直肠癌的微血管灌注及渗透性*
2016-01-31肖晓娟卢宝兰杨心悦刘旭斌翟凤仪余深平
肖晓娟, 卢宝兰, 杨心悦, 王 影, 刘旭斌, 翟凤仪, 余深平△
(中山大学附属第一医院 1影像科, 2病理科,广东 广州 510080)
定量磁共振灌注成像用于评价直肠癌的微血管灌注及渗透性*
肖晓娟1,卢宝兰1,杨心悦1,王影1,刘旭斌2,翟凤仪1,余深平1△
(中山大学附属第一医院1影像科,2病理科,广东 广州 510080)
[摘要]目的: 采用定量磁共振(MR)灌注成像测定直肠癌的各灌注参数,以探究MR灌注成像在评价肿瘤局部微血管灌注量及渗透性方面的应用价值。方法: 回顾性分析行直肠动态对比增强磁共振(DCE-MRI)扫描的直肠癌患者38例。计算肿瘤和正常肠壁感兴趣区(ROI)灌注参数 [对比剂容积转换常数(Ktrans)、血浆与血管外细胞外间隙(EES) 间的速率常数(Kep)、单位体积组织的EES 容量(Ve)及初始强化曲线下面积(iAUC)]的平均值,并对肿瘤与正常肠壁、黏液腺癌与非黏液腺癌、不同分化程度及是否伴淋巴结转移的患者各灌注参数值进行比较分析。结果: 直肠癌的各灌注参数均较正常肠壁高,差异具有统计学意义(P<0.01)。直肠黏液腺癌较非黏液腺癌的Ktrans值低(P<0.05)。不同分化程度、伴有或不伴有淋巴结转移直肠癌患者的Ktrans、Kep及Ve差异无统计学意义,伴有淋巴结转移的直肠癌iAUC较不伴者低。结论: 定量MR灌注成像验证了直肠癌较正常肠壁局部微血管灌注及渗透性的改变,并可用于鉴别黏液腺癌与非黏液腺癌的组织学分型,具有一定的诊断应用价值。但是仅根据肿瘤的灌注值来判断肿瘤的分化程度及淋巴结转移尚不可靠。
[关键词]直肠癌; 磁共振灌注成像; 微血管灌注; 渗透性
直肠癌的肠壁外侵袭、淋巴结转移、血行转移及放化疗效果均与肿瘤微血管情况密切相关,因此评估肿瘤血管对直肠癌的术前分期及预后评价具有重要意义[1]。传统的肿瘤血管评价方法包括微血管密度计数、免疫染色、反转录聚合酶链反应(reverse transcription polymerase chain reaction, RT-PCR)等,但都属于有创性检查,且耗时、不可重复[2]。基于动态对比增强扫描及TISSUE4D后处理技术的定量磁共振(magnetic resonance,MR)灌注成像为近年来应用较先进的一种磁共振功能成像技术,具有高时间分辨率、多参数定量评价的优点,可通过血浆与血管外细胞外间隙(extravascular extracellular space,EES)间的对比剂容积转换常数(volume transfer constant,Ktrans)、血浆与EES 间的速率常数(rate constant of back flux,Kep)和单位体积组织的EES 容量(ex-travascular extracellular space fractional volume,Ve)的值无创地反映肿瘤的微循环情况[3],已有研究将其用于放化疗的效果预测及监测,但结论不尽相同[4-5]。本研究拟采用该定量MR成像技术对直肠癌的各灌注参数进行疗前测定,以探究其局部微血管灌注及渗透性的改变及病理生理学基础,以期为未来的进一步临床应用提供参考。
材料和方法
1研究对象
收集中山大学附属第一医院2014年11月~2015年6月间38例行直肠高分辨MRI及动态对比增强磁共振成像(dynamic contrast-enhanced MRI,DCE-MRI)扫描的直肠癌患者资料。其中男22 例,女16 例,平均年龄(57.0±11.2)岁。患者纳入标准为:(1)检查前经肠镜病理活检明确为直肠癌;(2)检查前未接受放、化疗等辅助治疗;(3)检查后行手术治疗且取得最终病理结果。所有受检者均自愿接受直肠MRI 检查并签署知情同意书。
2MR扫描设备及检查方法
采用Magnetom Verio 3.0 T (Siemens)超导型MR 成像仪,并选择体部相控阵线圈。MRI扫描方案包括:(1)常规直肠高分辨矢状、冠状、正交轴位T2WI及正交轴位T1WI扫描。(2)正交轴位DCE-MRI扫描。首先,采用T1-vibe序列行3D双翻转角(2°和15°)扫描计算T1值,扫描参数为TR 5.08 ms,TE 1.74 ms,FOV 260 mm×260 mm,层厚3.60 mm,体素1.9 mm×1.4 mm×3.6 mm;然后,采用T1WI-3D-twist序列行DCE-MRI扫描,5期动态扫描后由高压注射器经肘静脉团注对比剂Gd-DTPA(广州康臣公司),注射剂量0.1 mmol/kg,流速为3 mL/s,注射对比剂后以同样速度注射0.9%生理盐水25 mL,共行75期不间断动态扫描;扫描参数为TR 4.83 ms,TE 1.87 ms,层厚3.60 mm,FOV 260 mm×260 mm,体素2.0 mm×1.4 mm×3.6 mm,翻转角12°。(3)常规正交轴位T1WI及3D-vibe-T1WI增强扫描。
3资料分析
3.1DCE-MRI图像及数据处理采用磁共振后处理工作站(Syngo MultiModality Workplace, VE40A; Siemens)的Tissue 4D软件对DCE-MRI图像进行后处理,具体步骤如下:(1)利用Tissue 4D软件对平扫及DCE-MRI所得灌注图像进行同层面校准;(2)于肿瘤区、正常肠壁(结合常规高分辨T2WI及增强扫描确定肿瘤的边缘,选取距离肿瘤边缘至少2 cm以外的肠壁作为正常肠壁)及邻近肌肉(肿瘤邻近的正常闭孔内肌或臀大肌)分别选定2个、1个和1个感兴趣区(region of interest,ROI),生成时间-强化曲线(time-relative enhancement curve),如图1A~C所示;(3)选取容积计算范围(volume of interest,VOI),选择原则为范围内包含肿瘤全部、部分正常肠壁及邻近肌肉(选取原则如前文所述),且须避开膀胱;(4)根据VOI内血流特点选择合适的动脉输入函数(arterial input function,AIF)模型,方法为依次试匹配软件内的“Fast”、“Intermediate”和“Slow”模型,卡方值最小的提示模型匹配最好,然后选择该模型并随即计算获得VOI的各灌注值(图1D~F);(5)选择ROI并获得灌注指标Ktrans、Kep、Ve和初始强化曲线下面积(initial area under curve,iAUC)值(图1G~I)。共选取12个ROI,第1~3个选取肿瘤的3个最大层面,第4~6个选取步骤(4)所显示的灌注值最高的区域,第7~9个选取正常肠壁,第10~12个选取邻近肌肉。以上ROI的选择均结合T2WI平扫图像考虑。(6)保存后处理图像并记录参数值。
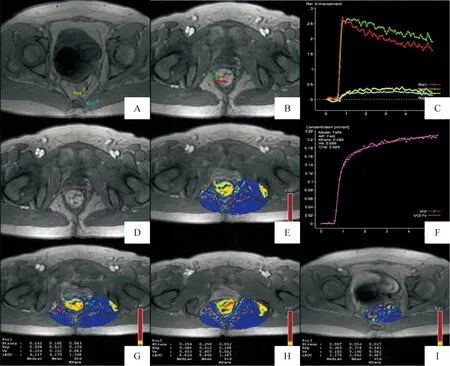
Figure 1.Quantitative perfusion analysis of a 42-year-old woman diagnosed with rectal cancer. A, B: ROIs of the carcinoma, normal rectal wall and adjacent muscle; C: time-relative enhancement curves of the 4 selected ROIs; D~F: drawing the volume of interest for calculation and modeling with color; G~I: perfusion parameters of the drawn ROIs were presented.
图1直肠癌定量MR灌注成像分析示例图
3.2病理资料分析直肠癌依据腺管形态学特征及腺样结构的多少分为高分化癌、中分化癌和低分化癌。95%以上的肿瘤组织显示腺样结构者可定为高分化腺癌(Ⅰ级),50%~95%定为中分化腺癌(Ⅱ级),5%~50%定为低分化腺癌(Ⅲ级),5%以下的定为未分化癌(Ⅳ级)[6]。因黏液腺癌的临床治疗及预后与非黏液腺癌不同,本研究将纳入病例的组织学类型分为黏液腺癌和非黏液腺癌(包括管状腺癌、乳头状癌等)2组。本研究中1例患者经病理证实伴有双侧卵巢种植转移,1例CT诊断肺转移但无病理证实,其余36例患者均未发现远处转移。
4统计学处理
应用SPSS 20.0 统计软件进行分析。灌注指标Ktrans、Kep、Ve和iAUC值均采用均数±标准差(mean±SD)表示。肿瘤与正常肠壁的比较采用配对t检验;黏液腺癌与非黏液腺癌、低分化与中高分化、伴有淋巴结转移和不伴淋巴结转移的直肠癌灌注值的比较采用两独立样本t检验;若前述分析数据正态性检验P<0.10,则采用对应的秩和检验。以P<0.05为差异有统计学意义。
结果
1直肠癌与正常肠壁的灌注值测量结果及比较
38例直肠癌(114个ROI)与正常肠壁的平均灌注值测量结果显示,肿瘤的各项灌注参数值明显低于正常肠壁(P<0.01),见表1。
表1直肠癌与正常肠壁的灌注值比较
Table 1.Perfusion parameters of rectal cancer and normal rectal wall (Mean±SD.n=38)
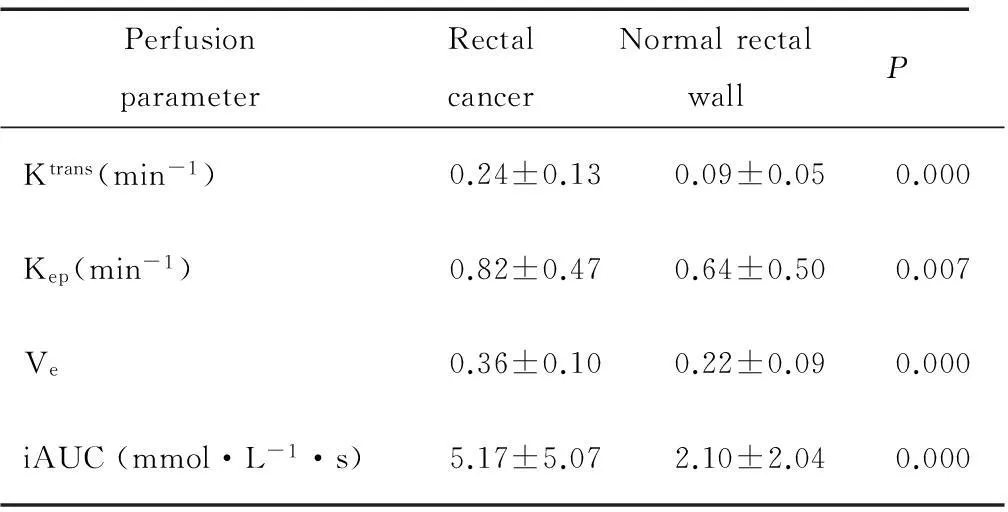
PerfusionparameterRectalcancerNormalrectalwallPKtrans(min-1)0.24±0.130.09±0.050.000Kep(min-1)0.82±0.470.64±0.500.007Ve0.36±0.100.22±0.090.000iAUC(mmol·L-1·s)5.17±5.072.10±2.040.000
2直肠癌组织学类型与灌注值的关系
本组病例中8例黏液腺癌与30例非黏液腺癌的灌注值比较,Ktrans值较低,差异有统计学意义;两组间Kep、Ve及iAUC差异不显著,见表2。
表2黏液腺癌与非黏液腺癌的灌注值比较
Table 2.Perfusion parameters of mucinous and nonmucinous rectal cancer (Mean±SD)

PerfusionparameterMucinousrectalcancer(n=8)Nonmucinousrectalcancer(n=30)PKtrans(min-1)0.16±0.580.26±0.140.015Kep(min-1)0.82±0.750.81±0.380.964Ve0.32±0.080.37±0.110.194iAUC(mmol·L-1·s)4.02±1.805.47±5.620.235
3直肠癌病理分化程度对直肠癌灌注值的影响
肿瘤分化程度方面,本研究38例直肠癌患者中有高分化1例,中分化27例,低分化10例,将中高分化合并与低分化组的灌注值进行比较,结果显示中高分化组与低分化组的各灌注指标的差异均无统计学意义,见表3。
表3不同分化程度直肠癌的灌注值比较
Table 3.Perfusion parameters of poorly and moderately-to-well differentiated rectal cancer (Mean±SD)
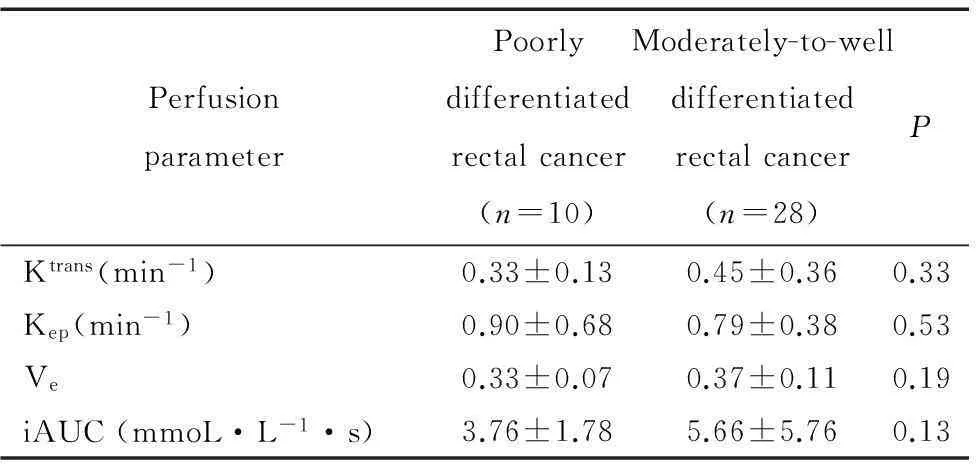
PerfusionparameterPoorlydifferentiatedrectalcancer(n=10)Moderately-to-welldifferentiatedrectalcancer(n=28)PKtrans(min-1)0.33±0.130.45±0.360.33Kep(min-1)0.90±0.680.79±0.380.53Ve0.33±0.070.37±0.110.19iAUC(mmoL·L-1·s)3.76±1.785.66±5.760.13
4伴有淋巴结转移和不伴淋巴结转移的直肠癌灌注值的比较
本组病例经病理证实伴有和不伴有淋巴结转移的直肠癌患者分别有17和21例。两组患者的灌注值仅iAUC的差异有统计学意义,结果显示不伴淋巴结转移的直肠癌iAUC值高于伴有淋巴结转移的直肠癌;但两组间Ktrans、Kep和Ve差异无统计学意义,见表4。
讨论
肿瘤的生长依赖于血管生成,如果没有血管系统,肿瘤组织会处于停滞、静止状态,在新血管生成后肿瘤则可呈指数倍生长,并向周围组织侵袭和出现远处转移[7]。因此,了解肿瘤的微血管灌注情况对于直肠癌的生物学特性及预后评估具有重要价值。本研究所采用的DCE-MRI即可通过小分子对比剂在组织内的运动情况间接、无创地反映肿瘤的微血管灌注环境。当静脉团注对比剂后,对比剂到达肿瘤处的毛细血管床进而很快渗漏至EES。DCE-MRI所得参数Ktrans描述的是对比剂经血管内皮转运至EES的速率,其大小可评价局部的血管灌注量及血管的渗透面积;因为对比剂不能进入细胞内,EES内分布与循环的对比剂量Ve就可以反映EES的大小;一段时间后,对比剂开始从EES回流至相应血管内,回流的速度即灌注参数Kep,Kep的大小很大程度受毛细血管渗透性的影响。此外,本研究纳入了半定量模型的灌注参数iAUC,因为其不受灌注参数模型的影响,可以整体反映感兴趣区的血流量情况[3]。
表4伴和不伴淋巴结转移的直肠癌灌注值比较
Table 4.Perfusion parameters of rectal cancer with or without lymph node metastasis (Mean±SD)
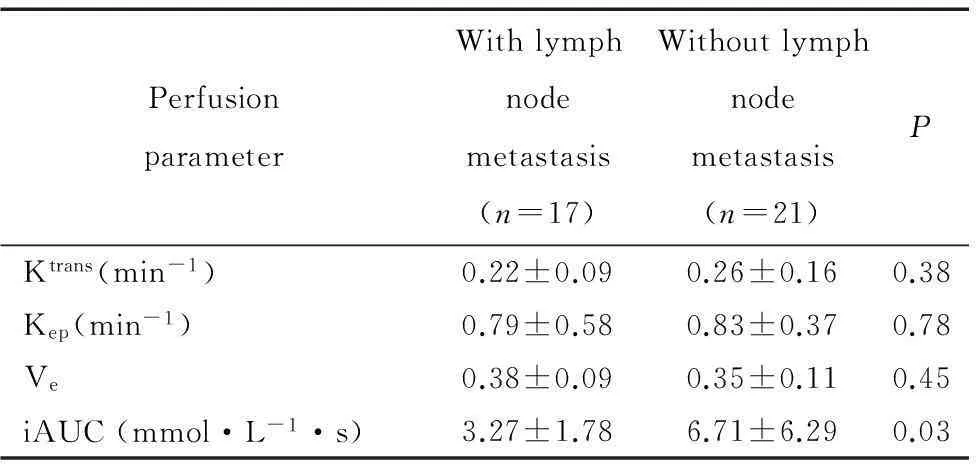
PerfusionparameterWithlymphnodemetastasis(n=17)Withoutlymphnodemetastasis(n=21)PKtrans(min-1)0.22±0.090.26±0.160.38Kep(min-1)0.79±0.580.83±0.370.78Ve0.38±0.090.35±0.110.45iAUC(mmol·L-1·s)3.27±1.786.71±6.290.03
本研究结果显示直肠癌的Ktrans、Kep、Ve及iAUC值均高于正常直肠肠壁。其中,直肠癌Ktrans和Kep值增高与目前报道的Yao等[8]及Kim等[2]的研究结果一致,因为肿瘤新生血管的结构及功能发育不完善,相较正常血管通常具有更高的渗透性和血流量,所以导致了Ktrans及Kep值的增高,同理iAUC也相应增高。但Ve的研究结果各异,Yao等[8]的结果与本文一致认为直肠癌的Ve值较正常肠壁高,而Kim等[2]的研究得出直肠癌与正常肠壁的并无差异,Janssen等[9]利用CT灌注则得出直肠癌与正常肠壁的Ve值接近。已有研究表明,肿瘤的EES会增大以满足需求量增加的氧和营养物质[3],本研究的结论符合该肿瘤血管的特点。出现前述研究结果差异的原因可能为Janssen等所使用CT灌注的采集时间较短,不能全面反映对比剂的渗透情况,所得EES的值并不准确;而Kim等的研究扫描时间够长,同样出现了阴性结果,他们提出的解释为EES还可能受多种因素如细胞密度、组织缺氧情况等的影响。
直肠黏液腺癌属于直肠癌的一种组织学分型,发生率约占结直肠癌的5~15%。研究发现其新辅助放化疗效果更不理想且预后较非黏液腺癌差[10]。因此,术前发现直肠癌是否属于黏液腺癌有助于患者合理选择新辅助放化疗并评估预后。本研究结果显示直肠黏液腺癌的Ktrans值低于非黏液腺癌,这与Oberholzer等[11]的结论相符,其病理生理学原理为黏液腺癌在细胞外形成较大的黏液湖,限制了血管内外的小分子运动,并导致了肿瘤毛细血管渗透面积的减小,从而使Ktrans值减小。黏液腺癌与非黏液腺癌在其它灌注指标方面及肿瘤分化程度的各个灌注值并无显著差异,但是目前关于粘液腺癌与非黏液腺癌的灌注值评价研究很少。在评价肿瘤分化程度方面,本文结果提示低分化与中高分化的直肠腺癌在灌注值方面并无差异。国内外有数篇研究亦就此进行了比较,但结论不一[2, 8, 12],因受局部肿瘤综合状况的影响,研究间差异较大,是否能根据灌注值来预估肿瘤的分化程度尚需进一步大样本的研究得出更可靠的证据。
淋巴结的术前评价是直肠癌的另一项重要评估内容,Langman等[13]的最新研究发现约1/3左右的直肠癌转移淋巴结直径<3 mm,超过一半的直肠癌转移淋巴结≤5 mm,因此,单纯依靠淋巴结的形态来判断转移有一定局限性,有研究提出是否可以利用功能成像来评估淋巴结转移。Yao等[8]的研究指出直肠癌是否伴有淋巴结转移与Ktrans相关,但未给出2组Ktrans的具体数值。然而,本研究结果显示伴有和不伴有淋巴结转移的直肠癌Ktrans、Kep及Ve均无差异,伴有淋巴结转移的直肠癌iAUC较不伴者低。因为淋巴结转移受病程长短、病理分化程度等多方面因素的影响,仅依靠对肿瘤本身的灌注参数来预测淋巴结转移的价值有待进一步探讨。
综上所述,本研究通过DCE-MRI定量灌注验证了直肠癌较正常肠壁微血管灌注及渗透性的改变,并发现直肠黏液腺癌的Ktrans值较非黏液腺癌低,说明了DCE-MRI定量灌注在无创反映肿瘤微循环情况方面的作用。但是,是否能仅根据肿瘤的灌注值来判断肿瘤的分化程度及淋巴结转移尚需进一步研究。
[参考文献]
[1]Choi HJ, Hyun MS, Jung GJ, et al.Tumor angiogenesis as a prognostic predictor in colorectal carcinoma with special reference to mode of metastasis and recurrence[J]. Onco-logy, 1998, 55(6):575-581.
[2]Kim YE, Lim JS, Choi J, et al. Perfusion parameters of dynamic contrast-enhanced magnetic resonance imaging in patients with rectal cancer: correlation with microvascular density and vascular endothelial growth factor expression[J]. Korean J Radiol, 2013, 14(6):878-885.
[3]Collins DJ, Padhani AR. Dynamic magnetic resonance imaging of tumor perfusion. Approaches and biomedical challenges[J]. IEEE Eng Med Biol Mag, 2004, 23(5):65-83.
[4]Lim JS, Kim D, Baek SE, et al. Perfusion MRI for the prediction of treatment response after preoperative chemoradiotherapy in locally advanced rectal cancer[J]. Eur Radiol, 2012, 22(8):1693-1700.
[5]Gollub MJ, Gultekin DH, Akin O, et al. Dynamic contrast enhanced-MRI for the detection of pathological complete response to neoadjuvant chemotherapy for locally advanced rectal cancer[J]. Eur Radiol, 2012, 22(4):821-831.
[6]万德森, 郑树. 结直肠癌[M]. 第1版. 北京: 北京大学医学出版社, 2008:40-42.
[7]尧良清, 顾漪萍, 丰有吉, 等. 卵巢癌血管生成的多样性[J]. 中国病理生理杂志, 2008, 24(1):195-197.
[8]Yao WW, Zhang H, Ding B, et al. Rectal cancer: 3D dynamic contrast-enhanced MRI; correlation with microva-scular density and clinicopathological features[J]. Radiol Med, 2011, 116(3):366-374.
[9]Janssen MH, Aerts HJ, Kierkels RG, et al. Tumor perfusion increases during hypofractionated short-course radiotherapy in rectal cancer: sequential perfusion-CT findings[J]. Radiother Oncol, 2010, 94(2):156-160.
[10]Shin US, Yu CS, Kim JH,et al. Mucinous rectal cancer: effectiveness of preoperative chemoradiotherapy and prognosis[J]. Ann Surg Oncol, 2011, 18(8):2232-2239.
[11]Oberholzer K, Menig M, Pohlmann A, et al. Rectal can-cer: assessment of response to neoadjuvant chemoradiation by dynamic contrast-enhanced MRI[J]. J Magn Reson Imaging, 2013, 38(1):119-126.
[12]谢宗源, 徐香玖, 黄刚,等. 直肠癌DCE-MRI参数与病理特征的相关性研究[J]. 磁共振成像, 2015, 6(4):289-293.
[13]Langman G, Patel A, Bowley DM. Size and distribution of lymph nodes in rectal cancer resection specimens[J]. Dis Colon Rectum, 2015, 58(4):406-414.
(责任编辑: 林白霜, 罗森)

Quantitative perfusion parameters of dynamic contrast-enhanced magne-tic resonance imaging in patients with rectal cancer: estimation of the microvascular perfusion and permeabilityXIAO Xiao-juan1, LU Bao-lan1, YANG Xin-yue1, WANG Ying1, LIU Xu-bin2, ZHAI Feng-yi1, YU Shen-ping1
(1DepartmentofRadiology,2DepartmentofPathology,TheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China.E-mail:ethan_yu@sina.com)
[ABSTRACT]AIM: To investigate the perfusion parameters using dynamic contrast-enhanced magnetic resonance imaging (DCE-MRI) in rectal cancer patients so as to explore its potential value in estimating the microvascular condition including perfusion and permeability. METHODS: The data of 38 rectal cancer patients examined with DCE-MRI was retrospectively analyzed. The perfusion parameters of carcinoma and normal rectal wall in each case were calculated, including volume transfer constant (Ktrans), rate constant of back flux (Kep), extravascular extracellular space fractional volume (Ve) and initial area under curve (iAUC). The mean values of tumor and normal rectal wall, mucinous and nonmucinous carcinoma, poorly and moderately-to-well differentiated carcinoma, case with or without lymph node metastasis were compared. RESULTS: All the parameters of rectal cancer were higher than normal rectal wall (P<0.01). No significant difference was found between poorly and moderately-to-well differentiated carcinoma in terms of Ktrans, Kepand Ve, neither was the case with or without lymph node metastasis. The cases with lymph node metastasis had lower iAUC than those without (P<0.05). CONCLUSION: Quantitative perfusion DCE-MRI answered the microvascular perfusion and permeability change of rectal cancer compared with normal rectal wall, besides it could be used to distinguish between mucinous and nonmucinous carcinoma, which demonstrated its value in the evaluation of rectal cancer. However, it should not be recommended to predict the degrees of tumor cell differentiation and lymph node metastasis just according to the perfusion parameters.
[KEY WORDS]Rectal cancer; Magnetic resonance perfusion imaging; Microvascular perfusion; Permeability
通讯作者△Tel: 0594-6923115; E-mail: xueleiwu@163.com
[收稿日期]2015- 06- 05[修回日期] 2015- 10- 14
[文章编号]1000- 4718(2015)12- 2169- 07
doi:10.3969/j.issn.1000- 4718.2015.12.009
[中图分类号]R735.3+7
[文献标志码]A
