血红蛋白和细胞色素c构象去折叠行为研究
2016-01-27凡素华宋燕玲沈芳明乔梦霞郑甜甜
凡素华,宋燕玲,沈芳明,乔梦霞,郑甜甜,张 宏,武 海
(阜阳师范学院 化学与材料工程学院,安徽 阜阳 236037)
血红蛋白和细胞色素c构象去折叠行为研究
凡素华,宋燕玲,沈芳明,乔梦霞,郑甜甜,张宏,武海*
(阜阳师范学院化学与材料工程学院,安徽阜阳236037)
蛋白质是由α-氨基酸通过肽键按一定顺序排列成一条肽链,再由一条或一条以上的肽链由次级键折叠而成的具有特殊空间结构的生物大分子,是生命的物质基础和生命活动的主要承担者。蛋白质的空间结构决定了其特殊的生物活性,一旦空间结构发生变化(如去折叠、变性、错误折叠),其生物活性将发生重大变化,甚至引发“折叠病”,如疯牛病、帕金森、老年痴呆等[1-2]。因此,研究蛋白质构象变化,并通过调节蛋白质构象以实现活性的控制,从而调控物质代谢反应及相应的生理功能,将有助于因错误折叠引起的疾病的机理研究、预防和诊断,在生物、医学及化学领域具有重要的理论意义和实用价值[3-4]。
血红素蛋白是一类含有血红素辅基的蛋白,如血红蛋白(Hb)、细胞色素c(Cyt c)、过氧化酶、肌红蛋白等。此类蛋白血红素辅基(Heme)的铁原子以6配位方式与原卟啉环的4个氮原子配位,并与蛋白组氨酸残基的咪唑环结合[5]。不同的血红素蛋白与血红素辅基的结合方式和Heme辅基活性中心的结构不同,致使其生物功能不同。Hb和Cyt c作为典型的血红素蛋白,常用于蛋白质结构与功能之间的关系、蛋白质的直接电化学性质、电化学传感器的构建等研究领域[6-7]。而且,此类蛋白的构象去折叠与结构出现紊乱时的生理条件密切相关。例如,在酸性条件改变时,由于Hb的三维构象发生改变会引起键合氧能力降低,而过氧化活性急剧增加[8]。研究Hb和Cyt c的构象变化规律,可揭示两者结构与功能之间的关系,对于调控蛋白构象并利用其活性具有重要意义。
Hb是两个由141个氨基酸残基组成的α-亚基和两个由146个氨基酸残基组成的β-亚基,按特定的接触和排列组成的一个球型蛋白质分子,每个亚基中各含有1个亚铁离子的Heme辅基。Hb不仅具有运输质子和二氧化碳等功能,而且具有氧合功能[9]。Cyt c是一种定位于线粒体内外膜间隙的血红素蛋白,广泛存在于各种含线粒体呼吸链的生物体中,是唯一能溶于水的细胞色素,在能量代谢中起着非常重要的作用[10]。这两种蛋白均具有Heme辅基,但由于其与蛋白肽链的结合方式不同,导致Hb和Cyt c的功能和构象变化机理不同。本文基于Hb和Cyt c与Heme辅基结合方式的不同而引起的结构不同,着力研究在外界环境因素改变的条件下两种蛋白的构象去折叠行为和构象变化机理,以期揭示蛋白功能与结构之间的关系,为利用蛋白构象变化产生的特殊活性提供基础。
1实验部分
1.1试剂与仪器
血红蛋白(Hb)和细胞色素c(Cyt c)购自百灵威科技有限公司(上海),KH2PO4、Na2HPO4·12H2O、尿素、盐酸胍(分析纯,国药集团化学试剂有限公司)。0.1 mol/L 磷酸缓冲溶液(PBS)由KH2PO4和Na2HPO4·12H2O溶液调配而成,利用pH计调至所需酸度。所有实验均在室温下进行,蛋白溶液于4 ℃保存,实验用水为超纯水。
吸收光谱利用双光束紫外-可见分光光度计(TU-1901,北京普析通用仪器有限责任公司)测定;荧光光谱采用FM4-NIR-TCSPC荧光光谱仪(法国FluoroMax-4)测定。
1.2蛋白去折叠及其光谱表征方法
分别移取30.00 μL浓度均为0.75 mmol/L的Hb和Cyt c溶液于3.0 mL的尿素或盐酸胍溶液中,尿素浓度分别为0,1.0,2.0,3.0,4.0,5.0,6.0,7.0,8.0 mol/L,盐酸胍浓度分别为0,1.0,1.5,2.0,3.0,4.0,5.0,6.0 mol/L,pH值均为7.0。分别测定吸收光谱和荧光光谱(λex=280 nm,狭缝为5/5 nm)。
2结果与讨论
2.1Hb与Cyt c的结构及性质
Hb是由两个α-亚基和两个β-亚基4条肽链组成的具有特殊空间结构的球型蛋白质分子(图1A)。Hb中4个亚基间靠氢键和8个离子键紧密结合,形成一个长、宽、高分别为6.4,5.5,5.0 nm的四聚体[11-12]。Hb的空间结构和肌红蛋白(Mb)的结构相似,每个亚基中含有1个高自旋5配位的Heme辅基,Fe原子除了与咪唑环的4个N原子配位外,第5个轴向配体为组氨酸(His 93),而第6个轴向存在一个空穴,可与O2分子可逆结合,具有载氧功能(图1B)。Hb并不参与生物体系的电子传递,但具有过氧化物酶和细胞色素的活性,并能与一氧化氮结合,起着平衡血液和骨骼肌中NO浓度的作用[13]。
Cyt c是由5个α螺旋通过loop连接而成的一个球形蛋白(图1C)。Heme辅基中心Fe原子与Cyt c 肽链上组氨酸(His 18)的N原子、甲硫氨酸残基(Met 80)的S原子及Heme的4个N原子配位。而且,Heme的两个乙烯基与肽链上两个半胱氨酸残基(Cys)的巯基配位形成两个硫醚键(图1D)。因此,Heme辅基这种键合于肽链的方式使得其在Cyt c疏水空腔内非常稳定[14]。Cyt c在细胞能量代谢中起着至关重要的作用,作为电子载体传递电子的方式是通过其血红素辅基中铁原子的还原态(Fe2+)和氧化态(Fe3+)之间的可逆变化,经过一系列步骤最终将O2还原成H2O,这是呼吸作用中非常重要的环节。基于Hb和Cyt c的血红素辅基与肽链的结合方式不同,这两种蛋白的构象变化所表现的性质也存在很大差异。

图1 Hb(A)和Hb的一个α-亚基的Heme辅基(B)的三维构象图以及Cyt c(C)和
2.2Hb与Cyt c的构象去折叠紫外-可见吸收光谱研究
在物理、化学因素的影响下,天然蛋白质的分子构象将发生改变,引起生物活性以及物理、化学性质的异常变化,该现象称为蛋白质的去折叠或变性[15]。只有在最适宜的条件下蛋白质方能保持天然的折叠态,显示其特有的生物活性。各种环境因素(如温度、机械力、溶液离子强度、酸度等)的改变或化学变性剂的存在均能导致蛋白质的物理化学及生物化学性质发生异常变化,甚至使其丧失生物活性。常见的化学变性剂有尿素(脲)和盐酸胍,由于诱导蛋白质去折叠的作用力方式不同,两者的蛋白质去折叠能力也有所不同。
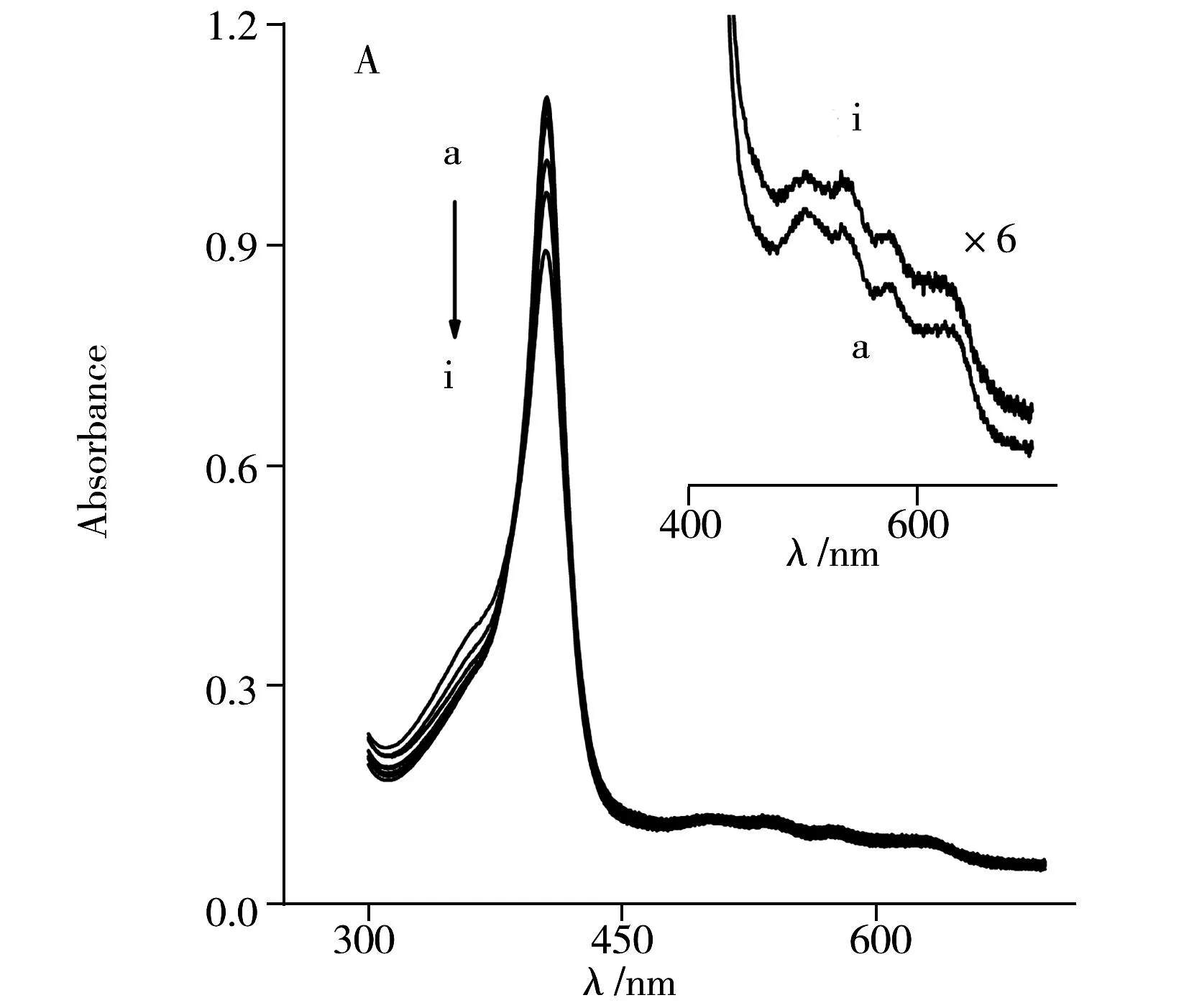
如图2所示,Hb和Cyt c在尿素和盐酸胍中去折叠时的紫外-可见吸收光谱图呈现不同的变化趋势。天然态的Hb和Cyt c分别在406 nm和409 nm处出现Heme与组氨酸配位而形成的Soret吸收带,这一吸收带的位置和形状常用于表征卟啉环和蛋白构象之间的变化[1]。另外,在470~700 nm处出现的Heme辅基的Q带常用于表征辅基周围微环境的改变。图2A和B显示随尿素溶液浓度的增加,Hb和Cyt c的Soret带吸收强度逐渐降低,即使尿素浓度高达8.0 mol/L时,其Soret带和Q带位置与形状均未发生明显变化。说明尿素可以改变Hb和Cyt c的三维结构,使其发生构象变化,但尿素的诱导去折叠能力较低,不能使Heme辅基解离。
为进一步研究两者构象的不同,使用具有更强去折叠能力的盐酸胍作为诱导剂。如图2C所示,当盐酸胍浓度在0~2.0 mol/L之间变化时,Hb在406 nm的吸收谱带先微弱增加而后下降,说明Hb的三级结构发生改变时其构象发生重排和扭曲,使Hb的疏水空腔先紧密收缩,后发生构象展开。当盐酸胍浓度为3.0 mol/L时,Hb在406 nm处的吸收峰消失,而在370 nm处出现一新的吸收峰,该峰归属于游离的Heme辅基的特征吸收。因此,在较高浓度盐酸胍的作用下,Hb的构象完全去折叠,Heme辅基发生解离后游离到溶液中。
然而,Cyt c却表现出不同的去折叠行为。如图2D所示,Cyt c在409 nm处的Soret吸收带随盐酸胍浓度的改变先增加而后降低,该现象与Hb相似。但Soret吸收带仅从409 nm轻微蓝移至402 nm处,并未发生Hb Soret吸收带的消失。这一现象说明盐酸胍能使Cyt c的结构发生去折叠,但并不能导致Heme辅基从其肽链上解离。也进一步说明Heme辅基与Cyt c的肽链通过二硫键键合,非常稳定地键合于肽链上。
通过Q带的细微改变也可以表征上述过程。比较图2A和C的插图可以看出,尿素溶液中Hb的4个Q带是Heme辅基与肽链配位后产生的吸收,当其在盐酸胍作用下发生解离后,游离Heme辅基则显示两个Q带(图2C的h曲线)。这一现象是由于Heme辅基与肽链解离,对称性增加,卟啉环的Q带个数会从4个减至2个。上述结果表明Hb与盐酸胍作用后,Hb的Heme辅基易发生脱离。而Cyt c的Q带在尿素和盐酸胍的作用下未发生明显改变(图2B和D插图),说明Cyt c的结构较为稳定,且Heme辅基难以解离。

2.3Hb与Cyt c的构象去折叠荧光光谱研究
荧光光谱技术是研究蛋白质构象变化的有效手段。多数蛋白含有色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)等具有荧光性质的氨基酸残基,其内源荧光常用于表征蛋白质的构象及微环境的改变。Hb在每一个α和β肽链上含有3个色氨酸残基[1]。Cyt c含有1个色氨酸和4个酪氨酸残基(Tyr),其中色氨酸和两个酪氨酸与血红素辅基较为接近,其它包埋在疏水环境内部。由于Hb和Cyt c含有Heme辅基,色氨酸激发态的能量向Heme辅基转移,从而使其内源荧光被Heme辅基猝灭。因此,天然态的Hb和Cyt c的荧光较弱。
图3 是Hb和Cyt c在尿素和盐酸胍诱导去折叠过程中的荧光光谱变化图。由图3A及其插图可以看出,激发波长为280 nm时,Hb显示微弱的色氨酸荧光。在尿素诱导下,由于Hb的构象逐渐展开,色氨酸与Heme辅基的距离增加致使荧光猝灭程度减弱,Hb的荧光逐渐增强。同时,由于色氨酸逐渐裸露在极性环境中,最大荧光发射波长发生红移。
天然态的Cyt c在310 nm和355 nm处分别出现酪氨酸和色氨酸的荧光峰(图3B)。由于Cyt c的酪氨酸残基较多,其在280 nm激发时,310 nm处出现酪氨酸的发射谱带。根据荧光强度随尿素浓度改变的曲线,Cyt c的荧光在尿素浓度低于3.0 mol/L时,色氨酸的荧光未发生明显改变,说明稳定性强的Cyt c构象变化较小,当尿素浓度增加时,其荧光强度逐渐增加,这与Hb的荧光变化趋势相似。
图3C和D分别是Hb和Cyt c在不同浓度的盐酸胍溶液中的荧光光谱。与尿素作用后的荧光光谱相比(图3A及插图),在盐酸胍浓度高于2.0 mol/L时,Hb的荧光变化迅速减缓,说明Hb此时逐渐完全去折叠,Heme辅基逐渐发生解离,色氨酸的荧光强度趋于最大。Cyt c的荧光随盐酸胍浓度的增大先缓慢增强,后快速增加,说明Cyt c的三维结构起始时性质较为稳定,三维构型逐渐打开后,荧光出现快速增强,这与尿素诱导去折叠时结果一致。而且,波长位置的红移进一步说明Cyt c通过二硫键与Heme辅基键合,使得辅基的稳定性增加,即使较高浓度的强去折叠试剂也难以使Heme辅基脱落。


3结论
Hb和Cyt c均为含有Heme辅基的血红素蛋白,但Heme辅基与肽链的结合方式不同。Hb的Heme辅基通过卟啉铁与组氨酸配位包埋在蛋白的疏水空腔内。Cyt c的Heme辅基不仅与卟啉铁和组氨酸配位,且与半胱氨酸形成两个硫醚键,配位后的Cyt c展现出十分稳定的结构和性质。因此,在尿素和盐酸胍化学变性剂的作用下呈现不同的去折叠行为。研究结果表明,尿素比盐酸胍的去折叠能力弱、性能温和,较高浓度的尿素难以使两种蛋白完全去折叠,Heme辅基不会发生解离。而在盐酸胍的作用下,Hb则因三维构象完全去折叠使Heme辅基发生解离,Cyt c的Heme辅基不易解离。因此,本研究结果揭示了不同的蛋白结构表现出不同的去折叠行为和机理,为解释蛋白结构与功能之间的关系提供了基础。
参考文献:
[1]Shao Q,Wu P,Gu P,Xu X Q,Zhang H,Cai C X.J.Phys.Chem.B,2011,115:8627-8637.
[2]Ridgley D M,Claunch E C,Lee P W,Barone J R.Biomacromolecules,2014,15:1240-1247.
[3]Westerheide S D,Morimoto R I.J.Biol.Chem.,2005,280:33097-33100.
[4]Mai Z B,Zhao X J,Dai Z,Zou X Y.J.Phys.Chem.B,2010,114:7090-7097.
[5]Lin Y W,Huang Z X.Prog.Chem.(林英武,黄仲贤.化学进展),2006,18(6):794-800.
[6]Wu H,Fan S H,Zhu W Y,Dai Z,Zou X Y.Biosens.Bioelectron.,2013,41:589-594.
[7]Ren Q Q,Yuan X J,Huang X R,Wen W,Zhao Y D,Chen W.Biosens.Bioeletron.,2013,50:318-324.
[8]Hristinsson H G,Hultin H O.J.Agric.FoodChem.,2004,52:3633-3643.
[9]Hou G W,Ma R N,Jia L P,Yao F,Huo R W,Li J,Wang H S.J.Instrum.Anal.(侯关伟,马荣娜,贾丽萍,姚飞,霍瑞伟,李娟,王怀生.分析测试学报),2013,32(10):1166-1173.
[10]Ma L Y.Chin.J.CellBiol.(马丽焱.细胞生物学杂志),2004,26(1):30-33.
[11]George S,Lee H K.J.Phys.Chem.B,2009,113:15445-15454.
[12]Ke X B,Shao R F,Zhu H Y,Yuan Y,Yang D J,Ratinac K R,Gao X P.Chem.Commun.(Camb),2009,14(10):1264-1266.
[13]Ma L,Wei Z Q,Huang A M,Yang H,He W R,Lin R S.ActaPhysico-ChimSin.(马林,魏志强,黄爱民,杨华,何维仁,林瑞森.物理化学学报),2009,25(9):1816-1822.
[14]Li X C,Zheng W,Zhang L M,Yu P,Lin Y Q,Su L,Mao L Q.Anal.Chem.,2009,81:8557-8563.
[15]Makhatadze G I.J.Phys.Chem.B,1999,103:4781-4785.

摘要:利用紫外-可见吸收和荧光光谱法研究了血红蛋白(Hb)与细胞色素c(Cyt c)两种血红素蛋白的去折叠行为。采用化学变性剂盐酸胍(GdHCl)和尿素(Urea)诱导两种蛋白构象去折叠,阐述了两种蛋白的去折叠机理。Hb的血红素(Heme)辅基通过与卟啉铁原子和组氨酸配位,与肽链键合的稳定性较差,在3.0 mol/L的盐酸胍作用下即发生解离。而Cyt c的Heme辅基通过卟啉与半胱氨酸形成二硫键呈现较强的稳定性,盐酸胍浓度达到6.0 mol/L也难使其发生解离。该研究为阐释蛋白构象与功能之间的关系提供了重要依据。
关键词:血红蛋白;细胞色素c;蛋白;去折叠
Investigation on the Unfolding Behavior of Hemoglobin and Cytochrome c ConformationFAN Su-hua,SONG Yan-ling,SHEN Fang-ming,QIAO Meng-xia,ZHENG Tian-tian,ZHANG Hong,WU Hai*
(School of Chemistry and Materials Engineering,Fuyang Normal University,Fuyang236037,China)
Abstract:The unfolding processes of two hemoproteins including hemoglobin(Hb) and cytochrome c(Cyt c) were investigated by using UV-Vis absorption and fluorescence emission spectrometry.The unfolding behaviors of Hb and Cyt c were induced with two chemical denaturing agents of guanidine hydrochloride(GdHCl) and urea.Weak bonding energy between heme groups and the histidine on Hb peptide caused the poor stability of heme groups and their easier dissociation from the peptide of Hb only in 3.0 mol/L GdHCl.However,high bonding force due to the disulfide bond between heme group and cysteines on Cyt c peptide chain increased the stability of Cyt c.Heme group did not dissociate from Cyt c peptide with high concentration of 6.0 mol/L GdHCl.The research provides an important basis for the elaboration of relationship between protein functions and their conformations.
Key words:hemoglobin;cytochrome c;protein;unfolding
中图分类号:O657.3;O629.73
文献标识码:A
文章编号:1004-4957(2015)12-1392-06
doi:10.3969/j.issn.1004-4957.2015.12.011
通讯作者:*武海,博士,副教授,研究方向:生物电分析化学,Tel:0558-2596249,E-mail:wuhai317@126.com
基金项目:国家自然科学基金项目(21201037,21405019);安徽省自然科学基金项目(1408085QB39);安徽省质量工程项目(2012jyxm339,2013jyxm140);安徽省教育厅重大教学改革项目(2014zdjy081)
收稿日期:2015-06-03;修回日期:2015-07-12
