缺血再灌注损伤大鼠脊髓神经元细胞凋亡、脊髓组织中内质网应激经典标志物的表达变化
2016-01-20关鑫董明岩于洋高博辽宁医学院附属第一医院辽宁锦州121000
关鑫,董明岩,于洋,高博(辽宁医学院附属第一医院,辽宁锦州121000)
缺血再灌注损伤大鼠脊髓神经元细胞凋亡、脊髓组织中内质网应激经典标志物的表达变化
关鑫,董明岩,于洋,高博
(辽宁医学院附属第一医院,辽宁锦州121000)
摘要:目的观察缺血再灌注损伤大鼠脊髓神经元细胞凋亡、脊髓组织中内质网应激经典标志物的表达变化,并探讨其意义。方法将60只SD大鼠随机分为实验组、假手术组和空白组,各20只。实验组采用经典Zivin法复制模型,动脉夹结扎左肾下腹主动脉1 h,制备脊髓缺血再灌注模型;假手术组只做左侧肋骨下缘切口,不结扎腹主动脉;空白组不做任何处理。三组分别于缺血再灌注后6、12、24、48 h,电镜观察脊髓神经元细胞的凋亡情况,Western blotting法检测脊髓组织X-盒结合蛋白1( XBP1)及C-JNK氨基末端激酶(磷酸化JNK)蛋白。结果与假手术组及空白组相比,实验组缺血再灌注6、12、24、48 h神经细胞凋亡数量多。假手术组及空白组可检测到少量表达的XBP1及磷酸化JNK蛋白。实验组再灌注6 h后,缺血再灌注梗死灶周围可以观察到明显表达的XBP1及磷酸化JNK蛋白,缺血再灌注12 h后两种蛋白表达达到高峰,24 h稍有回落,48 h仍有较高表达。结论缺血再灌注损伤大鼠脊髓神经元细胞凋亡数量增加、脊髓组织中内质网应激经典标志物XBP1及磷酸化JNK蛋白的表达增加。内质网应激参与了脊髓缺血再灌注后的神经细胞凋亡,其机制可能与促进脊髓组织磷酸化JNK和XBPI蛋白表达有关。
关键词:内质网应激;脊髓缺血再灌注; X-盒结合蛋白1; C-JNK氨基末端激酶
脊髓缺血再灌注损伤[1]在临床上十分常见,以往认为缺血再灌注损伤的主要方式是细胞坏死,但最新研究发现缺血再灌注损伤的主要方式是由细胞的凋亡引起的。过去认为介导神经细胞调亡的途径分别是线粒体途径和死亡受体途径[2],近几年发现内质网应激是介导神经细胞凋亡的新途径。内质网的主要功能是合成蛋白质,并进行修饰、折叠,将加工后的成熟蛋白转运出内质网[3]。内质网内环境必须维持在稳定平衡状态,以保证蛋白质的最佳折叠状态,这种平衡一旦遭到破坏将导致未折叠蛋白或错误折叠蛋白在内质网内聚集,即内质网应激[4]。本研究采用透射电镜检测脊髓神经细胞的凋亡情况,并应用Western blotting法观察了大鼠脊髓缺血再灌注后不同时间点内质网应激经典标志物X-盒结合蛋白1( XBP1)及C-JNK氨基末端激酶(磷酸化JNK)蛋白的表达变化,并探讨其意义。
1 材料与方法
1.1实验动物健康SD大鼠60只,雌雄不限,200~300 g,由辽宁医学院实验动物中心提供。
1.2试剂及仪器磷酸化JNK多克隆抗体、XBP1多克隆抗体购自北京博奥森生物技术有限公司; SABC免疫组化试剂盒、DAB染色剂购自北京中杉金桥生物技术有限公司;无水乙醇;多聚甲醛;二甲
苯;石蜡切片机;生物研究显微镜( BM-E) ;显微生物照相显微镜。
1.3大鼠脊髓缺血再灌注模型制备及分组所有大鼠适应性喂养1周,分笼饲养,术前8 h禁食水。采用单纯随机抽样方法将所有大鼠分为实验组、假手术组和空白组,每组20只。用10%水合氯醛0.3 mL/100 g体质量进行腹腔注射麻醉。实验组大鼠均采用经典Zivin法复制模型,从大鼠左侧肋骨下缘肋中线向下开口约3 cm,找到腹主动脉,用动脉夹夹闭1 h。1 h后松开动脉夹,检查所有大鼠腹腔无渗血后,用庆大霉素8万U冲洗腹腔,并逐层关腹。假手术组只做左侧肋骨下缘切口,不结扎腹主动脉,1 h后逐层关腹。空白组不做任何处理。各组在模型制备后的6、12、24、48 h每个时间点取5只大鼠,沿剑突打开胸腔暴露其心脏,经左心室插管至主动脉内,剪开右心耳,灌流固定。灌注完毕,立即取腰膨大以下段脊髓组织,将其分别浸入4%多聚甲醛溶液和2.5%戊二醛磷酸缓冲液中保存备用。
1.4各组大鼠脊髓神经细胞的凋亡情况观察取出2.5%戊二醛磷酸缓冲液里的脊髓组织,将其切成约1 mm3的组织块。再次浸入2.5%戊二醛中固定2 h,1%锇酸固定2~3 h,常规梯度乙醇脱水后,纯丙酮+包埋液( 2∶1)包埋,超薄切片,电镜观察神经细胞的凋亡情况并做各组凋亡细胞的定量分析。用投射电镜先在低倍下辨认凋亡的神经细胞并将其分布按网孔绘于坐标纸上,在3 000倍下,拍摄每组各时间点照片,每个时间点20张,计算照片上凋亡神经细胞数量。
1.5各组大鼠脊髓组织磷酸化JNK、XBP1蛋白检测采用Western blotting法。直接快速取出各时间点的大鼠冰上腰膨大以下0.1 g脊髓,离心取上清液。充分变性蛋白,冷却到室温后,放入电泳装置。电泳结束后转膜。1∶400稀释的XBP1一抗和1∶400稀释的磷酸化JNK一抗4℃孵育过夜。1∶2 000稀释的二抗在侧摆摇床上缓慢摇动室温孵育l h。运用Quantityone4.6.2( Bio.Rad,美国)凝胶图像分析系统对结果进行光密度扫描分析。
1.6统计学方法采用SPSS14.0统计软件。计量资料以珋x±s表示,组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠脊髓神经细胞的凋亡情况空白组及假手术组检测到少量凋亡细胞,细胞结构清晰完整;实验组检测到大量凋亡细胞存在。正常神经元细胞结构清晰完整,细胞核核膜完整,细胞核染色质颗粒均匀一致;实验组缺血再灌注6 h后,神经细胞结构不完整,核膜不完整,核仁偏移;而再灌注12 h后,脊髓神经细胞染色质固缩,并且呈斑块状聚集于核膜周围,并出现透明的空泡,但神经细胞的细胞器结构尚完整; 24、48 h仍有较多凋亡神经细胞。三组大鼠各时间点细胞凋亡数量比较见表1。
表1 三组大鼠各时间点细胞凋亡数量比较(±s)
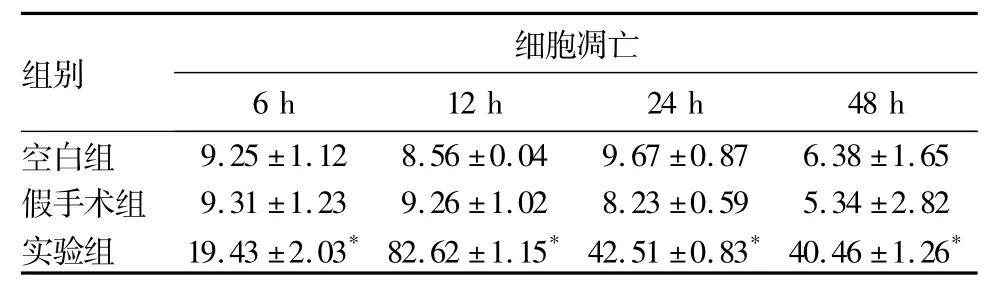
表1 三组大鼠各时间点细胞凋亡数量比较(±s)
注:与空白组及假手术组比较,*P<0.05。
组别 细胞凋亡6 h 12 h 24 h 48 h空白组9.25±1.12 8.56±0.04 9.67±0.87 6.38±1.65假手术组 9.31±1.23 9.26±1.02 8.23±0.59 5.34±2.82实验组 19.43±2.03*82.62±1.15*42.51±0.83*40.46±1.26*
2.2各组大鼠脊髓组织磷酸化JNK、XBP1蛋白表达比较假手术组及空白组可检测到少量表达的XBP1及磷酸化JNK蛋白。实验组再灌注6 h后,缺血再灌注梗死灶周围可以观察到明显表达的XBP1及磷酸化JNK蛋白,缺血再灌注12 h后两种蛋白表达达到高峰,24 h稍有回落,48 h仍有较高表达。详见图1和表2。
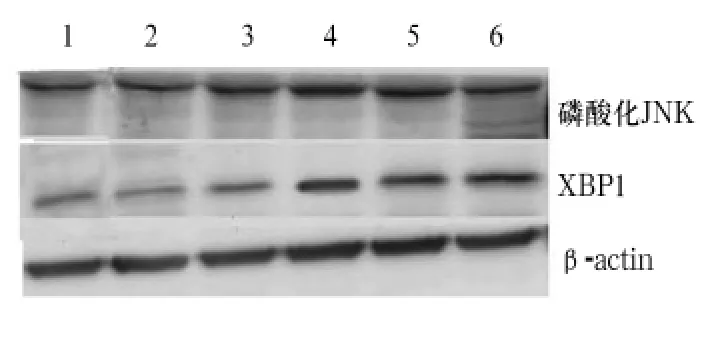
图1 各组磷酸化JNK、XBP1蛋白Western blotting法检测结果
表2 三组大鼠脊髓组织磷酸化JNK、XBP1蛋白表达水平比较(±s)

表2 三组大鼠脊髓组织磷酸化JNK、XBP1蛋白表达水平比较(±s)
注:与空白组及假手术组比较,*P<0.05。
组别 磷酸化JNK蛋白 XBP1蛋白空白组6 h 0.52±0.13 0.12±0.01 12 h 0.48±0.12 0.18±0.11 24 h 0.65±0.16 0.33±0.02 48 h 0.45±0.11 0.45±0.04假手术组6 h 0.49±0.15 0.11±0.03 12 h 0.58±0.15 0.16±0.02 24 h 0.58±0.12 0.23±0.09 48 h 0.42±0.14 0.34±0.02实验组6 h 4.98±1.08* 3.78±1.08*12 h 9.68±3.24* 8.43±1.35*24 h 7.86±1.58* 7.14±1.12*48 h 7.45±1.56* 6.24±1.24*
3 讨论
内质网应激是近年发现的介导神经细胞凋亡的
新途径[5,6],在应激的早期可以通过促进错误折叠的蛋白转化来保护机体,因此早期的干预应激反应是治疗再灌注损伤的关键。但继续应激会引起相关基因转录水平发生变化,进一步引起某些蛋白和分子伴侣合成减少,即为未折叠蛋白反应( UPR)[7]。UPR通过内质网膜上的肌醇需求激酶1( IRE1)、PKR样内质网激酶( PERK)、激活转录因子6 ( ATF6)等三个应激感受蛋白,调节未折叠或错误折叠蛋白[8]。这三个蛋白的信号通路可激活下游的信号分子XBP1介导的细胞凋亡。当内质网应激的反应水平低时,只能通过ATF6的蛋白水解活化来适应刺激,而当内质网应激处于高水平时,XBP1 mRNA的诱导由ATF6和IRE1共同参与,从而产生高活性的转录因子XBP1-S,XBP1-S进入细胞核并结合形成异源二聚体,随后进行了一系列的反应,以减少内质网应激[9,10]。当应激刺激过强或时间过长时,XBP1-S可以进一步激活其自身的启动子,ATF6-XBP1-S也可以通过进一步活化XBP1 mRNA的转录形成,失去对应激反应的处理能力,造成大量折叠蛋白的聚集,引起组织的损伤。损伤后的主要表现是神经功能的缺陷及丧失,从而引起相应的功能障碍[11]。JNK信号通路是1991年发现的一类MAPK通路。JNK最初被发现是一种特异性磷酸化核内转录因子C-JNK的激酶[12]。JNK MAPK信号通路存在于多种生命过程,是细胞的生长分化和死亡的关键路径之一。多种信号可活化JNK途径,如生长因子、细胞因子和细胞环境应激等[13]。当脊髓神经细胞发生内质网应激时,Ire1在内质网中被激活,激活后与GRP78分离,其次结合TRAF2和ASK1,进而形成Irel/TRAF2/ASK1复合体,进一步活化JNK通路,从而诱导神经细胞凋亡[14]。可见,JNK在应激反应中起着非常重要的作用,从而参与应激反应和细胞调亡。目前国内外研究已证实内质网应激参与了多种常见疾病如视网膜病变、心脑组织缺血和神经系统变性、肝炎等疾病的发病过程,在脊髓缺血再灌注损伤中也有相关的研究,但磷酸化JNK和XBPI蛋白在脊髓神经细胞应激凋亡的机制未见相关报道。
本研究结果表明,脊髓缺血再灌注损伤大鼠缺血再灌注6 h后,出现不同程度的神经细胞损伤性改变,随再灌注时间的延长而增加,12 h达高峰,24、48 h略有下降;且脊髓组织磷酸化JNK和XBPI蛋白表达出现增高的趋势,在12 h达到高峰,24 h稍有回落,48 h仍有较高表达。内质网应激启动后,早期内质网的自身保护作用发挥重要作用,此时磷酸化JNK和XBPI的表达尚低,神经细胞可适应应激反应的刺激而存活,后期内质网应激反应时间过长,内质网内未折叠蛋白聚集引起内质网功能障碍,磷酸化JNK和XBPI大量表达启动细胞的凋亡途径,引起脊髓神经细胞的凋亡。
可见,内质网应激参与了脊髓缺血再灌注损伤大鼠的神经细胞凋亡,其机制可能与促进脊髓组织磷酸化JNK和XBPI蛋白表达有关。
参考文献:
[1]Cunnane S,Nugent S,Roy M,et al.Brain fuel metabolism,aging,and Alzheimer's disease[J].Nutrition,2011,27( 1) : 3-20.
[2]李兵奎,常巍,宋跃明.脊髓损伤动物模型制备的研究进展[J].中国脊柱脊髓杂志,2012,22( 10) : 947-950.
[3]Smith PD,Puskas F,Meng X,et al.Ischemic dose-response in the spinal cord: both immediate and delayed paraplegia[J].J Surg Res,2012,174( 2) : 238-244.
[4]Zhu JW,Chen T,Guan J,et al.Neuroprotective effects of allicin on spinal cord ischemia-reperfusion injury via improvement of mitochondrial function in rabbits[J].Neurochem Int,2012,61( 5) : 640-648.
[5]M^onaco BA,Benício A,Contreras IS,et al.Ischemic preconditioning and spinal cord function monitoring in the descending thoracic aorta approach[J].Arq Bras Cardiol,2007,88( 3) :291-296.
[6]Mauriello A,Sangiorgi G,Fratoni S,et al.Diffuse and active inflammation occurs in both vulnerable and stable plaques of the entire coronary tree: ahistopathologic study of patients dying of acute myocardial infarction[J].J Am Coll Cardiol,2005,45 ( 10) : 1585-1593.
[7]Kim J,Hwang J,Huh J,et al.Acute normovolemic hemodilutioncan aggravate neurological injury after spinal cord ischemia inrats [J].Anesth Analg,2012,114( 6) : 1285-1291.
[8]Iwamoto S,Higashi A,Ueno T,et al.Protective effect of sivelestat sodium hydrate ( ONO-5046) on ischemic spinal cord injury[J].Interact Cardiovasc Thorac Surg,2009,8( 6) : 606-609.
[9]金华,郭光琼,李江,等.脊髓缺血再灌注损伤模型的改进及对大鼠神经行为学的影响[J].中风与神经疾病杂志,2012,29 ( 10) : 879-882.
[10]刘洪亮,崔玉山.Caspase-12在内质网应激中的激活途径及与疾病关系研究进展[J].环境卫生学杂志,2011,1( 4) : 41-45.
[11]Arantes C,Nomizo R,Lopes MH,et al.Prion protein and its ligand stress inducible protein 1 regulate astrocyte development[J].Glia,2009,57( 13) : 1439-1449.
[12]Simon F,Scheuerle A,Grger M,et al.Comparison of carbamylated erythropoietin-FC fusion protein and recombinant human erythropoietin during porcine aortic balloon occlusion-induced spinal cord ischemia/reperfusion injury[J].Intensive Care Med,2011,37( 9) : 1525-1533.
[13]Feezor RJ,Martin TD,Hess PJ Jr,et al.Extent of aortic coverage and incidence of spinal cord ischemia after thoracic endovascular aneurysm repair[J].Ann Thorac Surg,2008,86( 6) : 1809-1814.
[14]艾春雨,阎雪晶,江晓菁,等.改良脊髓缺血后处理对兔缺血/再灌注损伤脊髓的保护作用[J].中国医科大学学报,2011,40 ( 6) : 501-503.
收稿日期:( 2015-04-04)
通信作者:董明岩
基金项目:辽宁省科学技术计划项目( 2013225305)。
文章编号:1002-266X( 2015) 31-0027-03
文献标志码:A
中图分类号:R744
doi:10.3969/j.issn.1002-266X.2015.31.010
