缺氧预处理后骨髓源神经干细胞联合脑源性神经生长因子移植治疗大鼠脑缺血再灌注损伤的研究
2016-01-19雷延成吴世政张淑坤侯倩才鼎肖宗宇陈晓娟
雷延成,吴世政,张淑坤,侯倩,才鼎,肖宗宇,陈晓娟
脑血管病发病率、致死率、致残率和复发率均很高,在高海拔地区尤为明显[1],由于传统的治疗方法目前仍不能完成脑损伤后神经细胞的再生和修复,近来年,具有自我复制和多向分化潜能的神经干细胞(neural stem cells,NSCs)的研究成为了中枢神经损伤治疗的研究焦点之一。近年来国内外研究表明,骨髓间充质细胞(bone marrow mesenchymal stem cells,BMSCs)于体外通过诱导分化可获得骨髓源性神经干细胞(source neural stem cells of bone marrow,BMSCs-NSCs)[2-3],而脑源性神经生长因子(brain-derived neurotrophic factor,BDNF)能够促进神经细胞的存活、影响神经细胞的迁移,在体外还能促进NSCs的存活和分化[4-6]。有文献报道BMSCs与BDNF联合移植可显著改善大鼠脑或脊髓损伤及大脑中动脉阻塞再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)模型大鼠的神经功能,促进其恢复[7-10]。缺氧预处理脑保护机制是近年研究的热点,有研究表明低氧可诱导大鼠大脑皮层细胞的BDNF分泌和BDNF信使核糖核酸表达增加[11],起到脑组织的修复作用[12-13],但目前国内外尚无文献报道缺氧预处理是否能促进外源NSCs的增殖和分化,从而起到脑组织的保护作用,同时经过缺氧预处理后BMSCs-NSCs和BDNF联合移植是否进一步促进BDNF的表达而引起神经功能恢复的叠加效应。本研究对缺氧预处理后BMSCs-NSCs联合BDNF立体定向移植治疗大鼠脑缺血再灌注损伤的疗效进行了初步探讨,为高海拔缺氧地区脑梗死的细胞移植治疗提供动物实验基础。
1 材料与方法
1.1 动物及分组 72只健康成年SD大鼠,体重200~250 g;体重85 g幼鼠1只(取骨髓用),大鼠由兰州大学实验动物中心提供,合格证号:SCXK(甘)2013-0002。实验过程中对动物的处置符合动物伦理学标准。将大鼠随机分为缺氧预处理组和常氧组,每组各36只,缺氧预处理组造模前3 d先行缺氧预处理,处理方式为模拟海拔5000 m高度(氧分压11.32 kPa)的低压氧舱,每天3 h,连续3 d。本研究中常氧组在西宁地区(海拔2260 m)室内自然状态下进行饲养和实验。
两组大鼠均制作MCAO/R模型,然后每组分为3个亚组(BMSCs-NSCs+BDNF组、BMSCs-NSCs组和对照组,每组各12只),分别梗死灶同侧尾状核内立体定向移植BMSCs-NSCs+BDNF、BMSCs-NSCs和DMEM/F12培养基各10 µl。
1.2 主要材料 BDNF、DMEM/F12培养基、南美胎牛血清(fetal bovine serum,FBS)、B27、碱性成纤维生长因子(basic fibroblast growth factor,bFGF)、表皮生长因子(epidermal growth factor,EGF)、5-溴脱氧尿嘧啶(Bromouracil deoxyriboside,Brdu)、兔抗CD133抗体、小鼠抗Nestin抗体、兔抗微管蛋白(β-tubulin)Ⅲ抗体、微管相关蛋白2(microtubule-associated protein 2,MAP-2)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、半乳糖神经酰胺(galactosylceramidase,Galc)、山羊血清、山羊抗小鼠IgG和羊抗兔IgG、4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)封片剂购于美国HyClone公司。
1.3 主要仪器 低压氧舱(中航工业贵州风雷航空军械公司研制)、CO2恒温培养箱(HF-100,上海力申科学仪器有限公司)、动物立体定位仪(成都泰盟软件有限公司)。
1.4 骨髓源性神经干细胞的培养、诱导分化及鉴定 幼年SD大鼠在无菌条件下取双侧股骨、胫骨及双侧肱骨,以含10%FBS+1%青链双抗的DMEM/F12培养基10 ml重悬后接种于培养瓶中,37℃、5%CO2、饱和湿度条件下培养,24 h后更换全量培养基,去除未贴壁的细胞及杂细胞,以后每隔2~3 d换液一次,待原代细胞达80%~90%融合后,用0.25%胰酶消化后按1∶2进行首次传代培养,传代至第3~4代时进行诱导分化。
诱导分化采用无血清悬浮培养法,选择3~4代在含血清培养基中呈对数生长期的贴壁BMSCs,用0.25%胰酶消化,经吸管吹打制成单细胞悬液,加入含DMEM/F12培养基(5 ml)、bFGF 20 ng/ml(100 µl)、EGF 20 ng/ml(100 ng)、B27添加剂(100 µl)的神经筛选培养液中进行诱导分化3~5 d,待骨髓源性神经球直径为100~200 µm时传代,按1∶2瓶比例将细胞接种于25 cm培养瓶中,置37℃,5%CO2、饱和湿度培养箱中培养,2~3 d换半液一次,待骨髓源性神经球直径为100~200 µm时传代。
CD133和Nestin检测检测:①选取在无血清培养基中呈悬浮生长的状态良好的细胞球,去除培养基,0.01 mol/L的磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗3次,用4%多聚甲醛固定30 min,0.01 mol/L PBS冲洗3次;②0.3%Triton X-100破膜,室温10 min,0.01 mol/L PBS冲洗3次;③10%正常山羊血清封闭60 min;④滴加一抗:兔抗CD133和小鼠抗Nestin置湿盒中4℃孵育过夜,去除一抗,0.01 mol/L PBS冲洗3次;⑤滴加二抗:羊抗兔IgG和羊抗鼠IgG,37℃孵育1 h,去除二抗后,0.01 mol/L PBS冲洗3次;⑥用含DAPI的封片剂对细胞核进行复染,并封片,荧光显微镜下观察;⑦设阴性对照试验,以抗体稀释液代替一抗,结果镜下不显色为阴性结果。
1.5 大鼠大脑中动脉缺血再灌注损伤模型的建立及立体定向移植 采用改良的线栓法[14],制备右侧MCAO/R模型,参照Longa[15]的5分法进行评分,1~4分为造模成功,造模失败依次递补直至成功。
选取生长良好的大鼠骨髓源性神经球,加入3 ng/ml的Brdu,培养1 d后收集细胞,收集已行Brdu标记的大鼠骨髓源神经球,经胰酶消化制成单细胞悬液,0.01 mol/L PBS清洗2次,显微镜下计数,配置移植液。BMSCs-NSCs+BDNF组(BDNF 5 µl+DMEM/F12 5 µl培养基共10 µl,调整活细胞密度为5×105/10 µl)、BMSCs-NSCs组(DMEM/F12培养基10 µl,调整活细胞密度为5×105/10 µl)和对照组(仅移植DMEM/F12培养基10 µl)。3.6%水合氯醛腹腔注射麻醉大鼠,仰卧位固定,备皮沿矢状缝切开皮肤,定位后牙钻凿孔开颅,使用立体定向仪行大鼠骨髓源性神经球的颅内移植,选取大鼠右侧脑尾状核区为接种靶点,其坐标为:前囟中点前1.0 mm,矢状缝右旁开3.0 mm,硬膜下5.0 mm。将细胞悬液以1 µl/min的速度注射入靶区,除针前留针10 min,使细胞充分沉积,颅骨骨孔用消毒骨蜡密闭,缝合头皮切口。移植细胞夜无外漏,定位坐标无偏差,大鼠3 d内无死亡为移植成功。
1.6 观察指标 分别于建立MCAO/R模型前及移植后3 d、7 d、14 d、21 d、28 d、35 d对大鼠进行功能缺损评分(包括平衡木测试、行走测试、抓握测试)(表1)。上述时间段每组取2只大鼠,水合氯醛麻醉后以0.9%生理盐水快速灌注,分离大脑组织,浸入4%多聚甲醛中进行外固定,30%蔗糖浸泡脱水至沉底,快速冷冻后,采用恒温冷冻切片机进行切片,每种梗死区范围切片30张,厚度为10 µm,-20℃保存。免疫组织化学染色观察Brdu阳性细胞的迁移路径,神经元经CD133、Nestin、MAP-2、β-tubullin、GFAP、Galc 6种抗原行免疫组织化学染色,每种5张切片,行总光密度值(integral optical density,IOD)检测,了解骨髓源性神经球分化情况,进行疗效观察。
1.7 统计学 使用SPSS 19.0统计软件进行统计分析,所用数据符合正态性和方差齐性检验,均采用表示,两组间比较采用t检验,多组间比较采用单因素方差分析,两两比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠骨髓源性神经球鉴定方法与分化 免疫荧光染色结果显示,在无血清条件下培养的细胞球呈Nestin绿色、CD133呈红色为阳性,细胞核DAPI复染呈蓝色(图1),证实培养细胞为BMSCs-NSCs。BMSCs-NSCs Nestin、MAP-2、GFAP、Galc抗原免疫荧光染色均呈阳性表达(图2),表明SD大鼠BMSCs-NSCs能分化为表达神经元、星形胶质细胞及少突胶质细胞特异性标志物的细胞。
2.2 各组大鼠神经功能评定 常氧BMSCs-NSCs+BDNF组在移植后3 d、7 d、14 d、21 d、28 d和35 d 6个时间点的神经功能学评分有整体差异,其中3 d时神经功能显著高于14 d(P<0.001)、21 d(P<0.001)、28 d(P<0.001)和35 d(P<0.001)。常氧BMSCs-NSCs组在各个时间点的神经功能学评分也有整体差异,其中3 d时神经功能得分显著高于14 d(P=0.001)、21 d(P=0.001)、28 d(P=0.001)和35 d(P=0.001)。常氧对照组各时间点神经功能评分没有显著差异。
缺氧预处理BMSCs-NSCs组在移植后3 d、7 d、14 d、21 d、28 d和35 d 6个时间点的神经功能学评分有整体差异,其中3 d时神经功能显著高于14 d(P<0.001)、21 d(P<0.001)、28 d(P<0.001)和35 d(P<0.001)。缺氧预处理BMSCs-NSCs组在各个时间点的神经功能学评分也有整体差异,其中3 d时神经功能得分显著高于14 d(P=0.001)、21 d(P=0.001)、28 d(P=0.001)和35 d(P=0.001)。对照组各时间点神经功能评分没有显著差异。

表1 大鼠模型大鼠神经功能评分
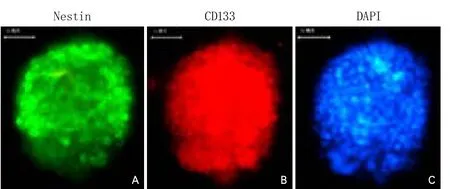
图1 大鼠骨髓源神经干细胞免疫荧光染色
缺氧预处理BMSCs-NSCs+BDNF组的神经功能学评分在7 d(P=0.031)显著低于常氧BMSCs-NSCs+BDNF组,而3 d(P=0.069)、14 d(P=0.342)、21 d(P=0.345)、28 d(P=0.362)和35 d(P=0.371)5各个时间点与常组没有显著差异;缺氧预处理BMSCs-NSCs组的神经功能学评分在3 d(P=0.143)、7 d(P=0.095)、14 d(P=0.051)、21 d(P=0.069)、28 d(P=0.067)和35 d(P=0.053)6各个时间点均与常氧BMSCs-NSCs组没有显著差异。缺氧预处理对照组的神经功能学评分只在第3天(P=0.040)显著低于常氧对照组,而7 d(P=0.102)、14 d(P=0.164)、21 d(P=0.185)、28 d(P=0.169)和35 d(P=0.171)5各个时间点与常组没有显著差异(表2)。
2.3 骨髓源性神经干细胞移植效果 移植后常氧与缺氧预处理组均有Brdu阳性的BMSCs-NSCs移植入脑。缺氧BMSCs-NSCs+BDNF组免疫组化Brdu单染,3 d时移植组在针道区域集聚Brdu阳性细胞,呈圆球形,棕色,呈簇状分布;7 d时Brdu标记的阳性细胞向周围较短距离迁移;14 d时Brdu阳性细胞仍集聚在针道区域,梗死区域可见少量迁移的Brdu阳性细胞(图3A);21 d时梗死区迁移的Brdu阳性细胞相对最多,分布较均匀,但大多数细胞仍集中针道区域及梗死区与正常脑组织交界处(图3B);28 d梗死区迁移的Badu阳性细胞数目反而略减少(图3C)。
2.4 移植后21 d骨髓源性神经干细胞在梗死区的分化情况 对移植后21 d时CD133、Nestin、GFAP、Map2、β-tubulin、Galc的荧光免疫组织化学法染色结果进行统计分析,结果显示各个指标在常氧和缺氧预处理6组间均有整体差异(表3)。进一步两两比较发现:无论常氧组还是缺氧预处理组,BMSCs-NSCs+BDNF组CD133、Nestin、GFAP、Map2、β-tubulin、Galc的IOD值均显著高于BMSCs-NSCs组(均P<0.001),BMSCs-NSCs+BDNF组、BMSCs-NSCs组各检测指标也均显著高于对照组(均P<0.001)。
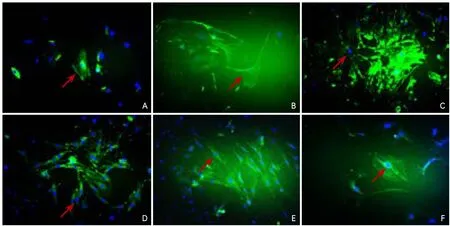
图2 骨髓源性神经干细胞CD133、MAP-2、GFAP抗原免疫荧光染色情况(荧光显微镜,200×)
缺氧BMSCs-NSCs+BDNF组与常氧BMSCs-NSCs+BDNF组CD133、Nestin、GFAP、Map2、β-tubulin、Galc检测指标IOD值无显著性差异。缺氧BMSCs-NSCs组与常氧BMSCs-NSCs组各检测指标IOD值无显著性差异。缺氧对照组与常氧对照组各检测指标IOD值亦无显著性差异。
3 讨论
NSCs移植中内外源诸多因素共同参与,相互作用是其损伤修复的机制。有研究表明急性缺氧刺激能导致内源性NSCs的增殖和分化,起到脑组织修复作用[16],但缺氧预处理能否影响外源性NSCs的增殖目前尚不清楚。
本研究显示移植BMSCs-NSCs的迁移与时间窗密切相关,移植后3 d迁移不明显,7 d时移植针道附近迁移,早期迁移并不理想,在21 d左右Badu阳性细胞到达梗死区内最多,但大多数仍集中于梗死区及脑梗死病灶与正常脑组织交界处,且以GFAP表达阳性的星形胶质细胞为主,而28 d后梗塞区阳性表达细胞数目反而略有减少,可能部分移植细胞发生了凋亡。对21 d神经细胞修复状况进行统计分析显示:BMSCs-NSCs+BDNF组与BMSCs-NSCs移植各组中均可见β-tubulin、Nestin、GFAP、CD133、Galc、MAP-2免疫组织化学染色阳性细胞表达,表明大鼠BMSCs-NSCs移植后具有分化为神经元、星形胶质细胞及少突胶质胞3种神经谱系细胞的能力。缺氧BMSCs-NSCs+BDNF组与常氧BMSCs-NSCs+BDNF组相比较,CD133、Nestin、GFAP、Map2、β-tubulin、Galc检测指标间无显著性差异,由此可见缺氧预处理并不能促进外源性移植细胞分化。但无论缺氧处理组、还是常氧组在添加BDNF后均显著促进了BMSCs-NSCs向这3者分化的比例,显著提高分化为神经元的比例,并能增加神经元突触数目与长度,促进突触连接。其可能机制如下:①BDNF可以通过酪氨酸激B(tyrosine kinase B,TrKB)受体促进神经干细胞增殖,并诱导神经干细胞向神经元和少突胶质细胞分化[17],促进了神经功能的恢复;②NSCs或已分化的星形胶质细胞、神经元等分泌多种细胞因子,促进神经的再生;③NSCs分化为少突胶质细胞,参与了神经细胞髓鞘的形成,促进了神经纤维的生长,促进了神经功能的恢复。
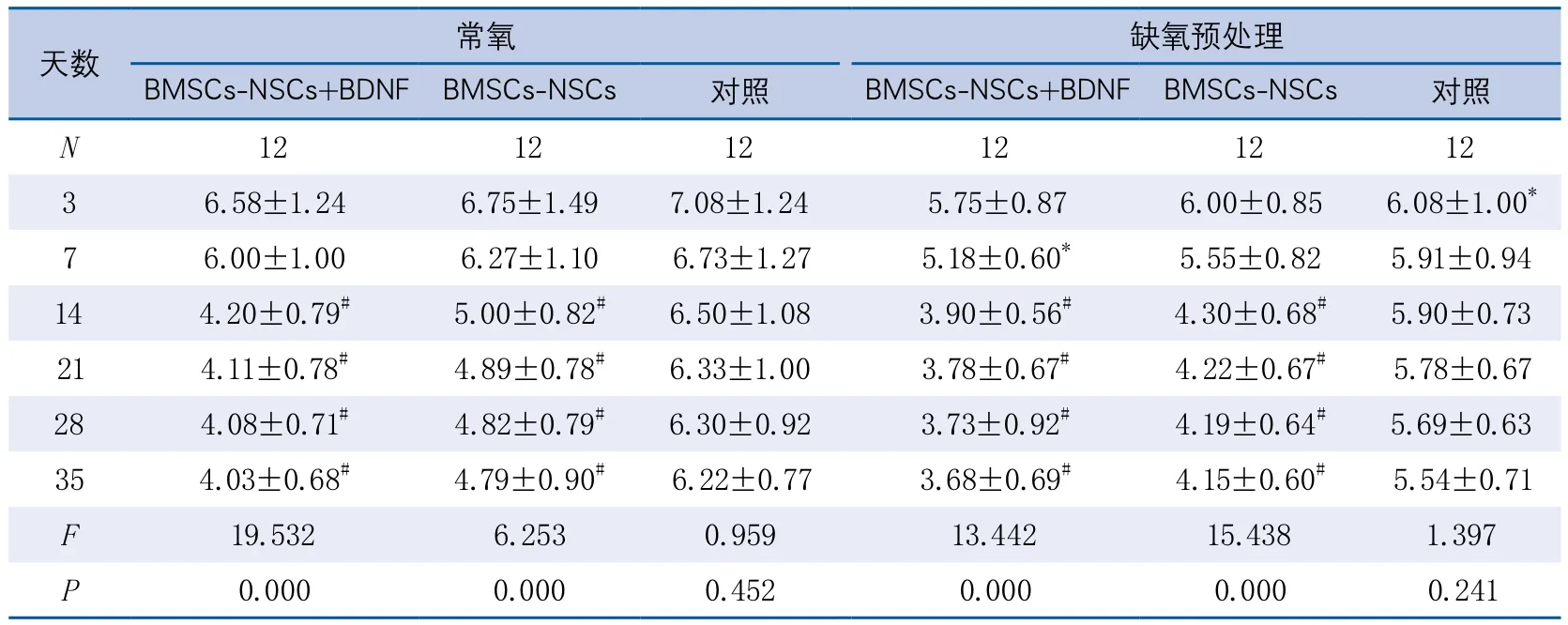
表2 各组大鼠不同时间点神经功能评分结果
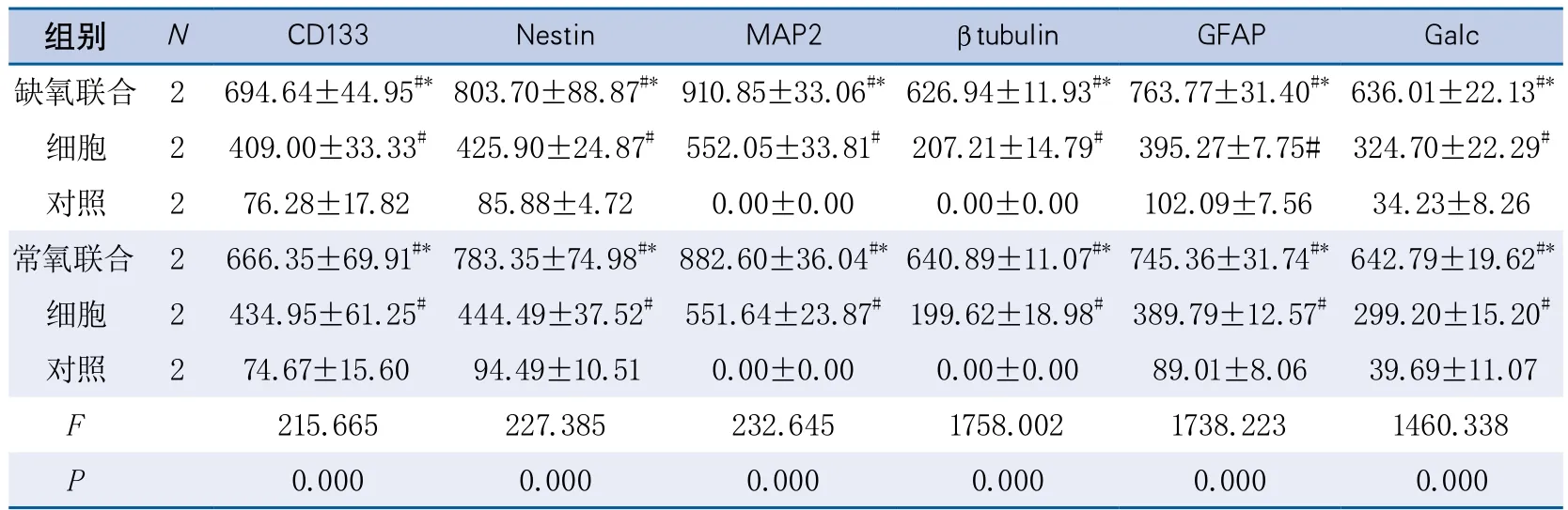
表3 细胞移植后21 d各移植组中CD133、Nestin、MAP2、β-tubulin、GFAP、Galc总光密度值
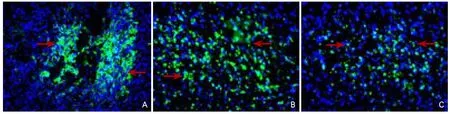
图3 骨髓源性神经干细胞移植效果
各移植组大鼠神经功能评定表明,移植后无论缺氧预处理组、还是常氧组中的BMSCs-NSCs+BDNF组及BMSCs-NSCs组大鼠神经功能均开始明显改善。移植治疗后只有缺氧预处理BMSCs-NSCs+BDNF组7 d和对照组3 d神经功能恢复情况要好于常氧对应组,而行BMSCs-NSCs+BDNF联合后7 d左右缺氧预处理对神经功能恢复最显著,考虑到本实验样本量较少,尚不能全面客观反映缺氧预处理对神经功能恢复的作用,这也是本实验不足之处。
目前研究结果证实缺氧预处理耐低氧效应相对明确,但其神经保护机制却未明确,可能涉及缺氧预处理过程中动物行为与代谢、神经形态学、动物离体脑功能活动,更可能涉及神经化学成分、分子神经生物学等诸方面的变化[18-19]。本实验中缺氧预处理并不能促进外源性BMSCs-NSCs移植细胞分化比例,但却能改善大鼠神经功能。分析可能原因有:①有研究表明缺氧预处理可诱导大鼠大脑皮层细胞的BDNF分泌和BDNF信使核糖核酸表达增加[20],国内研究表明在体外表皮生长因子浓度为20 µg/L、血清浓度为10%时,50 ng/L BDNF是促进NSCs分化为神经元的较佳浓度,超过该比例并不能增加外源性神经细胞分化[21]。而本实验缺氧BMSCs-NSCs+BDNF组中添加的BDNF含量为50 ng/L,缺氧预处理可致大脑皮层细胞分泌的BDNF,两者递加可能后已超过上限而并不能促进外源性移植细胞分化比例;②有研究表明低氧预适应后海马区内源性神经干细胞明显增殖,可能参与低氧预适应脑保护机制[16],可引起大鼠神经功能改善。其他研究也显示缺氧预处理能导致内源性神经干细胞的增殖和分化,起到脑组织的修复作用[19,22]。
本研究分组较多,但每组样本量较少,每个时间点每组大鼠免疫组织化学染色测定的例数仅有2只,因此可能会对结果造成一定偏倚。另外,本研究中的常氧组并不是平原环境下的常氧,对缺氧预处理条件下BMSCs-NSCs联合BDNF立体定向移植的机制也没有进一步研究,这些在以后的后继研究中会进一步改进。
1 He J,Gu D,Wu X,et a1. Major causes of death among men and women in China[J]. N Engl J Med,2005,353:1124-1134.
2 Lee J,Elkahloun AG,Messina SA,et al. Cellular and genetic characterization of human adult bone marrowderived neural stem-like cells:a potential antiglioma cellular vector[J]. Cancer Res,2003,63:8877-8889.
3 钟小明,余鸿. 骨髓基质细胞及其上清液对缺氧缺血脑损伤大鼠海马齿状回突触素表达的影响及机制[J].实用医学杂志,2016,3:359-360.
4 Sobeih MM,Corfas G. Extracellular factors that regulate neuronal migration in the central nervous system[J]. Int J Dev Neurosci,2002,20:349-357.
5 Ahmed S,Reynolds BA,Weiss S. BDNF enhances the differentiation but not survival of CNS stem cell derived neuronal precursors[J]. J Neurosci,1995,15:5765-5778.
6 Shetty AK,Turner DA. In vitro survival and differentiation of neurons derived from epidermal growth factor responsive postnatal hippocampus stem cells:Inducing effects of brain-derived neurotrophic factor[J]. J Neurobiol,1998,35:395-425.
7 Kurozumi K,Nakamura K,Tamiya T,et al. BDNF gene-modified mesenchymal stem cells promote functional recovery and reduce infarct size in the rat middle cerebral artery occlusion model[J]. Mol Ther,2004,9:189-197.
8 Sasaki M,Radtke C,Tan AM,et al. BDNF-hypersecreting human mesenchymal stem cells promote functional recovery,axonal sprouting,and protection of corticospinal neurons after spinal cord injury[J]. J Neurosci,2009,29:14932-14941.
9 Rakofsky JJ,Dunlop BW. BDNF function as a potential mediator of bipolar disorder and posttraumatic stress disorder comorbidity[J]. Mol Psychiatry,2012,17:22-35.
10 Hong CJ,Liou YJ,Tsai SJ. Effects of BDNF polymorphisms on brain function and behavior in health and disease[J]. Brain Res Bull,2011,86:287-297.
11 周跃辉,袁海平. 低氧对大鼠大脑皮层细胞表达脑源性神经生长因子的影响[J]. 神经解剖学杂志,2013,29:35-39.
12 孟红旗,全亚萍. 神经干细胞在神经系统疾病中的应用[J]. 中国组织工程研究与临床康复,2010,14:175-178.
13 Tian Y,Liu Y,Chen X,et al. Tetramethylpyrazine promotes proliferation and differentiation of neural stem cells from rat brain in hypoxic condition via mitogenactivated protein kinases pathway in vitro[J].Neurosci Lett,2010,474:26-31.
14 雷延成,吴世政. 改良法大鼠大脑中动脉阻塞再灌注模型的制备与效果评价[J]. 青海医学院学报,2014,4:276-279.
15 Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20:84.
16 张颜波,杨明峰. 低氧预适应刺激脑海马区内源性神经干细胞的增殖[J]. 中国组织工程研究与临床康复,2010,14:6699-6702.
17 黄斐,马广文. 脑源性神经营养因子缓释胶原凝胶支架对神经干细胞生长和分化的影响[J]. 安徽医科大学学报,2014,49:586-589.
18 Shao G,Gong KR,Li J,et al. Antihypoxic effects of neuroglobin in hypoxiaitioned mice and SH-SY5Y cells[J]. Neurosignals,2009,17:196-202.
19 疏龙飞,刘家传. 缺氧预处理对颅脑损伤大鼠抗氧化应激和神经功能的影响[J]. 中华神经医学杂志,2014,13:576-580.
20 周跃辉. 袁海平. 低氧对大鼠大脑皮层细胞表达脑源性神经生长因子的影响[J]. 神经解剖学杂志,2013,29:35-39.
21 季丽莉,佟雷. 脑源性神经生长因子促进成年大鼠脑海马神经干细胞定向分化的浓度选择[J]. 中国组织工程研究与临床康复,2007,11:9255-9258.
22 刘光杰. 刘家传. 缺氧预处理对颅脑损伤大鼠皮质内质网应激蛋白P-eIF2α表达的影响[J]. 中国微侵袭神经外科杂志,2016,2:83-86.
