适度酒精预适应对大鼠局灶性脑缺血再灌注损伤保护作用的研究
2016-01-19赵一龙郭安臣苏芳李巍巍杨华俊孙明王拥军1王群1
赵一龙,郭安臣,苏芳,李巍巍,杨华俊,孙明,王拥军1,2,3,,王群1,2,3,
缺血性卒中占卒中的60%~80%,具有高致残、高致死的特点[1]。流行病学发现适量饮用红葡萄酒可降低心脑血管疾病发病率[2]。前期研究发现:在全脑缺血再灌注模型中,适量酒精在再灌注24 h前灌胃保护了随后的脑缺血再灌注诱导的迟发性神经元损伤[3]。故本研究提出以下假设:适度酒精预适应对局灶性脑缺血再灌注诱导的神经元损伤有保护作用。本实验利用局灶性脑缺血再灌注模型,从整体和组织水平阐明适度酒精预适应对局灶性脑缺血再灌注损伤存在保护作用,为红酒的适量饮用可产生脑预适应保护,预防缺血性卒中提供理论证据,并提出“外源性适量酒精预适应激活脑内源性保护机制”的概念。
1 对象与方法
1.1 研究对象和分组 采用雄性SD大鼠,体重320~350 g[北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2012-0001]。36只大鼠随机分为假手术组、缺血/再灌注组和酒精预适应组,每组各12只。
缺血再灌注组和酒精预适应组大鼠采用线栓法制作右侧大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型,缺血2 h,再灌注24 h。
酒精预适应方法:酒精预适应组在局灶性脑缺血再灌注前24 h用95%酒精(批号41322,sigma)与0.3 ml无菌蒸馏水混合后在非麻醉状态下直接进行灌胃,95%酒精体积(μl)计算为:[大鼠体重(g)×0.6]+0.3。其余两组用同等体积的生理盐水(批号11033042,天津药业焦作有限公司)做同样灌胃处理。每组各取8只大鼠在缺血再灌注后24 h进行神经功能评分,然后麻醉处死取脑,行氯化2,3,5-三苯基四氮唑(2,3,5-Triphenyltetrazolium chloride,TTC)染色,比较各组的脑梗死体积。
每组剩余的4只大鼠,在缺血再灌注后24 h进行小动物磁共振T2加权像(T2-weighted imaging,T2WI)序列扫描,观察各组大鼠梗死体积的情况。然后将大鼠处死取脑,冷冻切片后,每只大鼠取第一躯体感觉皮质区的2张切片,1张用末端转移酶介导的脱氧尿嘧啶核苷三磷酸缺口末端标记(terminal deoxynucleotidyl transferase-mediated 2'-deoxyuridine 5'-triphosphate nick-end labeling,TUNEL)检测其凋亡性细胞死亡情况,另一张用Fluoro-Jade B检测其神经元退化变性情况。
1.2 缺血再灌注模型制作方法 用5%异氟烷(河北一品制药有限公司,京药制字H19980141)通过气体麻醉机对动物行气体麻醉,以仰卧位放置在37℃恒温板上。采用线栓法制作右侧MCAO模型[4]。具体方法为,在手术显微镜下经颈正中切口,暴露右侧颈外动脉和颈内动脉。线栓经颈外动脉断端进入颈内动脉,向内延伸约20 mm直到感到抵触感,此时线栓的头部越过大脑中动脉的起始端,并阻断大脑中动脉的血流。脑缺血2 h后线栓被拔出至颈外动脉的断端,再灌注24 h。假手术组线栓在颈外动脉断端处被结扎,不再向颈内动脉延伸,其余手术过程与其他几组相同。术后待大鼠清醒后,观察大鼠是否有肢体屈曲或偏瘫症状[5]。如果没有,说明造模不成功。将造模失败的大鼠去除,重新造模补充。
1.3 试验方法
1.3.1 神经功能行为评分 在局灶性脑缺血再灌注后24 h,采用Chen等[6]使用的行为评分方法,对各组动物进行神经功能评分(表1)。
1.3.2 TTC染色及梗死体积测量 局灶性脑缺血再灌注后24 h,动物按400 mg/kg剂量腹腔注射10%水合三氯乙醛胶浆(北京天坛医院制剂,京药制字H20083287)麻醉后,断头处死。迅速取出脑组织,检查并确定有无蛛网膜下腔出血。将每个脑组织切为2 mm厚的冠状切片,共6片,在37℃水浴中与1%TTC(Sigma-Aldrich,美国)溶液避光孵育20 min,再于10%甲醛溶液中固定10 min。将TTC染色后的6张脑片照相后保存,以进行损伤区域的测量。采用图像分析系统(HMIAS-2000,北京空海科技发展公司)计算未被TTC染色的区域,即脑缺血损伤区域。总梗死体积的计算方法为6张脑片未染色的面积总和乘以脑片厚度。
1.3.3 磁共振检查 局灶性脑缺血再灌注后24 h,动物以10%水合氯醛麻醉,应用德国Bruker 7.0 T超高场实验动物磁共振扫描仪进行头部磁共振成像(magnetic resonance imaging,MRI)的T2WI序列平扫。扫描参数:重复时间/回拨时间(repetition time/echo time,TR/TE)=3140/37 ms;层厚1.0 mm。用图像处理软件(matlab,MathWorks,美国)计算出各组动物的梗死体积。
1.3.4 TUNEL法检测细胞凋亡 磁共振检查后,将大鼠断头处死,迅速取出脑组织,以4%多聚甲醛固定,后经30%蔗糖溶液脱水,冷冻切片后用于TUNEL检测和Fluoro-Jade B染色。
每只大鼠取第一躯体感觉皮质区的1张切片,使用原位细胞凋亡检测试剂盒(No.11684817910,罗氏诊断产品有限公司,德国)进行分析。25 μm厚的冠状切片在冰上经渗透液渗透后,在每个样本上加入50 μl TUNEL反应混合液,37℃避光反应60 min。切片使用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)复染后,荧光显微镜(DMI400B,Leica,德国)观察。每张切片在梗死灶周边区随机选取5个高倍视野,每个高倍视野分别进行TUNEL阳性细胞和细胞核总数的计数,统计结果以每只大鼠的5个高倍视野TUNEL阳性细胞所占平均百分比进行分析。
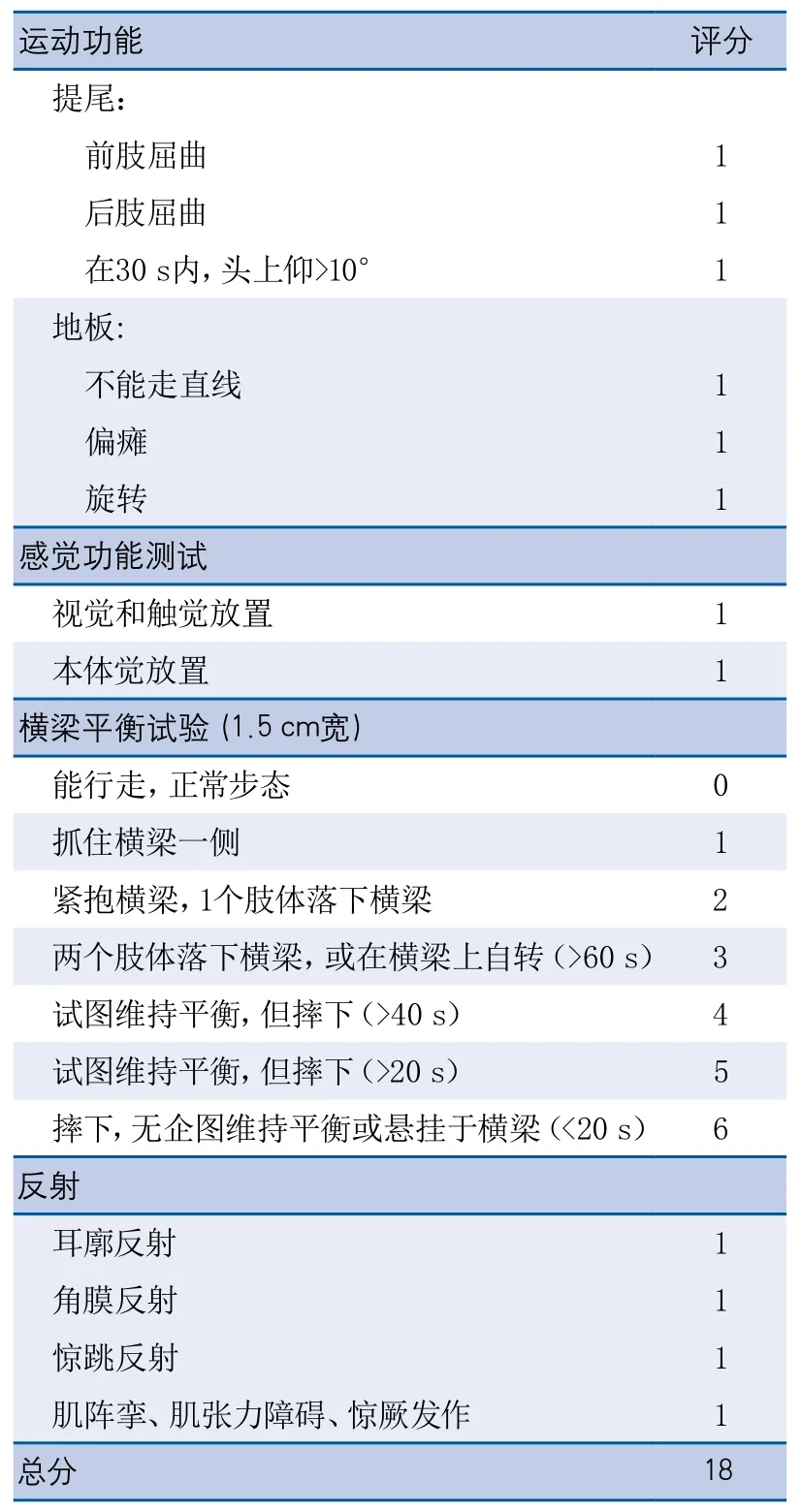
表1 大鼠脑损伤后神经功能评分
1.3.5 Fluoro-Jade B染色检测神经元退化变性 每只大鼠取第一躯体感觉皮质区的1张切片,使用Fluoro-Jade B(Histo-Chem Inc.)染液进行染色。25 μm厚的冠状切片依次在包含1%氢氧化钠的80%酒精、70%的酒精和0.06%的高锰酸钾溶液中浸泡后,用Fluoro-Jade B染液染色。经蒸馏水冲洗后,使用DAPI复染。然后放在50℃烘干机里烘干,经二甲苯浸泡后,荧光显微镜(DMI400B,Leica,德国)观察。每张切片在梗死灶周边区随机选取5个高倍视野,每个高倍视野分别进行Fluoro-Jade B阳性细胞和细胞核总数的计数,统计结果以每只大鼠的5个高倍视野Fluoro-Jade B阳性细胞所占平均百分比进行分析。
1.4 统计学分析 采用Prism软件进行统计分析,神经功能行为评分的数据为偏态分布,以中位数和四分位数表示,其他数据为正态分布,以均值±标准差表示。神经功能行为评分的数据用Kruskal-Wallis检验分析,其余各组之间比较采用单因素方差分析及Tukey检验。P<0.05被认为差异有显著性。
2 结果
2.1 TTC染色所示适度酒精预适应对局灶性脑缺血再灌注后梗死体积的影响 TTC染色显示:酒精预适应组的梗死体积较缺血再灌注组显著减少[(54.83±13.43)mm3vs(242.80±17.44)mm3,P<0.001)(图1)。
2.2 适度酒精预适应对局灶性脑缺血再灌注后神经功能缺损的影响 3组大鼠在局灶性脑缺血再灌注后24 h进行神经功能评分显示:3组大鼠的神经功能评分之间差异有显著性(KW=19.28,P<0.001)。缺血再灌注组的神经功能缺损较假手术组显著加重(P<0.001),酒精预适应组的神经功能缺损较缺血再灌注组减轻(P<0.05),酒精预适应组的神经功能缺损较假手术组差异无显著性(表2)。
2.3 磁共振成像所示酒精预适应对局灶性脑缺血再灌注后梗死体积的影响 3组大鼠在局灶性脑缺血再灌注后24 h进行头部MRI的T2WI序列平扫,结果显示:酒精预适应组的梗死体积较缺血再灌注组明显减少[(59.68±9.97)mm3vs(296.80±8.53)mm3,P<0.001](图2)。

图1 大鼠局灶性脑缺血再灌注后脑组织TTC染色图
2.4 酒精预适应对局灶性脑缺血再灌注后细胞凋亡的影响 在缺血再灌注组大鼠的右侧躯体感觉皮质区可见大量绿色的TUNEL染色阳性细胞,而通过适度酒精预适应后TUNEL染色阳性细胞数明显减少,假手术组TUNEL染色为阴性(图3)。3组大鼠的凋亡阳性细胞计数值差异有显著性(F=143.3,P<0.001,表3)。缺血再灌注组的TUNEL染色阳性细胞数所占百分比较假手术组显著增加(P<0.001),酒精预适应组的TUNEL染色阳性细胞数所占百分比较缺血再灌注组显著减少(P<0.001),酒精预适应组的TUNEL染色阳性细胞数所占百分比较假手术组显著增加(P<0.001)。
2.5 酒精预适应对局灶性脑缺血再灌注后神经元退化变性的影响 在缺血再灌注组大鼠的右侧躯体感觉皮质区可见大量绿色的Fluoro-Jade B染色阳性细胞,而通过适度酒精预适应后Fluoro-Jade B染色阳性细胞数显著减少,假手术组Fluoro-Jade B染色为阴性(图4)。3组大鼠的凋亡阳性细胞计数值差异有显著性(F=105.4,P<0.001,表4)。缺血再灌注组的Fluoro-Jade B染色阳性细胞数所占百分比较假手术组显著增加(P<0.001),酒精预适应组的Fluoro-Jade B染色阳性细胞数所占百分比较缺血再灌注组显著减少(P<0.001),酒精预适应组的Fluoro-Jade B染色阳性细胞数所占百分比较假手术组显著增加(P<0.001)。
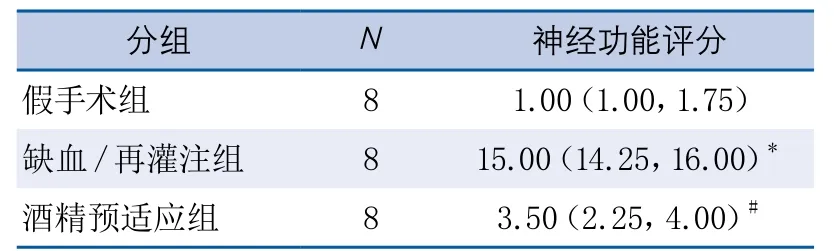
表2 酒精预适对大鼠神经功能影响

图2 大鼠局灶性脑缺血再灌注后脑组织磁共振成像T2WI图
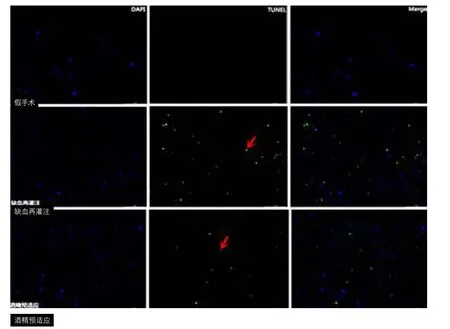
图3 大鼠局灶性脑缺血再灌注后躯体感觉皮质区的DAPI染色阳性细胞、TUNEL染色阳性细胞及TUNEL染色阳性细胞所占百分比图(200×)
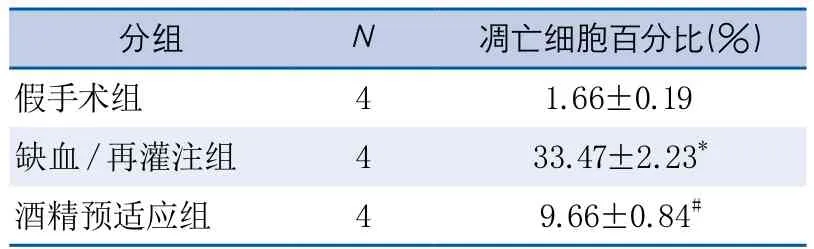
表3 TUNEL染色所示酒精预适应对细胞凋亡的影响
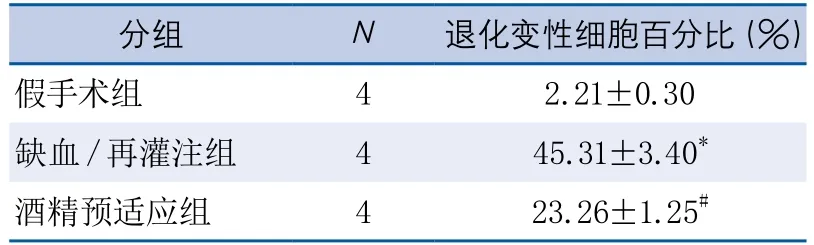
表4 Fluoro-Jade B染色所示酒精预适应对神经元退化变性的影响
3 讨论
脑缺血再灌注损伤会导致高死亡率和长期严重的生理和认知障碍[7]。其中,氧化应激反应产生的活性氧(reactive oxygen species,ROS)被认为是脑缺血再灌注损伤中的关键,这是因为其强大的氧化和还原作用,可以消耗抗氧化剂,抵制内源性抗氧化防御系统,干扰能量代谢以及导致神经细胞凋亡[8]。但是,也有研究发现,适度酒精预适应对脑缺血再灌注损伤的保护作用可能与酒精诱导了还原型烟酰胺腺嘌呤二核苷酸磷酸(triphosphopyridine nucleotide,NADPH)形成ROS有关,这可能是因为适度酒精预适应诱导了微量ROS的形成,产生了适度的氧化应激反应,从而发挥保护作用。而且,在肾中也发现这一现象[9]。因此,ROS对机体来说可能是一把双刃剑。除此之外,有文章报道适度酒精能诱导N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)[10]或者γ-氨基丁受体(γ-aminobutyric acid,GABA)[11]的激活,从而产生保护作用,但是确切的机制仍待研究。
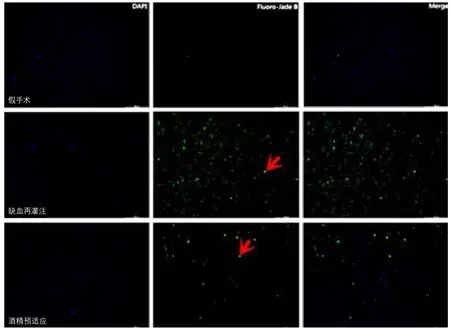
图4 大鼠局灶性脑缺血再灌注后躯体感觉皮质区的DAPI染色阳性细胞、Fluoro-Jade B染色阳性细胞及Fluoro-Jade B染色阳性细胞所占百分比图(200×)
缺血性卒中由于病因、病程、梗死部位、缺血程度及合并系统疾病的差异,导致临床变异性很大。目前临床上缺血性卒中的治疗主要集中在溶栓和神经保护方面[12]。而溶栓由于其时间窗很短,只有3~4.5 h[13],因此能得到治疗的患者是非常有限的。至于外源性神经保护剂,尽管许多药物在动物模型上显示了神经保护作用,然而在从动物到临床的转化研究中未能显示同样的效果[14]。因此,目前越来越多的研究集中在内源性神经保护方面,比如预适应[15]。
预适应是这样一种现象:短暂的亚致死损害会为随后发生的致死损伤提供强力的保护作用,它被认为是自然界中的一种常规形式[15]。预适应中最经典的是缺血预适应,已在多种器官中发现[16-17]。但是,由于缺血预适应在机体中难以实现,人们正热衷于寻找合适的药物来代替。
流行病学研究结果表明,低至中等剂量的红酒摄入能降低心肌梗死与卒中的发生率和严重程度,这可能与红酒中含有的酒精有关[18]。适度酒精预适应是预适应的一种,是指先期摄入低至中等剂量的酒精,可保护组织免受随后的缺血/再灌注造成的损伤。要产生这一保护作用,需要血浆中的酒精浓度在短时间内(30~60 min)增加到10 mmol,这相当于人饮用1~2杯酒精饮料的水平。本研究在大鼠脑缺血再灌注前24 h灌胃95%酒精,这样,血浆中的酒精浓度在灌胃后30 min增加到45 mg/dl的峰值,从而产生保护作用[19]。
已有研究表明,在脑缺血再灌注的动物模型中,适度酒精预适应可减轻大脑的梗死面积[20]。在本研究中,局灶性脑缺血再灌注后24 h脑组织TTC染色也得出了同样的结果。同时,T2WI图像结果从另一方面证明适度酒精预适应可减小局灶性脑缺血再灌注后的梗死体积。
有研究表明,适度酒精预适应能明显减轻大鼠全脑缺血再灌注后的细胞凋亡和神经元退化变性[21]。在本研究中,TUNEL染色和Fluoro-Jade B染色的结果表明,适度酒精预适应能明显减轻大鼠局灶性缺血再灌注后躯体感觉皮质区的细胞凋亡和神经元退化变性,提示酒精对脑缺血再灌注的保护作用可能介导了细胞凋亡和神经元退化变性途径,其机制有待进一步研究证实。
需要指出的是,虽然本研究表明适量的酒精摄入会对机体产生保护作用,但作为动物实验存在向临床实际效果转化的问题,而且本研究没有对酒精预适应对大鼠缺血再灌注长期神经功能影响进行研究。目前,酒精的预保护作用的确切机制尚不清楚,需要再进行大量的研究来探讨;酒精预适应对细胞凋亡的影响究竟是抑制细胞凋亡还是延缓了凋亡的发生,这需要大鼠脑缺血后观察至7 d的实验来验证;另外,酒精预适应对脑缺血后细胞凋亡的时间效应作用也有待完善。
1 Flynn RW,MacWalter RS,Doney AS. The cost of cerebral ischaemia[J]. Neuropharmacology,2008,55:250-256.
2 Collins MA,Neafsey EJ,Mukamal KJ,et al. Alcohol in moderation,cardioprotection,and neuroprotection:epidemiological considerations and mechanistic studies[J]. Alcohol Clin Exp Res,2009,33:206-219.
3 Wang Q,Sun AY,Simonyi A,et al. Ethanol preconditioning protects against ischemia/reperfusion-induced brain damage:role of NADPH oxidase-derived ROS[J]. Free Radic Biol Med,2007,43:1048-1060.
4 Sun M,Zhao YM,Gu Y,et al. Therapeutic window of taurine against experimental stroke in rats[J].Transl Res,2012,160:223-229.
5 Bederson JB,Pitts LH,Tsuji M,et al. Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J]. Stroke,1986,17:472-476.
6 Chen J,Sanberg PR,Li Y,et al. Intravenous administration of human umbilical cord blood reduces behavioral def i cits after stroke in rats[J]. Stroke,2001,32:2682-2688.
7 Sun K,Fan J,Han J. Ameliorating effects of traditional Chinese medicine preparation,Chinese materia medica and active compounds on ischemia/reperfusion-induced cerebral microcirculatory disturbances and neuron damage[J]. Acta Pharm Sin B,2015,5:8-24.
8 Hu Y,Deng H,Xu S,et al. MicroRNAs regulate mitochondrial function in cerebral ischemiareperfusion injury[J]. Int J Mol Sci,2015,16:24895-24917.
9 Yuan Q,Hong S,Han S,et al. Preconditioning with physiological levels of ethanol protect kidney against ischemia/reperfusion injury by modulating oxidative stress[J]. PLoS One,2011,6:e25811.
10 Collins MA,Neafsey EJ,Wang K,et al. Moderate ethanol preconditioning of rat brain cultures engenders neuroprotection against dementia-inducing neuroinflammatory proteins:possible signaling mechanisms[J]. Mol Neurobiol,2010,41:420-425.
11 Krenz M,Korthuis RJ. Moderate ethanol ingestion and cardiovascular protection:from epidemiologic associations to cellular mechanisms[J]. J Mol Cell Cardiol,2012,52:93-104.
12 Kikuchi K,Uchikado H,Morioka M,et al. Clinical neuroprotective drugs for treatment and prevention of stroke[J]. Int J Mol Sci,2012,13:7739-7761.
13 Fisher M,Hachinski V. European Cooperative Acute Stroke Study III:support for and questions about a truly emerging therapy[J]. Stroke,2009,40:2262-2263.
14 Willing AE. Experimental models:help or hindrance[J]. Stroke,2009,40:S152-154.
15 Stetler RA,Leak RK,Gan Y,et al. Preconditioning provides neuroprotection in models of CNS disease:paradigms and clinical significance[J]. Prog Neurobiol,2014,114:58-83.
16 Bonservizi WG,Koike MK,Saurim R,et al.Ischemic preconditioning and atenolol on lung injury after intestinal ischemia and reperfusion in rats[J].Transplant Proc,2014,46:1862-1866.
17 Tsutsui H,Tanaka R,Yamagata M,et al. Protective effect of ischemic preconditioning on ischemia/reperfusion-induced acute kidney injury through sympathetic nervous system in rats[J]. Eur J Pharmacol,2013,718:206-212.
18 Onishi A,Miyamae M,Inoue H,et al. Sevoflurane confers additive cardioprotection to ethanol preconditioning associated with enhanced phosphorylation of glycogen synthase kinase-3beta and inhibition of mitochondrial permeability transition pore opening[J]. J Cardiothorac Vasc Anesth,2013,27:916-924.
19 Yamaguchi T,Dayton C,Shigematsu T,et al.Preconditioning with ethanol prevents postischemic leukocyte-endothelial cell adhesive interactions[J]. Am J Physiol Heart Circ Physiol,2002,283:H1019-1030.
20 Liao SL,Chen WY,Raung SL,et al. Ethanol attenuates ischemic and hypoxic injury in rat brain and cultured neurons[J]. Neuroreport,2003,14:2089-2094.
21 Wang Q,Kalogeris TJ,Wang M,et al. Antecedent ethanol attenuates cerebral ischemia/reperfusioninduced leukocyte-endothelial adhesive interactions and delayed neuronal death:role of large conductance,Ca2+-activated K+channels[J].Microcirculation,2010,17:427-438.
