猪源性成分检测中3种DNA提取方法比较
2016-01-13王萍,乔勇升,韩芷玲

猪源性成分检测中3种DNA提取方法比较
王萍,乔勇升,韩芷玲
(江苏省泰州市食品药品检验所,江苏泰州225300)
摘要:为了达到对动物源性成分快速、准确的检定,对提取动物源性基因组DNA的方法进行了比较分析。考察酚-三氯甲烷法、聚乙烯吡咯烷酮法(PVP法)和试剂盒法这3种方法对DNA提取的浓度、纯度及实时荧光PCR扩增效果的影响。结果表明:酚-三氯甲烷法提取DNA浓度最高,试剂盒法纯度最高且实时荧光PCR扩增效果最好,但PVP法操作简单、安全、经济,提取的DNA用于实时荧光PCR扩增检出限可达1.98 pg/μL。使用PVP法对市场上10份不同类型的动物性产品进行了检测,检出两份产品中含有猪源性成分。PVP法应是3种方法中的首选方法,本文为实验室选择合适的DNA提取方法提供了依据。
关键词:猪源性;DNA提取;酚-三氯甲烷法;PVP法;试剂盒法;实时荧光PCR
doi:10.3969/j.issn.1672-3678.2015.06.011
收稿日期:2015-03-24
作者简介:王萍(1983—),女,江苏泰州人,工程师,硕士,研究方向:食品检测,E-mail:wingping02091111@126.com
中图分类号:TS207.3
文献标志码:A
文章编号:1672-3678(2015)06-0061-04
Abstract:In order to detect animal-derived material rapidly and accurately,we compared and analyzed the DNA extraction methods from the animal-derived material. We investigated the effect of three methods (phenol-chloroform method,polyvinylpyrrolidone method(PVP method) and reagent kit method) on the concentration of the extracted DNA,the purity of the extracted DNA and the result of the real-time fluorescent PCR amplification. The DNA concentration of the phenol-chloroform DNA extraction method was the highest,the purity of reagent kit was the highest and the effect of the real-time fluorescent PCR amplification was the best,but the PVP method was convenient,safe and economical,the detection limit of the real-time fluorescent PCR amplification was 1.98 pg/μL. Ten different types of animal products in the market were tested with PVP method,two products were detected to contain the porcine-derived material. The PVP method should be the preferred of the three methods. The assay provided a basis for the laboratory to choose a suitable DNA extraction method.
Keywords:porcine-derived; DNA extraction; phenol-chloroform method; PVP method; reagent kit method; real-time fluorescent PCR
Comparison of three DNA extraction methods in detection of porcine-derived material
WANG Ping,QIAO Yongsheng,HAN Zhiling
(Jiangsu Taizhou Institute for Food and Drug Control,Taizhou 225300,China)
食品安全关系着人类身体健康,是全社会关注的热点问题。近年来肉制品掺假屡禁不止,肉制品以次充好,引起人们对食品安全的恐慌,这就要求食品监管部门能够对动物源性成分进行快速、准确的检验和鉴定。
用于动物源性成分的鉴定主要有物理、化学、免疫学和分子生物学等方法。其中,以检测DNA为基础的实时荧光定量PCR技术具有特异性强、灵敏度高、定量准确、自动化程度高等优点,被广泛用于分子生物学和医学研究等领域。DNA模板质量对荧光定量PCR很关键,在提取过程中若是处理不当,残留的一些有机物以及其他一些杂物就会抑制PCR的进行,从而造成假阴性,影响后续操作的进行;此外不同实验材料的组分差异,不同方法所提取的DNA质量也不尽相同,对后续的实验结果也存在差异[3-4]。提取基因组DNA的方法有很多:酚-三氯甲烷法是实验室常用的经典DNA提取方法,商业化的基因组DNA提取试剂盒目前也被实验室广泛使用,而聚乙烯吡咯烷酮(PVP)在提取植物基因组DNA方面报道的较多[5-8],在提取动物基因组DNA方面报道的较少。
本文以猪肉为实验材料,考察这3种提取动物源性基因组DNA方法,以期从中筛选出一种简单、快速、更适合于实时荧光PCR扩增检测动物源性基因组DNA的提取方法,从而为实验室提供方法依据。
1材料与方法
1.1 材料
猪肉以及10份不同类型的其他动物性材料(蜜汁牛肉、牛肉丸 、牛肉切片、牛肉卷、牛柳、羊肉卷、羊肚、羊肉切片、羊排、羊腿)购自农贸市场或超市。所有材料买回后剪碎,装入样品袋,置于-20 ℃冰箱中备用。
1.2 主要试剂与仪器
TaKaRa DNA 提取试剂盒及实时荧光PCR猪源性DNA检测试剂盒,宝生物工程(大连)有限公司;抽提缓冲液(pH8.0),Tris 0.05 mol/L,Na2EDTA 0.05 mol/L,SDS 30 g/L,使用HCl或KOH调节pH;提取缓冲液(pH 8.0),Tris 0.2 mol/L,NaCl 0.25 mol/L,Na2EDTA 0.025 mol/L,SDS 50 g/L,使用HCl或KOH调节pH。
7500型荧光定量PCR仪,美国ABI公司;Lambda 35型紫外-可见光分光光度计,美国PE公司;SORVall D-37520型高速冷冻离心机,美国Thermo fisher公司。
1.3 3种DNA提取方法
采用酚-三氯甲烷法、PVP法、试剂盒法[10]3种方法对试验材料进行DNA提取。不同方法所用样品量均为0.25 g,放入经-20℃冰箱预冷24 h的研钵中,快速用力研磨粉碎后分装于编号的2 mL离心管中,每种方法重复3次。
1.3.1酚-三氯甲烷法
分别称取0.25 g粉碎的猪肉置于编号为F1、F2、F3的离心管中,具体操作参照文献,其中RNA酶消化这一步省略。
1.3.2PVP法
分别称取0.25 g粉碎的猪肉置于编号为P1、P2、P3的离心管中,加入1 mL提取缓冲液,65 ℃搅拌1 h,室温下冷却后将60 mg PVP粉末和0.5×体积的乙酸氨(7.5 mol/L)溶液与上清液混合,冰浴30 min;10 000g离心10 min,取上清液至另一离心管中,加入等体积的三氯甲烷和异戊醇(24∶1)混匀,12 000g离心5 min,抽提1次;将上清与等体积的异丙醇混合,-20 ℃放置30 min。4 ℃条件下10 000g离心10 min,弃上清液,70%乙醇溶液洗涤沉淀2次,干燥后溶于100 μL灭菌双蒸水中,4 ℃保存备用。
1.3.3试剂盒法
分别称取0.25 g粉碎的猪肉置于编号为SH1、SH2、SH3的离心管中,具体操作见试剂盒说明书。
1.4 DNA质量检测
取20 μL DNA样品,加1 980 μL双蒸水稀释,充分混匀后,以双蒸水做空白对照[11],用紫外-分光光度计分别测定核酸在260、280和230 nm处OD值,OD260/OD280代表DNA的纯度,OD260/OD280比值在1.8左右,表明DNA纯度高,低表明有杂蛋白质及苯酚[12],高则表明有RNA;OD260/OD230比值通常大于2,低则可能有核苷酸、氨基酸、盐等小分子物质残留。DNA浓度计算按照式ρ=OD260×稀释倍数×50计算。
1.5 实时荧光PCR扩增检测
3种方法所提DNA稀释至10 μg/mL作为扩增模板,使用ABI 7500荧光定量PCR仪扩增,PCR反应体系为25 μL,各成分组成:ddH2O 9.5 μL,2×Premix for Porcine 12.5 μL,Primer Mix for Porcine 1 μL,Probe Mix for Porcine 1 μL,DNA模板1 μL;PCR反应程序:95 ℃,10 s;95 ℃ 5 s,60 ℃ 34 s,40个循环,60 ℃延伸时收集荧光信号。检测试剂盒是采用双标记荧光(FAM、HEX)在同一反应管内对猪COX I基因及内参照反应同时进行扩增,若FAM荧光检出,且Ct值(每个反应管内的荧光信号达到设定的阈值时所经历的循环数)≤35则视为检出猪源性成分,若Ct值>35,则视为未检出猪源性成分。
1.6 灵敏度检测
提取的DNA模板用无菌双蒸水10倍梯度稀释,进行实时荧光PCR反应,检测所提DNA的扩增检测限。
2结果与讨论
2.1 3种方法提取的DNA质量比较
PCR扩增对模板DNA的质量要求较高,3种DNA提取方法在原方法上稍加改进:首先用-20 ℃预冷的研钵研磨代替了-196 ℃的液氮研磨,操作上更加安全;酚-三氯甲烷法省去了RNA酶进行RNA消化的过程,PVP法通过反复试验发现需要增加1次三氯甲烷:异戊醇抽提才能去除蛋白质,可能跟所选材料动物性制品中脂肪和蛋白质较多有关系。从表1中可以看出酚-三氯甲烷法提取的DNA浓度最高,PVP法提取的次之,试剂盒法提取的最低;但试剂盒法提取的DNA纯度最高,酚-三氯甲烷法提取的DNA中含有一些RNA,PVP法提取的DNA中则有一些残留的蛋白质,3种方法提取的DNA中都有一些盐等小分子物质残留。
2.2 3种方法提取的DNA实时荧光PCR扩增效果
3种方法提取的猪源性基因组DNA在相同质量浓度(10 μg/mL)和条件下进行实时荧光PCR扩增反应,Ct值见表2。HEX和FAM荧光信号均被检出,且FAM的Ct值在19.018~20.648之间,说明3种方法提取的DNA在同浓度及同条件下扩增效果相差不大,并且都可直接用于实时荧光PCR扩增检测,都能满足后续分子生物学的需要。其中试剂盒法的FAM荧光信号的Ct值最小,扩增效果最好;酚-三氯甲烷法次之;PVP法的Ct值最高。由此,也进一步说明了DNA模板的质量影响着荧光定量PCR反应的进行。
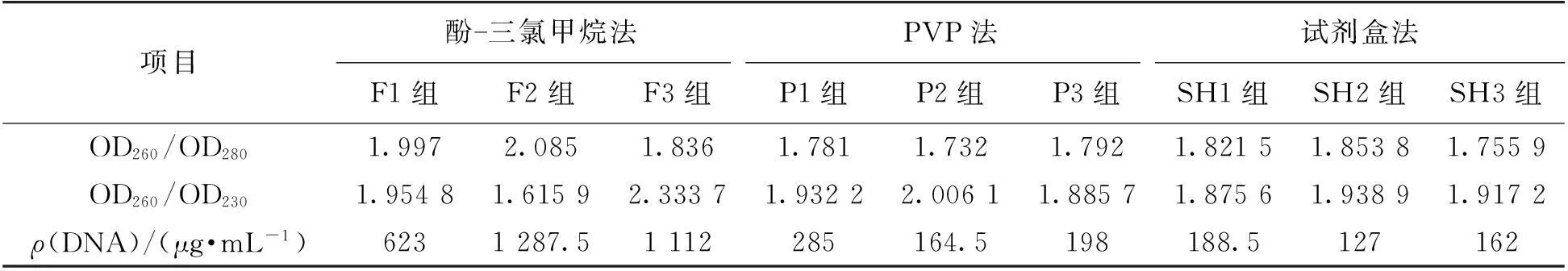
表1 3种方法提取猪源性基因组DNA质量比较
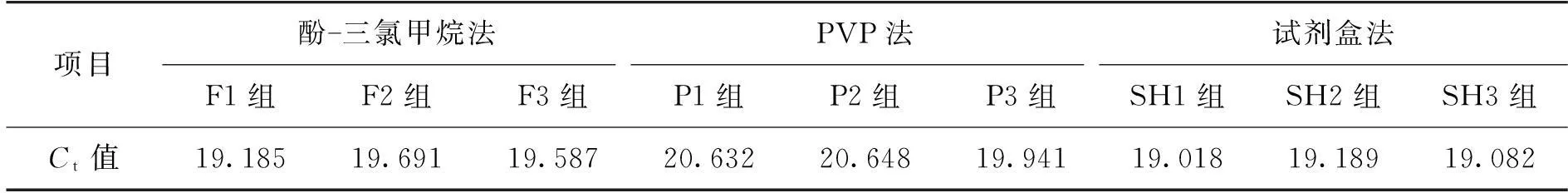
表2 3种方法提取猪源性基因组DNA用于实时荧光PCR扩增的 C t值
2.3 以PVP法提取的DNA为模板的检出限试验
将PVP法提取的质量浓度为198 μg/mL的DNA作为模板,10倍梯度稀释后实时荧光PCR扩增检测,各梯度反应体系中的模板量分别为19.8、1.98、0.198、0.019 8和0.001 98 ng/μL,扩增曲线见图1。由图1可知,实时荧光PCR可检出1.98 pg/μL的DNA样品。这说明PVP法提取的DNA用于实时荧光PCR检测灵敏度可达到皮克级。
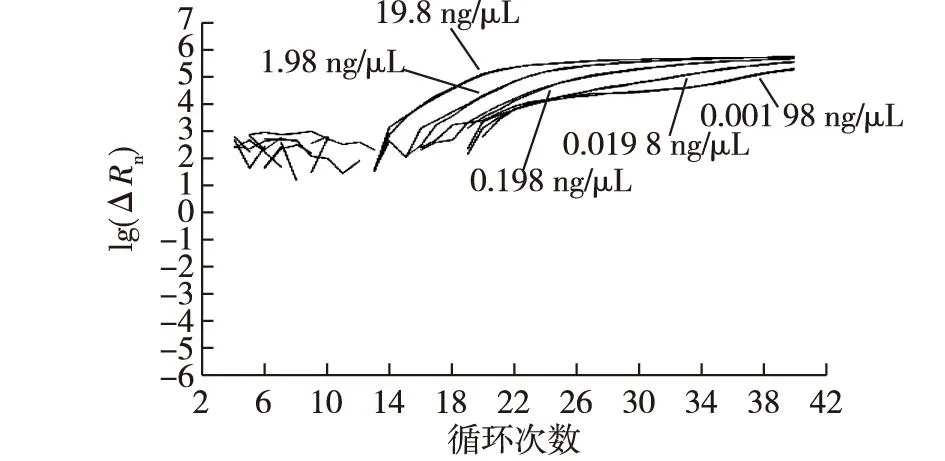
图1 PVP法提取的DNA为模板的检出限试验 Fig.1 Detection limit test using DNA extracted with PVP method as template
2.4 市售动物性产品的猪源性成分检测
随机选取市场上10份不同类型的动物性制品作为样品,用PVP法提取DNA进行实时荧光PCR扩增检测猪源性成分,其中蜜汁牛肉和牛肉卷2份样品检出为阳性,Ct值分别为17.222和20.401(均<35),扩增曲线见图2。由图2可见,这2份样品都掺入了猪肉欺骗消费者,2份阳性样品的检出也说明了PVP方法也适合于其他动物性样品的基因组DNA提取。
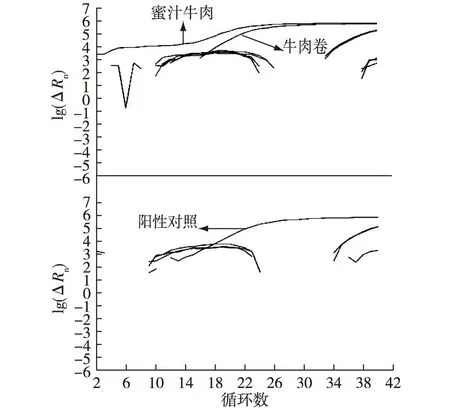
图2 PVP法检测市售动物性产品的猪源性成分 Fig.2 Detection of porcine-derived material in animal products from the market with PVP method
3结论
3种方法所提DNA都可直接用于实时荧光PCR扩增,其中酚-三氯甲烷法所提DNA浓度较高,但是该方法在操作上比较繁琐,提取时间长,有机溶剂抽提次数多,对人体有一定的伤害;试剂盒法所提DNA纯度较高,提取时间最短,但是所得DNA量较少,且
试剂盒本身价格也较昂贵;PVP法操作过程相对简单,有机溶剂用得少,虽然实时荧光PCR扩增检测Ct值是最高的,但是其DNA模板经过稀释,灵敏度可达到皮克级,完全满足分子生物学的需求。
综上所述,PVP方法操作简单、安全、经济、实时,荧光PCR扩增效果好,可以检出市售动物性肉制品中的猪源性成分,是3种方法中的首选方法。
参考文献:
[1]Mikael K A,Jose M A,Martin B,et al.The real-time polymerase chain reaction.Mol Aspects Med,2006,27:95-125.
[2]宋君,牛蓓,王东.两种蛋白质变性剂在转基因成分检测中的抑制作用.西南农业学报,2010,23(5):1170-1172.
[3]Donna S,Philip W,Solke H,et al.Comparison of several methods for the extraction of DNA from potatoes and potato-derived products.J Agric Food Chem,2005,53(26):9848-9859.
[4]Meti B G,Torstein T,Jose L L P,et al.Comparison of nine different real time PCR chemistries for qualitative and quantitative applications in GMO detection.Anal Bioanal Chem,2010,396(6):2023-2029.
[5]邓立超,邱道寿,屠乃美,等.PVP对烟草基因组DNA提取的影响.广东农业科学,2009(5):37-39.
[6]刘玉皎,李萍,张小田.β-巯基乙醇和PVP对蚕豆DNA质量的影响.湖北农业科学,2008(3):248-250.
[7]闫光照,郑根昌,王伟.β-巯基乙醇与PVP在红干椒DNA提取中的比较研究.内蒙古民族大学学报,2009(1):51-54.
[8]杜道林,马文儒,苏杰,等.SDS、CTAB、和PVP法提取香蕉基因组DNA的比较研究.海南师范学院学报,2003,16(1):74-80.
[9]国家质量监督检验检疫总局.GB/T19495.3—2004转基因产品检测核酸提取纯化方法.北京:中国标准出版社,2004:5-6.
[10]国家质量监督检验检疫总局.SN/T 2051—2008食品、化妆品和饲料中牛羊猪源性成分检测方法.北京:中国标准出版社,2008:11-12.
[11]曲衍洪,田琳,李玉梅,等.环氧丙烷皂化废水活性污泥DNA提取方法的比较与优化.生物加工过程,2015,13(1):41-46.
[12]周正,吕二盼,周巍,等.动物源性食品鸭血、猪血DNA提取方法研究及双重PCR检测.食品工业,2012,33(11):161-165.
(责任编辑荀志金)
