长期保存活力低下的大肠杆菌制备感受态细胞条件的优化
2015-10-20晏国洪姜山
晏国洪 姜山

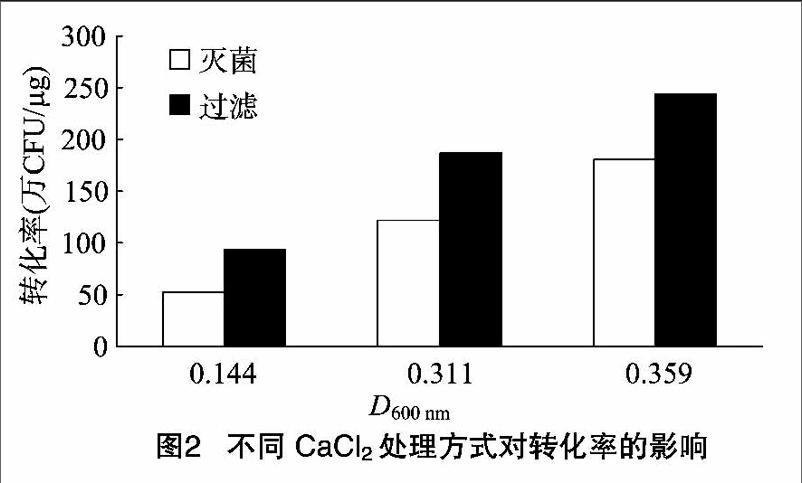
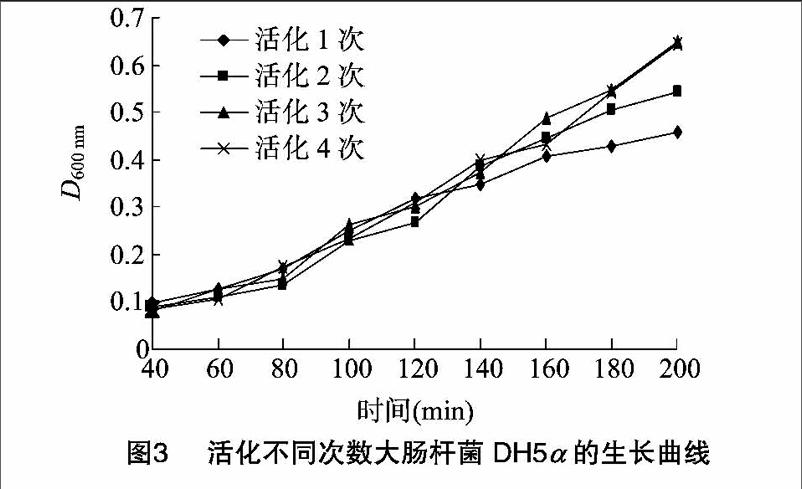
摘要:研究了CaCl2,溶液处理方法、长期保存的原始菌种活化次数、离心条件对感受态细胞最终转化效率的影响,并分析其最佳转化效率参数、优化感受态制备和转化方法。结果发现:使用过滤处理的GaCl2比灭菌处理的CaCl2制备的感受态细胞转化效率高。在其他条件相同的情况下,长期保存的大肠杆菌菌种活化3次以上的转化率最高;制备感受态细胞第1次离心在4℃、4 000g条件下离心15min,第2次离心时在4℃、4000g条件下离心5min得到的感受态细胞转化率最高。
关键词:大肠杆菌;感受态细胞;转化率;优化
中图分类号:Q813.1+1 文献标志码:A 文章编号:1002-1302(2015)05-0046-03
DH5α是一种常用于质粒克隆的菌种。感受态细胞的制备和转化是分子生物学实验室频繁使用的一项重要的常规操作。大肠杆菌(Escherichia coli)DH5α在使用含NPTⅡ质粒载体转化时,可用卡那霉素鉴别重组菌株。重组DNA转化细菌技术的关键是通过物理或者化学的方法,人工诱导细菌细胞成为敏感的感受态细胞,这种细胞易接受外源DNA,但由于转化是一个很复杂的过程,具体的作用机理尚不明确。一些优良的大肠杆菌菌种价格较贵或获得途径较难,而实验室保存的大肠杆菌菌种一般时间较长(约5~10年),导致菌种部分死亡和活力降低,在实际操作中制得的感受态细胞转化效率常常不能满足试验的要求。
对于大肠杆菌而言,外源DNA导入主要有电穿孔转化法、MgCl2-DMSO法、Inoue法、CaCl2法等多种。电穿孔转化法需要特殊的仪器设备,MgCl:-DMSO法和Inoue法操作比较复杂。而CaCl2转化法操作相对简单、方便,而且成本非常低廉,已成为实验室进行基因克隆操作常用方法。CaCl2法制备感受态细胞的关键因素有CaCl2溶液的质量、大肠杆菌DH50z生理状况、制备过程中的离心条件。本试验用CaCl2法对保存了5.5年的菌种按以上3个关键因素设计试验,优化感受态细胞的制备条件。
1.材料与方法
1.1材料
1.1.1菌种与质粒大肠杆菌DIlSa由贵阳医学院寄生虫实验室赠送,pRll01-ON质粒购置于TaKaRa公司(图1)。
1.1.2试剂LB培养基,卡那霉素素溶液,CaCl2溶液,均按文献[10]的要求配制。
1.1.3仪器凝皎成像系统、电泳仪、超净工作台、冷冻离心机、摇床、紫外分光光度计。
1.2
方法
1.2.1提取pRll01-ON质粒按照质粒提取试剂盒说明书操作。
1.2.2活化菌种 (1)从一80 qC冰箱中取出长期保存的大肠杆菌,用无菌牙签刮取固体(仔细操作不要让其融化),然后在LB平板上划线。
(2)取5mL新鲜LB液体培养基加入支无菌试管中。
(3)用接种环挑1个单菌落,浸没于培养液中并轻轻摇动接种环,使待接种的细菌分散于培养液中。
(4)盖好试管,在摇床上以60r/min、37℃条件下振荡培养至饱和(新鲜培养至饱和期的培养细菌浓度约为10亿~20亿个/mL),一般须过夜培养。
(5)取出(4)中0.2mL培养物到含有10mL新鲜lJH培养基试管中,在摇床上以220 r/min、37℃振荡培养,每隔20min取出2支试管,一支放入4℃冰箱统一测定D600nm值,另一支制备感受态细胞。(活化1次)
(6)将活化过1次的大肠杆菌取100uL加入5mL新鲜LH液体培养基在摇床上于60r/rain、37℃条件下振荡培养至饱和。
(7)取出(6)中O.2 mL培养物到含有10mL新鲜LB培养基试管中,在摇床上于220 r/min、37℃条件下振荡培养,每隔20MIN取出2支试管,一支放入4℃冰箱统一测定D600NM值,另一支制备感受态细胞。(活化2次)
(8)将活化过2次的大肠杆菌取100uL加入5mL新鲜LH液体培养基在摇床上于60r/rain、37℃条件下振荡培养至饱和。
(9)取出(8)中0.2mL培养物到含有10mL新鲜LB培养基试管中,在摇床上于220r/min、37℃条件下振荡培养,每隔20min取出2支试管,一支放入4 qC冰箱统一测定D600nm值,另一支制备感受态细胞。(活化3次)
(10)将活化过3次的大肠杆菌取100uL加入5mL新鲜LB液体培养基在摇床上于60r/min、37℃条件下振荡培养至饱和。
(11)取出(10)中0.2mL培养物到含有10mL新鲜LB培养基试管中,在摇床上于220r/min、37℃条件下振荡培养,每隔20min取出2支试管,一支放入4℃冰箱统一测定D600nm值,另一支制备感受态细胞。(活化4次)
1.2.3制备感受态细胞 CaCl2法制备感受态细胞。摇好的菌液试管冰浴30min,分装成2mL,在4℃、4000g条件下离心8min,弃上清,加800uL冰预冷的0.1mo]/L CaCl:重悬浮,分别使用O.22汕m的滤菌器和高温灭菌。再在4℃、4000g条件下离心8min,弃上清,加100uL冰预冷的0.1mol/L CaCl2重悬浮,4℃保存12~24h。
1.2.4质粒转化 把100uL的感受态细胞放置于冰上,加入转化的10ng DNA,于冰中放置30min。42℃热激90s,再在冰中放置2~3min,加入37℃条件下预热好900uL的LB培养基,37℃条件下振荡1h。取10uL菌液稀释涂布平板(平板预热),37℃条件下正向培养1h,再过夜培养。
1.2.5计算转化子总数=该皿菌落数×稀释倍数×(转化反应原液总体积/稀释倍数);
转化频率=转化子总数/质粒DNA加入量(ug)。2结果与分析
