二维斑点追踪技术在二尖瓣狭窄患者右心室收缩功能定量评价中的应用
2016-01-12商志娟,丛涛,孙颖慧等
二维斑点追踪技术在二尖瓣狭窄患者右心室收缩功能定量评价中的应用
商志娟,丛涛,孙颖慧,王珂,张树龙
(大连医科大学附属第一医院,辽宁大连116011)
摘要:目的探讨应用二维斑点追踪技术(STE)评价无右心衰症状的风湿性二尖瓣狭窄(MS)患者右心室收缩功能的价值。方法选择MS患者30例作为MS组,健康对照者20例作为对照组。应用常规超声心动图测量两组右心室中部横径(RVD)、肺动脉收缩压(PASP)、三尖瓣侧壁瓣环收缩期位移(TAPSE)、三尖瓣侧壁瓣环的收缩期速度(S′)。应用STE技术测量两组右心室游离壁、室间隔及右心室整体的长轴收缩期应变(S)及应变率(SR)。比较两组右心室参数及S、SR,分析S、SR与PASP的相关性。结果MS组PASP高于对照组(P<0.01),TAPSE、S′均低于对照组(P均<0.01)。MS组右心室整体S低于对照组(P<0.05),室间隔基底段、中段、心尖段S均低于对照组(P均<0.05)。MS组室间隔基底段和中段SR均低于对照组(P均<0.05)。右心室整体S与PASP呈负相关(r=-0.61,P<0.05)。右心室整体SR与PASP无相关性。结论 STE可以发现无右心衰症状MS患者的右心室整体及局部收缩功能受损,MS患者的右心室整体及局部的功能受损与PASP增高有关。
关键词:二维斑点追踪;二尖瓣狭窄;心室功能,右;超声心动图
doi:10.3969/j.issn.1002-266X.2015.42.028
中图分类号:R542.5;R445.1 文献标志码:B
收稿日期:(2015-06-11)
通信作者:张树龙
右心室收缩功能是影响单纯性风湿性二尖瓣狭窄(MS)患者临床症状、生活质量及预后的重要因素。由于右心室解剖结构复杂且形态不规则,传统超声心动图很难对其功能做出定量评价。近几年出现的二维斑点追踪技术(STE)可以定量评价局部和整体的心肌功能,所测量的收缩期峰值长轴心肌应变(S)及收缩期峰值长轴心肌应变率(SR)不依赖于多普勒信号,无角度依赖性,操作方便,对右心室收缩功能的评价具有较好的效果[1]。2013年7月~2014年7月,我们应用STE评价无右心衰症状的MS患者的右心室整体及局部心肌收缩功能,探讨STE对MS患者右心室功能的评估价值。
1资料与方法
1.1临床资料选择住院及门诊收治的单纯性MS患者30例作为MS组,男11例、女19例,年龄42~61(49.2±8.2)岁,均为窦性心律,心功能分级Ⅰ~Ⅱ级。排除标准:有右心衰的临床表现;合并冠心病、高血压、糖尿病;左心室射血分数<50%;除MS外存在中度及中度以上的瓣膜狭窄或反流;肺部疾病。选择健康对照者20例,均为健康体检者,男7例、女13例,年龄42~71(54.8±8.8)岁,均经临床及辅助检查排除心肺疾患。两组年龄、性别比例及心率差异无统计学意义。
1.2右心室功能评价方法两组均采用常规超声心动图检查及STE检查评价右心室功能。采用GE vivid7超声诊断仪,S4探头,探头频率2.5~4.0 MHz,数据分析为Echo PAC工作站。受检者左侧卧位,均接受常规超声心动图检查获得右心室参数,测量右心室中部横径(RVD),三尖瓣反流法估测肺动脉收缩压(PASP);M型超声测量三尖瓣侧壁瓣环收缩期位移(TAPSE);在TDI的条件下测量三尖瓣侧壁瓣环的收缩期速度(S′)。呼气末采集心尖四腔心二维动态图像,帧频>40 f/s,清晰显示右心室游离壁及室间隔,存储动态图像。导入Echo PAC工作站,手动确定心内膜边界,软件自动确定心外膜边界,调整感兴趣区,使每个节段都能被很好地追踪。分析时,用软件将右心室心肌自动分成右心室游离壁与室间隔两部分,每个部分再分成基底段、中间段、心尖段,共6个节段,并给出6个节段及右心室整体的曲线。

2结果
2.1两组右心室参数比较见表1。
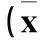
表1 两组右心室参数比较 ± s)
注:与对照组比较,*P<0.01。
2.2两组右心室整体及各节段S、SR比较详见表2、3。
2.3S、SR与PASP的相关性右心室整体S与PASP呈负相关(r=-0.61,P<0.05)。右心室整体SR与PASP无相关性。
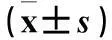
表2 两组右心室整体及各节段S比较
注:与对照组比较,*P<0.05。

表3 两组右心室整体及各节段SR比较 ± s)
注:与对照组比较,*P<0.05。
3讨论
右心室收缩功能是决定MS患者预后和生存率的主要因素。右心室结构复杂、形态不规则,对其收缩功能的评价有一定困难。临床通常以超声心动图测量右心室的射血分数来评价收缩功能,但这种方法具有主观性,而且费时。研究表明,右心室纵向的心肌收缩功能可以作为右心室收缩功能的有效评价指标[2]。组织多普勒及应变率显像技术是常用于定量评价右心室纵向收缩功能的检查方法[3,4],但二者具有明显的角度依赖性,对噪声敏感,而且对帧频的要求非常高,临床应用具有一定局限性。
STE是在二维图像的基础上逐帧追踪心肌内的斑点,通过比较不同斑点的运动,得出心肌纵向的S和SR,无角度依赖性,信噪比高,能准确、快速地提供整体及局部的心肌功能参数[5]。S与SR结合能够提供心肌收缩功能的不同信息。S反映的是心肌形变的大小,收缩期S受右心室负荷的影响。Kumar等[6]研究发现,MS患者右心室收缩功能受损是由于MS使左心房压力增高,形成肺动脉高压,使右心室后负荷增加,继而导致右心室功能受损,认为MS患者右心室收缩功能受损是后负荷增加所致。Nagel等[7]研究也发现,MS患者右心室收缩功能受损的主要原因是后负荷增加而不是心肌收缩功能降低所致。本研究发现,MS组右心室整体及室间隔各段的S低于对照组,右心室整体S与PASP呈负相关,提示右心室收缩功能可能是PASP增高、后负荷增加所致。既往也有研究[8,9]报告,肺动脉高压能导致右心室收缩功能降低。TAPSE、S′也是反映右心室整体收缩功能的指标[10]。本研究结果显示,MS组TAPSE和S′低于对照组,表明本研究的MS患者右心室整体收缩功能降低,与Tanboga等[11]的研究结果一致。
SR反映心肌形变的速度,收缩期SR与心肌收缩力密切相关,反映的是心肌本身的收缩特性,相对不受后负荷影响。风湿因子可直接侵入右心室心肌内,导致心肌细胞坏死、纤维化,使心肌收缩力降低,导致右心室功能受损。本研究发现,MS组室间隔基底段和中段SR低于对照组,提示无右心衰症状的MS患者存在右心室收缩功能的降低[12,13];右心室整体SR与PASP无相关性,提示MS患者右心室游离壁的心肌可能没有受到风湿的侵袭而损伤心肌收缩力,而室间隔的部分节段SR降低,考虑其原因为室间隔解剖位置与二尖瓣环相连,可能会直接受到风湿的侵袭从而损伤心肌收缩力。
综上所述,STE可以发现无右心衰症状MS患者的右心室整体及局部收缩功能受损,MS患者的右心室整体及局部功能的受损与PASP增高有关。
参考文献:
[1] Teske AJ, De Boeck BW, Olimulder M, et al. Echocardiographic assessment of regional right ventricular function: a head-to-head comparison between 2-dimensional and tissue doppler-derived strain analysis[J]. J Am Soc Echocardiogr, 2008,21(3):275-283.
[2] Deswarte G, Richardson M, Polge AS, et al. longitudinal right ventricular function as a predictor of functional capacity in patients with mitral stenosis: an exercise echocardiographic study[J]. J Am Soc Echocardiogr, 2010,23(6):667-672.
[3] Sevimli S, Gundogdu F, Aksakal E, et al. Right ventricular strain and strain rate properties in patients with right ventricular myocardial infarction[J]. Echocardiography, 2007,24(7):732-738.
[4] Meluzin J, Spinarova L, Bakala J, et al. Pulsed doppler tissue im-aging of tricuspid annular systolic motion: a new, rapid and non-invasive method for evaluating right ventricular systolic function[J]. Eur Heart J, 2001,22(4):340-348.
[5] Artis NJ, Oxborough DL, Williams G, et al. Two-dimensional strain imaging: a new echocardiographic advance with research and clinical applications[J]. Int J Cardiol, 2008,123(3):240-248.
[6] Kumar V, Jose VJ, Pati PK, et al. Assessment of right ventricular strain and strain rate in patients with severe mitral stenosis before and after balloon mitral valvuloplasty[J]. Indian Heart J, 2014, 66(2):176-182.
[7] Nagel E, Stuber M, Hess OM. Importance of the right ventricle in valvular heart disease[J]. Eur Heart J, 1996,17(6):829-836.
[8] Lopez-Candales A, Rajagopalan N, Dohi K, et al. Abnormal right ventricular myocardial strain generation in mild pulmonary hypertension[J]. Echocardiography, 2007,24(6):615-622.
[9] Pirat B, McCulloch M, Zoghbi WA. Evaluation of global and regional right ventricular systolic function in patients with pulmonary hypertension using a novel speckle tracking method[J]. Am J Cardiol, 2006,98(5):699-704.
[10] Fichet J, Moreau L, Genee O, et al. Feasibility of right ventricular longitudinal systolic function evaluation with transthoracic echocardiographic indices derived from tricuspid annular motion: a preliminary study in acute respiratory distress syndrome[J]. Echocardiography, 2012,29(5):513-521.
[11] Tanboga IH, Kurt M, Bilen E. Assessment of right ventricular mechanics in patients with mitral stenosis by two-dimensional deformation imaging echocardiography[J]. Echocardiography, 2012,29(8):956-961.
[12] Ozdemir K, Altunkeser BB, Gok H, et al. Analysis of the myocardial velocities in patients with mitral stenosis[J]. J Am Soc Echocardiogr, 2002,15(12):1472-1478.
[13] Yildirimturk O, Helvacioglu FF, Tayyareci Y, et al. Assessment of right ventricular endocardial dysfunction in mild-to-moderate mitral stenosis patients using velocity vector imaging[J]. Echocardiography, 2012,29(1):25-33.
