豫北地区嗜水气单胞菌灭活疫苗的制备及免疫效果的研究①
2016-01-08关建义毛会丽贺文旭杨利敏符运栋张敬梅吴佳静宁黔冀
关建义 毛会丽 贺文旭 杨利敏 符运栋 张敬梅 吴佳静 宁黔冀
(河南师范大学生命科学学院,新乡453007)
[摘 要] 目的:选取毒力因子多、毒性强的嗜水气单胞菌株(Aeromonas hydrophil)制成灭活疫苗,研究疫苗的免疫保护效果。方法:采用甲醛灭活制备疫苗,对银鲫进行腹腔注射,设立免疫组和对照组,然后进行血清抗体效价检测、病理切片分析和攻毒保护试验。结果:银鲫在经注射免疫后,各免疫时间均有抗体产生,抗体效价在第6周检测时达到高峰,而对照组在整个试验过程中均没有检测到抗体;病理切片也表明,该疫苗能够对鲫鱼靶器官产生很好的保护作用;攻毒保护试验中,免疫组的免疫保护率达100%,且免疫保护期长达6个月以上。结论:嗜水气单胞菌灭活疫苗对银鲫有显著的免疫保护效应,可作为预防细菌性败血症感染的疫苗。
[关键词] 嗜水气单胞菌(Aeromonas hydrophil);疫苗;抗体效价;病理切片;免疫保护率
doi:10.3969/j.issn.1000-484X.2015.11.013
豫北地区嗜水气单胞菌灭活疫苗的制备及免疫效果的研究①
关建义毛会丽②贺文旭②杨利敏②符运栋②张敬梅②吴佳静②宁黔冀
(河南师范大学生命科学学院,新乡453007)
[摘要]目的:选取毒力因子多、毒性强的嗜水气单胞菌株(Aeromonas hydrophil)制成灭活疫苗,研究疫苗的免疫保护效果。方法:采用甲醛灭活制备疫苗,对银鲫进行腹腔注射,设立免疫组和对照组,然后进行血清抗体效价检测、病理切片分析和攻毒保护试验。结果:银鲫在经注射免疫后,各免疫时间均有抗体产生,抗体效价在第6周检测时达到高峰,而对照组在整个试验过程中均没有检测到抗体;病理切片也表明,该疫苗能够对鲫鱼靶器官产生很好的保护作用;攻毒保护试验中,免疫组的免疫保护率达100%,且免疫保护期长达6个月以上。结论:嗜水气单胞菌灭活疫苗对银鲫有显著的免疫保护效应,可作为预防细菌性败血症感染的疫苗。
[关键词]嗜水气单胞菌(Aeromonas hydrophil);疫苗;抗体效价;病理切片;免疫保护率
doi:10.3969/j.issn.1000-484X.2015.11.013
中图分类号①本文为河南省基础与前言技术研究项目(142300410021)、河南省科技厅科技攻关(132102310165)、河南省教育厅科技攻关资助项目(2011A240001)和2013年国家大学生创新课题(201310472007)。;②新乡医学院生命科学技术学院,新乡453003。
作者简介:关建义(1969年-),男,副教授,主要从事鱼类病害研究,同时就职于新乡医学院生命科学技术学院,E-mail:jianyiguan@163.com。
通讯作者及指导教师:宁黔冀(1964年-),女,博士,教授,主要从事动物生长及细胞免疫学方面的研究,E-mail:ningqianji1964@163.com。
[Abstract]Objective:Selected virulence factors more than and high virulent Aeromonas hydrophia strain made into inactivated vaccine,to study the immunization effect of inactivated vaccine.Methods: Crucian were vaccinated with formalin-killed vaccine via intraperitoneal injection.Controls were injected with the same volumes of saline.Then the antibody titres,histopathology and relative percent survival were analyzed from samples of both groups.Results: The antibody in the indirect agglutination reaction could be detected in vaccinated fish once a weeks after immunization and reached highest level 6 weeks after immunization.The histopathology analysis indicated that the vaccine had a good protective effect on crucian target organs.Vaccinated fish showed 100% relative percent survival and the immune period would be 6 month.Conclusion: The vaccine in this study has a significant protective effect on crucian and may be used as effective fish vaccines against bacterial septicemia.
Preparation of a deactivation vaccine against Aeromonas hydrophila and research about its immue effect in the north of Henan
GUANJian-Yi,MAOHui-Li,HEWen-Xu,YANGLi-Min,FUYun-Dong,ZHANGJing-Mei,WUJia-Jing,NINGQian-Ji.CollegeofLifeSciences,HenanNormalUniversity,Xinxiang453007,China
[Key words]Aeromonas hydrophia;Vaccine;Antibody titers;Tissue slices;Immunization protection rate
嗜水气单胞菌(Aeromonas hydrophila) 广泛存在于淡水、土壤、污水、淤泥和粪便中,包括有致病性菌株和非致病性菌株两类[1],致病性菌株感染谱十分广泛,可引起鳖、虾、蟹、蛙、鸭、貂等[2,3]的爆发感染,是引起水产生物病害的重要病原体[4-7],人类感染此菌可引起软组织损伤和食物中毒[8],是一种典型人-兽-鱼共患病病原[9-11]。防治嗜水气单胞菌的方法主要包括抗生素防治和疫苗防治2种方法。抗生素的广泛使用和滥用,加上监管措施不严,导致嗜水气单胞菌产生了耐药性甚至多重耐药性[12]。目前,研究嗜水气单胞菌全菌灭活疫苗对控制嗜水气单胞菌感染鱼类具有重要意义,全菌灭活疫苗是指利用某种方式灭活烈性野生病原菌的感染性,但保留其免疫原性而制备的疫苗[13-15]。
本研究从新乡地区自然患细菌性败血症的病例中分离出强毒株,制成全菌灭活疫苗,检查其安全性后,以腹腔注射方式进行接种免疫,观察对银鲫的免疫保护情况,旨在为全菌灭活疫苗在本地区鱼病防治中的应用提供理论依据。
1材料与方法
1.1实验材料试验菌株:嗜水气单胞菌菌株,自新乡市患细菌性败血病的病鱼体内分离,本实验室分离、保存。
试验动物:健康银鲫购自新乡市郊某渔场,每条鱼质量约为(30±2)g,长度为12~15 cm。使用前先于实验室驯养1周,充气,控制水温28℃左右,定期清污换水、喂食。
实验仪器: 恒温震荡培养箱(设备编号ZHWY-2102);TG-16型微量高速离心机; 水族箱;冰冻切片机(德国产); NikonE400型显微镜。
1.2实验方法
1.2.1疫苗菌株的筛选实验室保存的菌株活化后,接种于营养肉汤28℃摇床培养16 h。培养物利用血小球计数板计数,每株菌的试验组分5组,每组10尾鱼,将菌液以10-1、10-2、10-3、10-4倍比稀释,每稀释度菌液腹腔注射银鲫,每尾注射0.2 ml,同时设生理盐水对照。实验鱼养于已消过毒的水族箱里,自来水已曝气24 h,充气,控制水温28℃左右,定期清污换水、投喂食物。每天记录每组鱼的死亡情况,参考Reed-Muench法计算半数致死浓度(LD50),选出LD50最低的菌株为疫苗菌株。
1.2.2全菌灭活疫苗的制备将疫苗菌株接种于营养肉汤28℃摇床培养16 h后,10 000 r/min离心20 min,收集菌体,加入磷酸缓冲液(PBS)至细菌浓度为1×108cfu/ml,然后加入终浓度为0.2%的甲醛溶液,28℃摇床培养24 h,制得嗜水气单胞菌的灭活疫苗。
1.2.3疫苗无菌检测与安全性试验取上述制备的疫苗涂布平板,28℃培养48 h,观察有无菌落出现。取上述制备的疫苗腹腔注射银鲫30尾,每尾注射0.2 ml,观察试验银鲫的反应和死亡情况。
1.2.4银鲫的免疫接种试验组和对照组各80尾银鲫,试验组腹腔注射全菌灭活溶液,每尾注射0.2 ml;对照组腹腔注射等量的生理盐水。每天充气,投喂食物,水温控制在28℃左右。
1.2.5血清抗体动态检测银鲫免疫后,每周从各组鱼中随机取5尾,注射器尾动脉/静脉取血,血液收集于离心管,使其4℃下自然沉降,分离血清,检测到免疫后第6个月。96孔板每孔加入生理盐水50 μl后,分别加入2倍比稀释免疫鱼血清和对照鱼血清,然后加入灭活的嗜水气单胞菌菌液作为抗原,培养板于28℃恒温箱1 h,再放入4℃冰箱过夜后判定结果。
1.2.6病理切片分析银鲫免疫21 d后,随机挑取试验组和对照组的鱼,以50LD50嗜水气单胞菌攻击,12 h后解剖取其肝脏、脾脏、肾脏以及肠道组织固定,包埋,经冰冻切片机切片,HE染色,二甲苯透明,中性树胶封存后,于光学显微镜下观察并对比试验组与对照组中鱼各组织器官的变化。
1.2.7攻毒保护试验在首次免疫21 d后,每组随机挑取30尾鱼,以50LD50嗜水气单胞菌攻击,同样采取腹腔注射的方式,同样环境下培养10 d,每天观察并记录各组死亡数,根据公式计算鱼的免疫保护率:免疫保护(%)=(对照组鱼种死亡率-实验组鱼种死亡率)/对照组鱼种死亡率×100%。
1.2.8免疫保护期的测定在首次免疫6个月后,每组随机挑取30尾鱼,仍以50LD50嗜水气单胞菌攻击,同样环境下培养10 d,每天观察并记录各组死亡数,根据公式计算鱼的免疫保护率。
2结果
2.1疫苗菌株的筛选试验试验菌株活化后,进行了半致死浓度LD50的测定。根据攻毒试验中,每组银鲫的死亡情况,并结合各菌株毒力因子的特点,筛选出了毒力因子多、毒性强的菌株作为疫苗制备备用菌株:XDMC(1),其LD50为1.5×105cfu/ml。
2.2疫苗无菌检测和安全性试验试验用灭活疫苗涂布平板培养48 h后,无菌落出现,证明疫苗灭活完全。动物安全实验中,疫苗注射银鲫后均无异常反应,证明疫苗是安全无毒性的。
2.3血清抗体检测每组鱼血清凝集抗体效价如图1所示。免疫后不同时间,免疫组银鲫平均抗体效价始终明显高于对照组,银鲫经注射免疫后,能产生较高的抗体效价,免疫组每周的抗体效价均显著高于对照组(P<0.05),在第6周时抗体效价达到高峰(1∶1 024),约为对照组的10倍左右,且能维持3周左右,在第24周时抗体效价仍能达到1∶256,约是对照组的8倍左右。

图1 血清抗体效阶Fig.1 Average serum antibody titerNote: Within the same time,different letters indicate significant difference (P<0.05).
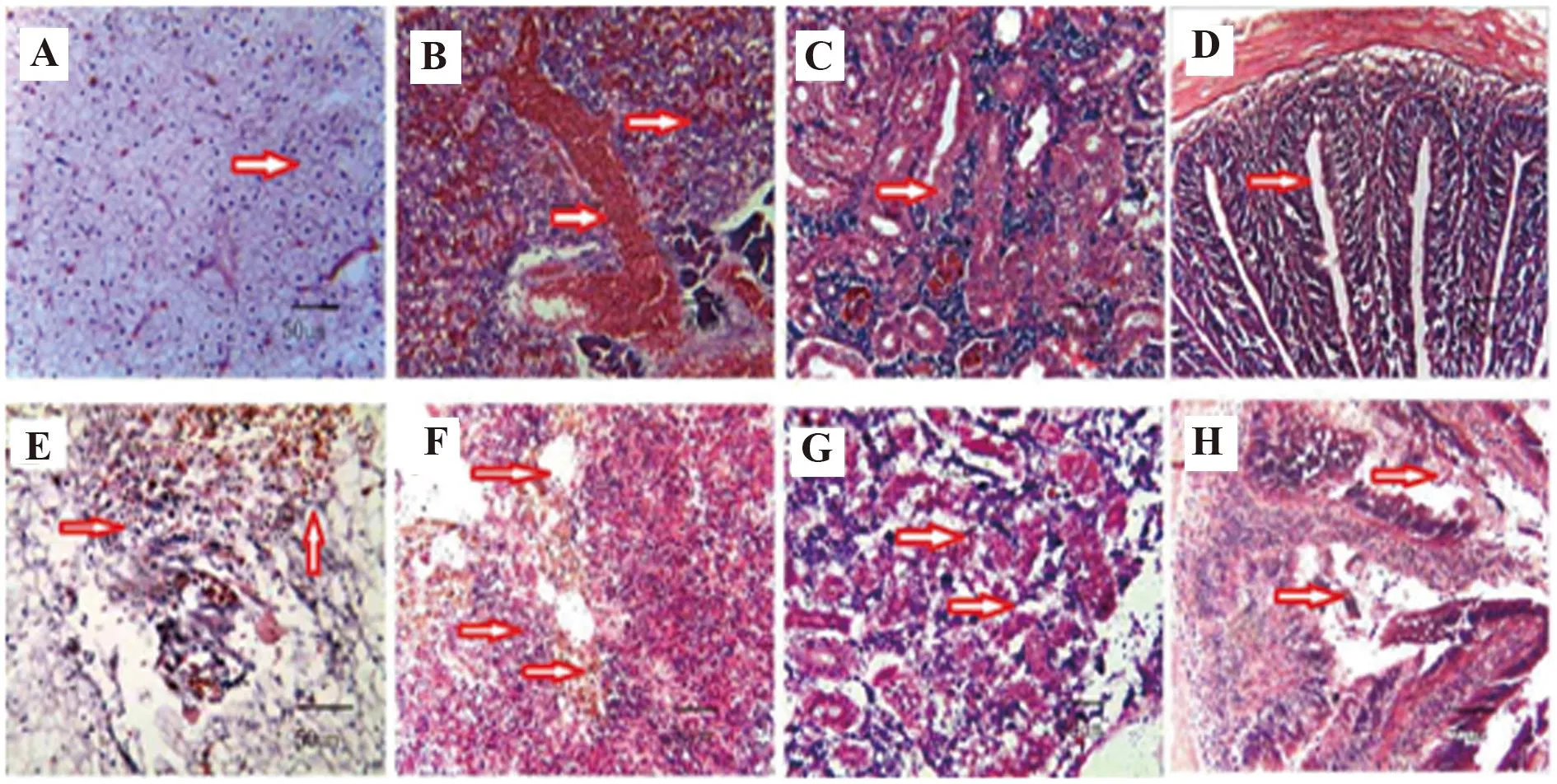
图2 鱼的肝脏、脾脏、肾脏和肠道的组织切片照片(×200)Fig.2 Photos of histopathologic slices with from fish liver,spleen,kidney and intestinal tissue(×200)Note: A,B,C and D were photos of histopathologic slices with HE staining from fish liver,spleen,kidney and intestine respectively in experimental group.E,F,G and H were photos of histopathologic slices with HE staining from fish liver,spleen,kidney and intestine respectively in control group.
2.4病理切片分析试验组与对照组病理切片见图2。图2A为免疫组鱼肝细胞可见肝细胞呈多角状,排列均匀有规则 (箭头所示);图2B为免疫组鱼脾脏可见脾实质红髓与白髓相间排列,无明显的分界,网状组织中充满着不同发育阶段的红细胞、粒细胞、淋巴细胞等(箭头所示);图2C为免疫组鱼肾脏,可见其形态大小正常,皮髓质界限清晰,肾窦无分离,肾小管正常(箭头所示);图2D为免疫组鱼肠道组织,上皮组织细胞、淋巴细胞、黏膜内层、黏膜下层细胞形态正常(箭头所示);图2E为对照组鱼的肝脏,肝细胞包浆疏松且出现明显气球样变性,后期出现大量的肝细胞坏死及淋巴细胞浸润,红细胞肿大、破裂、溶解,毛细血管、小血管破损,管壁扁平,内皮细胞肿胀,变性,严重溶血,可见棕黄色血源性色素沉积(箭头所示);图2F为对照组鱼的脾脏,可见脾脏红髓与白髓难以辨认,小体结构不清,组织细胞大量溶解、坏死、血源性色素沉积最为显著(箭头所示);图2G为对照组鱼的肾脏,可见肾小体坏死,肾小球囊腔变大,肾小管上皮细胞肿胀、变性、坏死、崩解(箭头所示);图2H为对照组鱼的肠道,可见肠绒毛坏死、脱落,肠绒毛上皮细胞坏死、脱落,杯状细胞大量增生(箭头所示)。说明疫苗对鲫鱼产生了保护作用,当嗜水气单胞菌侵入鱼体内时,鱼的免疫系统可识别并消灭病原菌,以免细菌对组织造成损伤。
2.5攻毒保护试验灭活疫苗对银鲫的攻毒保护试验(见表1)显示,该疫苗能对鲫鱼产生很好的保护作用,其免疫保护率达到了100%;未免疫的对照组银鲫全部死亡,从死鱼内脏中回收到攻毒株。
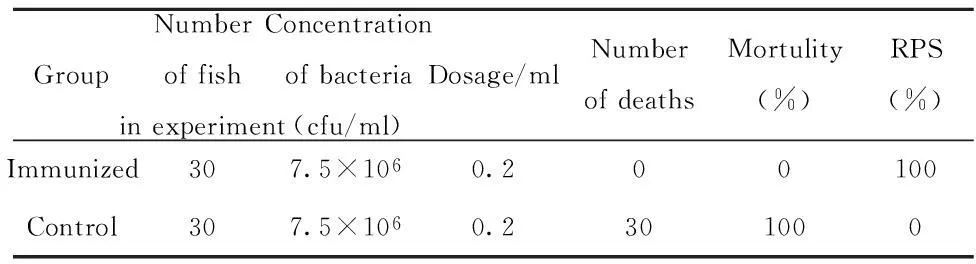
表1 免疫后3周的免疫保护力Tab.1 Relative percent survival 3 weeks after immunization
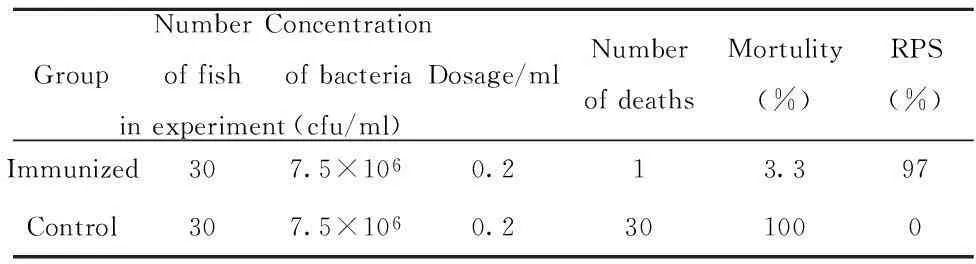
表2 免疫后6个月的免疫保护力Tab.2 Relative percent survival 6 months after immunization
2.6免疫保护期的测定6个月后的免疫保护结果显示(见表2),该疫苗免疫保护率仍高达97%,而未免疫的对照组银鲫全部死亡,从死鱼内脏中回收到攻毒株,说明该疫苗对银鲫的免疫保护期长达6个月以上。
3结论
本实验采用甲醛灭活的方法制备嗜水气单胞菌灭活疫苗,既灭活烈性野生病原菌的感染性,又保留其免疫原性[14],并用此疫苗来免疫银鲫,且采用的是毒力因子最多,毒性最强的菌株作为疫苗菌株,所以能对更多种强毒株产生免疫保护作用。血清抗体检测试验说明,鱼类虽然是较低等的脊椎动物,特异性免疫机制还很不完善,但在嗜水气单胞菌免疫反应中,产生了抗体,特异性免疫发挥了重要作用。从病理切片可以看出,嗜水气单胞菌可以侵入鱼的肝脏、脾脏、肾脏、肠道等组织,并造成严重的损伤,疫苗可以在细菌进入这些组织之前将其杀灭,很好的保护了鱼体的安全。从攻毒保护试验可以看出,该全菌灭活疫苗可以产生很好的保护力。但是,该疫苗也存在很大的局限性,由于嗜水气单胞菌血清型众多,不同地区、不同鱼种之间分离的菌株差异显著,导致至今嗜水气单胞菌灭活疫苗免疫效果不佳。本研究采用本地分离的嗜水气单胞菌制备灭活疫苗应用于本地养殖场所,取得了较好的保护效果。但所制备的灭活疫苗仍然面临着应用范围狭窄的问题。解决这一问题还需要进一步从基因方面入手,选择各菌株间变异系数较小的致病基因构建基因工程疫苗或核酸疫苗,扩大疫苗的应用范围。因此,开发新型疫苗以针对多种血清型菌株仍是今后防治嗜水气单胞菌引起疾病的重要方向。
参考文献:
[1]于学辉,王远微,汤承.嗜水气单胞菌研究进展[J].西南民族大学学报:自然科学版,2007,33(3):507-514.
[2]Lee HL,Lee SC,Kim JD,etal.Methane production potential of feed ingredients as measured by in vitro gas test. [J].Asian Austral J Anim Sci,2003,16(8):1143-1150.
[3]Puchala R, min BR,Goetsch AL,etal.The effect of a condensed tannin-containing forage on methane emission by goats [J].J Anim Sci,2005,83(1):182-186.
[4]Elwitigala JP,Higgs DS,Namnyak S,etal.Septic arthritis due to Aeromonas hydrophila:case report and review of the literature [J].Int J Clin Pract,2005,59(Supp):121-124.
[5]朱大玲,李爱华,汪建国,等.嗜水气单胞菌毒力与毒力基因分布的相关性[J].中山大学学报:自然科学版,2006,45(1):80-84.
[6]Vivas J,Carracedo B,Riano J,etal.Behavior of an Aero-m0nns hydrophila aroA live vaccine in water microcosms [J].Appl Environ Microbiol,2004,70:2702-2708.
[7]Li AH,Yang WM,Hu J,etal.Optimization by orthogonal array design and humoral immunity of the bivalent vaccine against Aeromonas hydrophila and Vibrio fluvialis infection in crueian carp(Carassius auratus L) [J].Aqua Res,2006,37:813-820.
[8]Kurihara M,Nishida A,Purnomoadi.The prediction of methane conversion rate from dietary factors[M].Japan Hokkaido,2001:301-304.
[9]潘厚军,吴淑勤,董传甫,等.鳜致病性嗜水气单胞菌GYK1株的鉴定、毒力及溶血性[J].上海水产大学学报,2004,13 (1):24-29.
[10]游忠岚,陈嵩,王宇明.慢性重型肝炎并发嗜水气单胞菌败血症1例[J].第三军医大学学报,2008,30(3):206.
[11]Rathinasamy S,Thangavelu T,Govinadhasamy V,etal.Occurrence of Aeromonas hydrophila in acute gastroenteritis among children [J].Indian J Med Res,2006,123:61-66.
[12]Pridgeon JW,Klesius PH.Development and eficacy of novobiocin and rifampicin-resistant Aeromonas hydrophila as novel vaccines in channel catfish and Nile tilapia [J].Vaccine,2011,29(45):7896-7904.
[13]Verma R,Khanna P,Chawla S.Whole-cell inactivated Leptospirosis vaccine:future prospects [J].Hum Vaccin lmmunother,2013,9(4):763-765.
[14]ming JH,Xie J,Xu P,etal.Molecular cloning and expression of two HSP70 genes in the Wuchang bream (Megalobrama amblycephala Yih )[J].Fish Shellfish Immun,2010,28(3):407-418.
[15]Anderson DP.Adiuvants and immunostimulants for enhancing vaccine potency in fish [J].Dev Biol Stand,1997,90:257-265.
[收稿2015-04-25修回2015-05-20]
(编辑倪鹏)
