应用SNaPshot 单碱基延伸反应方法检测多个目的基因多态性与非酒精性脂肪性肝病易感性的关系
2015-12-31李裕碧周永健李瑜元聂玉强杜艳蕾
李裕碧,周永健,李瑜元,聂玉强,杜艳蕾
广州医科大学附属广州市第一人民医院消化内科,广东 广州510180
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种很常见的导致肝脏脂肪变性的疾病,广东省的发病率达到14%左右[1-2]。NAFLD 的发病机制尚未完全清晰。国外有较多的研究表明单核甘酸多态性(single nucleotide polymorphism,SNP)与NAFLD 关系密切[3],国内的研究多以单个位点较多,并且鲜有涉及基因型与NAFLD 严重程度相关研究。胰岛素抵抗及代谢综合征与NAFLD 密切相关,因此本研究选取NAFLD 发病通路中影响胰岛素抵抗和代谢综合征的9 个基因位点。用SNaPshot 单碱基延伸反应同时测定9 个位点基因型,初步探讨其在广东汉族人群中与NAFLD 严重程度的关系。
1 资料与方法
1.1 一般资料 选取2010 年广州市社区流调人群共194 人,确诊NAFLD 102 例(男/女= 24/78),为NAFLD 组,健康人群92 名(男/女=28/64),为对照组。NAFLD 诊断标准采用中华医学会肝脏病学分会脂肪肝和酒精性肝病学组2010 年修订的非酒精性脂肪性肝病诊疗指南[4]。所有病例无饮酒史,排除病毒性肝炎、药物性肝病、Wilson 病等可导致脂肪肝的特定疾病。B 超诊断NAFLD 参考2008 NAFLD 的诊断和治疗指南标准[5]。选取的9 个位点均在dbSNP 数据库中国汉族人群中的最小等位基因频率(MAF)>0.1。
1.2 方法
1.2.1 标本的采集和保存:采集清晨空腹静脉血4 ml,其中2 ml 交由检验科检测血糖、胰岛素、肝三酶、血脂四项。其余2 ml 保存于-80 ℃超低温冰箱中,统一时间提取DNA 后待下一步分析。
1.2.2 SNP 分型:采用SNaPshot 分型技术平台测定基因型。具体步骤如下:(1)测定DNA 浓度(采用美国NanoDrop 公司ND-1000 分光光度计):根据测定的浓度将样本稀释到工作浓度5 ~10 ng/μl。(2)PCR扩增:采用touchdown 反应模式,引物用在线Primer3软件设计,上海生工公司(广州)合成。a:PCR 引物见表1;b:扩增PCR 反应体系(10 μl)包含1 × GC-I buffer (Takara.),3. 0 mmol/L Mg2+,0. 3 mmol/L dNTP,1 U HotStarTaq polymerase (Qiagen Inc.),1 μl 样本DNA 和1 μl 多重PCR 引物。其中每条引物的终浓度为1 μmol/L;c:扩增参数,第一步95 ℃,2 min。第二步11 ×(94 ℃20 s,65 ℃40 s,每个循环降低0.5 ℃,72 ℃1.5 min)。第三步24 ×(94 ℃20 s,59 ℃30 s,72 ℃1.5 min)。第四步72 ℃2 min 4 ℃结束。(3)产物纯化:在10 μl PCR 产物中加入1 U SAP 酶和1 U Exonuclease I 酶,37 ℃温浴1 h,然后75 ℃灭活15 min。(4)SNaPshot 单碱基延伸反应:a:延伸引物见表1;b:延伸反应体系(10 μl)包括5 μl SNaPshot Multiplex Kit(ABI),2 μl 纯化后多重PCR 产物,1 μl 延伸引物混合物(各引物的终浓度为 0. 8 μmol/L,其中rs10865710SR 为0.4 μmol/L),2 μl 超纯水;c:延伸热循环程序:96 ℃1 min;28 × (96 ℃10 s,52 ℃5 s,60 ℃30 s);4 ℃结束。(5)延伸产物纯化,在10 μl延伸产物中加入1 U SAP 酶,37 ℃温浴1 h,然后75 ℃灭活15 min。(6)延伸产物上ABI 3500 测序仪:取0.5 μl纯化后的延伸产物,与0. 5 μl Liz120 SIZE STANDARD,9 μl Hi-Di 混匀,95 ℃变性5 min 后,立即置于冰上,2 min 后上ABI 3500 测序仪(ABI,USA)分析。(7)数据记录及分析:在ABI 3500 测序仪上用3500 Series Software 2 软件(ABI,USA)记录原始数据,用GeneMapper 5.0 软件(ABI,USA)分析。由于在最后一步PCR 反应中加有4 种不同颜色荧光标记的dNTP,分别代表A/G/C/T 碱基,反应产物只在引物延生一个碱基,延伸的碱基就是该样本在该位点上的基因型,当在ABI 3500 测序仪上检测时,可以检测是哪种颜色荧光,从而判断碱基的类型。用GeneMapper 5.0软件可以得到样本的基因型。

表1 PCR 引物和延伸引物Tab 1 PCR primers and extension primers
1.3 统计学处理 所有组别进行Hardy-Weinberg 遗传平衡检验确定样本群体的代表性。连续型变量采用±s 表示,计数资料直接给出具体数值。基因频率采用直接计数法。两组定量资料满足正态分布及方差齐性用两样本独立t 检验,满足正态分布但方差不齐用校正t 检验,即t'检验,不满足正态分布采用非参数检验中的秩和检验。两样本以上的定量资料比较用方差分析,两两比较用Bonferroni 检验。以上统计均采用SPSS 16.0 进行分析。P <0.05 为差异有统计学意义。
2 结果
2.1 碱基类型的判别 根据碱基颜色判断碱基类型,其中纯合子表现为单峰,杂合子表现为双峰(见图1)。

图1 SNaPshot 单碱基延伸反应方法检测结果Fig 1 Results of the genotypes by SNaPshot single nucleotide extension reaction method
2.2 NAFLD 组和对照组一般临床资料及生化指标的比较 结果显示两组的性别及年龄差异无统计学意义(P 均>0.05)。NAFLD 组体质量指数(BMI)明显较对照组大(P <0.001),腰臀比(WHR)两组比较,差异有统计学意义(P <0.001)。胰岛素抵抗(HOMA-IR)指数NAFLD 组大于对照组(P <0.001)。肝脏酶学指标(ALT、AST、γ-GT),NAFLD 组均较正常组升高(P均<0.001)。脂质四项中除HDLC 在NAFLD 组是降低,其余三项(TC、TG、LDLC)均升高(P 均<0.05,见表2)。
2.3 NAFLD 患者轻度、中度及重度组一般临床资料及生化指标的比较 NAFLD 组按照B 超检查结果分成轻度(58 例)、中度(32 例)和重度(12 例)。三组年龄及γ-GT 比较,差异无统计学意义(P =0.071、0.32)。NAFLD 程度越高,其BMI 指数及LDLC 含量也增高(P 均<0.05)。腰臀比在中重度要明显大于轻度(P <0.001)。HOMA-IR 指数轻中度要小于重度(P <0.001)。随着NAFLD 程度增加,转氨酶ALT 及AST 均升高(P 均<0.005),γ-GT 虽有升高,但差异无统计学意义(P =0.32)。TG 含量在重度明显较轻中度均高(P <0.001),而HDLC 则是降低趋势(P <0.001),TC 则显示差异无统计学意义(P >0.05,见表3)。

表2 NAFLD 组和对照组临床资料和生化指标的比较Tab 2 Comparison of clinical and biochemical indicators between NAFLD and control groups
表3 NAFLD 组轻度、中度及重度在一般临床资料和生化指标的比较(±s)Tab 3 Comparison of clinical and biochemical indicators among mild,moderate and severe groups of NAFLD (±s)

表3 NAFLD 组轻度、中度及重度在一般临床资料和生化指标的比较(±s)Tab 3 Comparison of clinical and biochemical indicators among mild,moderate and severe groups of NAFLD (±s)
注:数值后面的字母相同表示两两比较P >0.0017(0.05/3),字母不相同表示两两比较,P <0.0017。
轻度 中度 重度 P值57.57 ±11.16 57.53 ±12.58 56.83 ±15.38 0.071 BMI(kg/m2) 25.61 ±5.30a 27.36 ±2.23b 27.87 ±3.54c 0.000 WHR 0.90 ±0.05a 0.92 ±0.06b 0.93 ±0.06b 0.000 HOMA-IR 8.03 ±3.39a 6.46 ±3.14a 3.15 ±7.39b 0.010 AST(U/L) 27.87 ±13.24a 29.40 ±11.91a 33.50 ±18.93b 0.001 ALT(U/L) 29.74 ±17.66a 30.95 ±30.71a 41.33 ±13.85b 0.002 γ-GT(U/L) 32.77 ±21.63 34.65 ±16.46 36.78 ±21.34 0.320 TG(mmol/L) 2.65 ±2.16a 3.09 ±3.14a 3.14 ±1.67b 0.000 TC(mmol/L) 5.00 ±0.75 5.16 ±1.07 5.30 ±1.26 0.060 HDLC(mmol/L) 1.48 ±0.49a 1.32 ±0.46a 1.24 ±0.49b 0.000 LDLC(mmol/L) 2.03 ±0.90a 2.24 ±0.92b 2.92 ±1.24c年龄(岁)0.030
2.4 NAFLD 组和对照组的基因型频数统计 除TNFα 基因rs361525 位点外,其他基因位点在两组基因频数分布差异均有统计学意义(P 均<0. 05)。PPARγ 基因rs10865710 位点C 等位基因、ADIPOQ 基因rs1501299 位点T 等位基因、FDFT1 基因rs2645424位点G 等位基因、AGTR1 基因rs3772622 位点G 等位基因、MTTP 基因rs3816873 位点T 等位基因、PNPLA3基因rs738409 位点C 等位基因、ADIPOR2 基因rs767870 位点A 等位基因、PEMT 基因rs7946 位点C等位基因在NAFLD 组中频数高于对照组(P 均<0.05,见表4)。
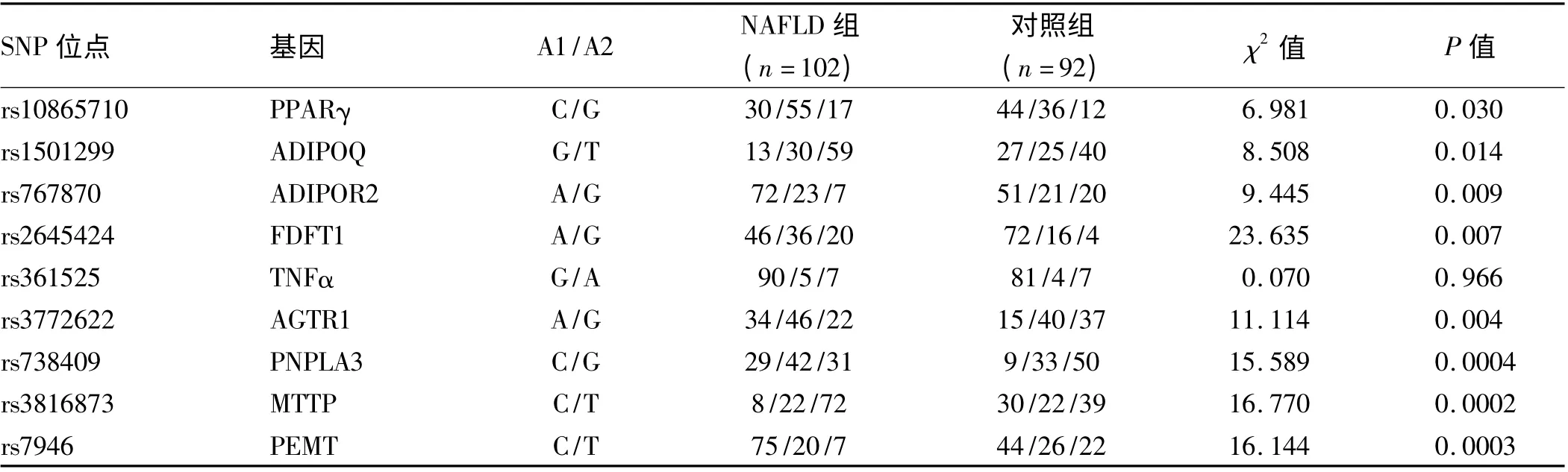
表4 NAFLD 组和对照组基因型频数的比较Tab 4 Comparison of genotype frequency between NAFLD group and control group
2.5 NAFLD 患者轻度、中度和重度组的基因型频率的比较 进一步按照轻、中、重度分组。PNPLA3 基因rs738409 位点C 等位基因在轻、中、重度的频数分别为0.39、0.59 和0.83(P=0.002),其余位点则差异无统计学意义(P >0.05,见表5)。
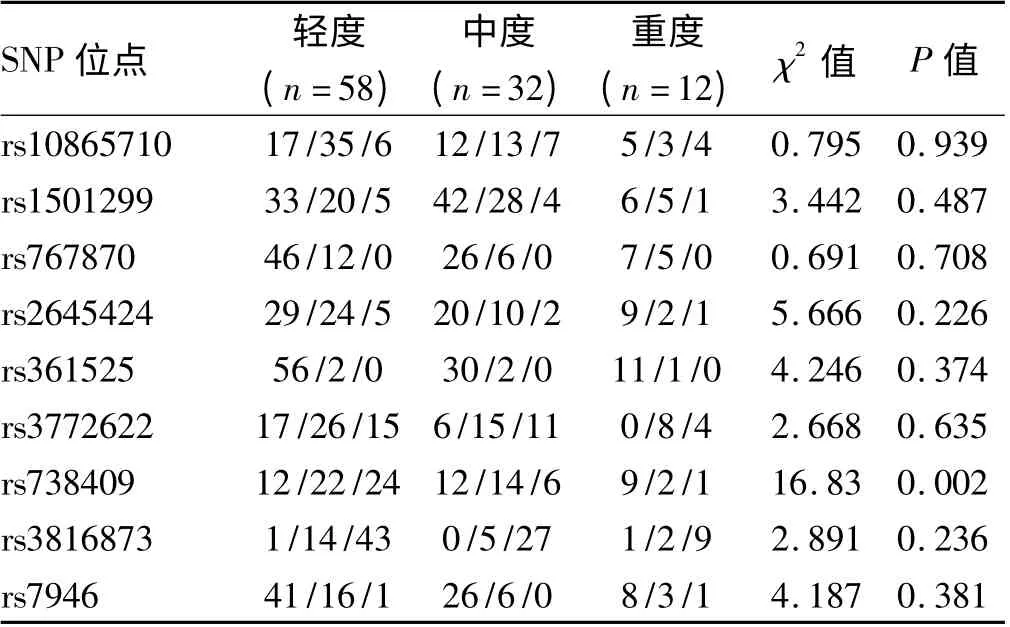
表5 NAFLD 患者轻度、中度和重度组各基因型频率的比较Tab 5 Comparison of genotype frequency among mild,moderate and severe groups of NAFLD
3 讨论
NAFLD 包含一系列的肝脏疾病谱,从单纯性脂肪肝(肝细胞甘油三酯的含量累积超过5%)到脂肪性肝炎(肝细胞炎症和气球样变性)、肝纤维化,最终肝硬化[3]。目前认为遗传因素在NAFLD 的发病中有重要作用,其中与基因多态性关系密切[6]。SNP 是遗传因素中的重要组成部分,其序列上的变异,与人体对疾病的易感性及抵抗力有关,甚至可以影响临床表现及治疗的反应[3,7]。理论上,NAFLD 发病过程相关基因非常多,目前不可能同时将所有的基因及其位点同时进行候选基因SNP 研究。因此,本研究选择了9 个与NAFLD 的发病密切相关基因位点。
检测这些基因多态性的方法有许多种,比如测序分析方法,但是其成本高,通量低,检测周期较长;及核酸电泳法,其对样本要求高;还有TaqMan 探针法,其对探针设计较复杂,设计周期长。我们利用SNaPshot分型技术平台测定以上基因型,该方法有以下优点,首先引物和探针合成周期短,1 周之内可以合成完毕。其次可以做多重的SNP 检测,降低了成本。最后样本数量要求不高,100 ~1 000 的样本量都很适合并且位点成功率和准确率均>95%。
上述基因位点对NAFLD 影响的侧重点不同,可大致分为三类。
PPARγ、ADIPO、ADIPOR2 与胰岛素敏感性相关:一项针对中国汉族人群的研究结果[8]表明PPARγ 基因rs10865710 位点多态性的劣势基因与肥胖关系密切。本研究则显示G 等位基因频率在NAFLD 人群中(39.2%)较正常人群高(37.5%,P =0.03),提示G等位基因可能增加NAFLD 易感性。与前人研究结果类似。日本的一项研究[9]表明ADIPO 基因rs1501299位点GG 型的个体发生胰岛素抵抗明显高于其他基因型的个体。而在本研究中则相反,携带T 型等位基因的个体发生NAFLD 的比例高于G 等位基因。推测其结果不同可能与研究种族有关。有报道ADIPOR2 基因rs767870 位点在调整年龄、性别及BMI 后,其次要等位基因即G 等位基因与肝脏脂肪含量减少有关[10]。本研究结果与前人研究基本相同,显示G 等位基因在NAFLD 中的频率较低。
FTFD1、TNFα、AGTR1、PNPLA3 参与氧化活性代谢和细胞因子通路:国外一项全基因组扫描研究(GWAS)[11]表明FTFD1 基因rs2645424 位点与病理活检确诊的NAFLD 活动评分有关,本研究则进一步证实其G 等位基因与NAFLD 易感性增加有关。较早的的一项研究[12]指出,TNFα 基因rs361525 位点G 等位基因通过增加血清中TNFα 含量参与胰岛素抵抗及脂质代谢,从而与NAFLD 发生有一定关系,但在本实验中则未能发现有相关性。一项多民族的基因易感性分析指出rs3772622 位点,G 等位基因与NAFLD 纤维化的发生有关[13],本研究同样支持NAFLD 患者组中G等位基因占主导。国内的研究指出携带G 等位基因的个体患NAFLD 的易感性更高[14]。本研究结果显示G 等位基因个体患NAFLD 易感性高于C 等位基因,结果与国内外研究结果一致,并且在NAFLD 重度患者中G 等位基因的频数也较高,这可以解释GG 型更易患NASH 及纤维化。
PEMT、MTTP 与肝脏脂肪代谢相关:rs7946 等位基因多态性可能会导致血清PEMT 含量下降,并增加NAFLD 易感性[15]。本研究进一步证实C 型等位基因,其NAFLD 易感性增加。既往研究显示MTTP 基因rs3816873(I128T)多态性位点错义突变,即编码区128位点异亮氨酸Ile 变为苏氨酸Thr,导致MTTP 的结构发生变化,热稳定性下降,容易被水解以及与载脂蛋白B 的结合降低,影响脂质的转运功能[16]。在本研究中MTTP 基因位点(rs3816873)G 等位基因在NFALD 组中的频率高于其他基因型,与前人研究一致。
既然在NAFLD 组和对照组中其优势等位基因不同,那么在不同程度的NAFLD 患者中是否仍有此现象呢?当我们把NAFLD 患者按照B 超结果分成轻、中及重度组,并且将各个位点基因型频率结合起来分析,结果发现只有PNPLA3 基因rs738409 位点在三组的分布有差异,并且G 等位基因在重度的NAFLD 中频率较高,提示携带此位点个体NASH 或纤维化的易感性高于C 等位基因。
本研究存在一定局限性,首先,病理组织学诊断为NAFLD 诊断金标准,本文采用B 超代替,不如前者有说服力;其次,基因位点的选择比较分散,位点数量较少;最后,样本量偏少可能会对实验数据有影响,需要更大样本含量及多中心的研究来验证。
综上所述,本研究结果显示除TNFα 位点外,其余位点均在NAFLD 组中发现有优势等位基因。提示携带上述等位基因的个体其NAFLD 的易感性也增高。PNPLA3 基因rs738409 位点与G 等位基因增加NAFLD 易感性,并且其与NAFLD 严重程度相关。
[1] Zhou YJ,Li YY,Nie YQ,et al. Prevalence of fatty liver disease and its risk factors in the population of South China[J]. World J Gastroenterol,2007,13(47):6419-24.
[2] Lu Y,Yao JY,Zhi M,et al. Epidemiological investigations of adult prevalence of fatty liver and related factors in Liwan district of Guangzhou [J]. The Journal of Practical Medicine,2011,27 (19):3589-3591.鲁义,姚嘉茵,郅敏,等. 广州市荔湾区成人脂肪肝患病率及其相关因素的流行病学调查[J]. 实用医学杂志,2011,27(19):3589-3591.
[3] Anstee QM,Day CP. The genetics of NAFLD[J]. Nat Rev Gastroenterol Hepatol,2013,10(11):645-55.
[4] The Chinese National Work-shop on Fatty Liver and Alcoholic Liver Disease for the Chinese Liver Disease Association. Nonalcoholic fatty liver disease diagnosis and treatment guidelines (2010 Revision)[J].Chin J Gastroenterol Hepatol,2010,19(6):483-487.中华医学会肝病学分会脂肪肝和酒精性肝病学组. 非酒精性脂肪性肝病诊疗指南(2010 年修订版)[J]. 胃肠病学和肝病学杂志,2010,19(6):483-487.
[5] Zeng MD,Fan JG,Lu LG,et al. Guidelines for the diagnosis and treatment of nonalcoholic fatty liver diseases[J]. J Dig Dis,2008,9(2):108-112.
[6] Schwimmer JB,Celedon MA,Lavine JE,et al. Heritability of nonalcoholic fatty liver disease [J]. Gastroenterology,2009,136(5):1585-1592.
[7] He S,Mcphaul C,Li JZ,et al. A sequence variation (I148M)in PNPLA3 associated with nonalcoholic fatty liver disease disrupts triglyceride hydrolysis[J]. J Biol Chem,2010,285(9):6706-6715.
[8] Luo W,Guo Z,Wu M,et al. Association of peroxisome proliferatoractivated receptor alpha/delta/gamma with obesity,and gene-gene interaction,in the Chinese Han population[J]. J epidemiol,2013,23(3):187-194.
[9] Tokushige K,Hashimoto E,Noto H,et al. Influence of adiponectin gene polymorphisms in Japanese patients with non-alcoholic fatty liver disease[J]. J Gastroenterol,2009,44(9):976-982.
[10] Kotronena A,Yki-Jarvinen H,Aminoff A,et al. Genetic variation in the ADIPOR2 gene is associated with liver fat content and its surrogate markers in three independent cohorts[J]. Eur J Endocrinol,2009,160(4):593-602.
[11] Chalasani N,Guo X,Loomba R,et al. Genome-wide association study identifies variants associated with histologic features of nonalcoholic Fatty liver disease [J]. Gastroenterology,2010,139(5):1567-76,76 e1-6.
[12] Huang J,Li YY,Zhou YJ. Association between tumor necrosis factor-alpha gene polymorphism and insulin resistance in nonalcoholic fatty liver disease[J]. Chin J Hepatol,2006,14(8):613-615.黄健,李瑜元,周永健. 肿瘤坏死因子α 基因多态性与非酒精性脂肪性肝病胰岛素抵抗的相关性[J]. 中华肝脏病杂志,2006,14(8):613-615.
[13] Zain S,Mohamed Z,Mahadeva S,et al. Susceptibility and gene interaction study of the angiotensin Ⅱtype 1 receptor (AGTR1)gene polymorphisms with non-alcoholic fatty liver disease in a multi-ethnic population[J]. PLoS one,2013,8(3):e58538.
[14] Peng XE,Wu YL,Lin SW,et al. Genetic variants in PNPLA3 and risk of non-alcoholic fatty liver disease in a Han Chinese population[J].PloS one,2012,7(11):e50256.
[15] Song J,Da Costa KA,Fischer LM,et al. Polymorphism of the PEMT gene and susceptibility to nonalcoholic fatty liver disease(NAFLD)[J].FASEB J,2005,19(10):1266-1271.
[16] Ledmyr H,Ottosson L,Sunnerhagen M,et al. The lle128Thr polymorphism influences stability and ligand binding properties of the microsomal triglyceride transfer protein [J]. J Lipid Res,2006,47(7):1378-1385.
