香烟提取物对大鼠血管内皮细胞的损害
2015-12-31朱涛,李锋,严飞等
香烟提取物对大鼠血管内皮细胞的损害
朱涛李锋1严飞刘正霍强
(新疆医科大学第一附属医院心脏外一科,新疆乌鲁木齐830011)
摘要〔〕目的探究香烟提取物(CSE)对大鼠血管内皮细胞(VEC)的影响。方法利用原代培养的方法获得大鼠主动脉VEC(RVEC),采用不同浓度的CSE处理RVEC,分别用MTT和流式细胞仪来检测三组细胞的增殖和凋亡情况,并检测细胞乳酸脱氢酶(LDH)释放情况。同时,采用双抗体夹心ELISA法检测细胞分泌的肿瘤坏死因子(TNF)-α、基质金属蛋白酶(MMP)-1、MMP-2、MMP-3和MMP-10的情况。结果MTT实验中,与0.05%组相比,0.5%浓度组的细胞生长显著变慢(P<0.05),且这种抑制作用呈现剂量依赖性。LDH释放结果显示,与0.05%组相比,20%浓度的CSE处理可导致细胞LDH释放显著升高(P<0.01),且随着CSE浓度的进一步升高,LDH释放逐渐增多。经过24 h后,CSE处理后的细胞凋亡逐渐增多,差异明显(P<0.01)。而对于细胞分泌的TNF-α、MMP-1、MMP-2、MMP-3和MMP-10含量,CSE干预组均比对照组明显增加(P<0.01)。结论CSE可以明显抑制RVEC的生长,加剧其凋亡,并促进细胞分泌TNF-α、MMP-1、MMP-2、MMP-3和MMP-10的能力。
关键词〔〕香烟提取物;血管内皮细胞;细胞增殖;细胞凋亡;肿瘤坏死因子α
中图分类号〔〕R73〔文献标识码〕A〔
通讯作者:霍强(1967-),男,硕士生导师,副教授,主任医师,主要从事心胸外科学研究。
1伊犁州友谊医院心血管介入科
第一作者:朱涛(1979-),男,硕士,主治医师,主要从事心胸外科学研究。
血管壁异常主要指血管内皮细胞(VEC)损伤,是造成急性冠脉事件的重要原因,也是糖尿病肾病等疾病发生的共同病理环节。香烟及其烟雾中含有上千种化合物和有毒物质,都具有刺激性和潜在致癌性。吸烟是诸多血管缺血性疾病如动脉硬化闭塞、血栓闭塞性脉管炎等疾病的重要危险因素〔1~6〕,本研究通过检测香烟提取物(CSE)对原代培养的大鼠主动脉VEC(RVEC)内皮细胞的损伤,探讨此类疾病的发生机制。
1材料与方法
1.1材料DMEM培养基、胎牛血清、胰蛋白酶、青、链霉素和磷酸盐缓冲液(PBS)均购自HyClone公司;二甲基亚砜(DMSO)、四甲基偶氮唑盐(MTT)、溴化丙啶(PI)购于Sigma公司;Rnase购于上海生工; ELISA试剂盒购自上海恒远生物技术发展有限公司。
1.2方法
1.2.1大鼠RVEC悬液的制备无菌操作取出大鼠主动脉,立即在无菌D-Hank液洗净血管外壁血液及分离脂肪组织等,并用注射器将血管内血液冲洗干净,剪成大约2 mm×2 mm的动脉片,然后贴入灭菌25 mm培养瓶中,置于37℃,5% CO2培养箱内进行原代培养。
1.2.2CSE的制备使用国产某品牌香烟,参照Nakamura等〔7〕:将烟嘴与泵相连,通过泵的抽气作用,使去掉过滤嘴的香烟燃烧,按每包烟通入1 000 ml Hank液制成悬液。悬液调至pH 7.4,经孔径0.2 μm微孔滤膜过滤除去细菌和大颗粒备用。
1.2.3MTT检测将制备的大鼠RVEC以每孔5 000个细胞接种于96孔培养板培养,将培养板移入CO2孵箱中,在37℃、5% CO2及饱和湿度条件下常规培养。细胞贴壁后通过换液分成对照组和不同浓度的CSE干预组,将各组细胞培养3 d后,每孔加入MTT溶液(5 g/L)20 μl,继续培养4 h,终止培养,小心吸弃孔内培养上清液,每孔加入DMSO 150 μl,轻轻振荡10 min,使结晶充分溶解,用酶联免疫标记分析仪在490 nm波长处测定各孔的吸光度A值(A 490)。细胞增殖抑制率(%)=(对照孔OD值-试验孔OD 值/对照孔OD值)×100%
1.2.4细胞凋亡检测将大鼠RVEC分为对照组,5%、10%和15%CSE干预组,继续培养24 h后,倒去培养基,胰酶消化细胞,离心去上清,PBS洗涤2次。加0.3 ml PBS重悬细胞,加入4 ml 70%乙醇(预冷),4℃过夜固定,离心收集细胞,PBS洗涤2次,0.5 ml PBS重悬细胞,加入50 μg/ml RNase,37℃消化30 min,再加入50 μg/ml的PI,37℃避光染色30 min,流式细胞仪检测细胞凋亡情况。
1.2.5细胞中细胞因子含量的检测将大鼠RVEC分为对照组,5%、10%和15%CSE干预组,培养至单层贴壁融合后,将培养基更换为无血清培养基,37℃、5% CO2孵箱中过夜培养,收集上清,按照ELISA试剂盒说明书进行实验,每组设3个复孔,用酶标仪在450 nm处读取OD值。
1.3统计学方法应用SPSS13.0软件行t检验。
2结果
2.1CSE对RVEC细胞增殖的影响MTT结果显示,当RVEC经过不同浓度CSE处理后,与0.05%组相比,0.5%浓度组的细胞生长显著变慢(P<0.05),说明CSE可以抑制大鼠RVEC的增殖,并且这种抑制作用呈现剂量依赖性。乳酸脱氢酸(LDH)释放结果显示,与0.05%组相比,20%浓度的CSE处理可导致细胞LDH释放显著升高,且随着CSE浓度的进一步升高,LDH释放逐渐增多,提示20%或更高浓度的CSE破坏RVEC细胞膜的通透性。综合上述结果,后续实验选择既有很好抑制效果,又不会破坏RVEC细胞膜通透性的5%、10%和15%浓度的CSE处理细胞。见表1。
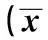
2.2CSE对大鼠RVEC凋亡的影响流式细胞仪分析显示,CSE作用大鼠RVEC 24 h后,与对照组相比,凋亡率显著增加,并且随着CSE作用浓度增加,凋亡率也随之增加(P<0.05),并且,早期凋亡和晚期凋亡与总体凋亡的趋势相同。见表2。
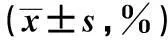
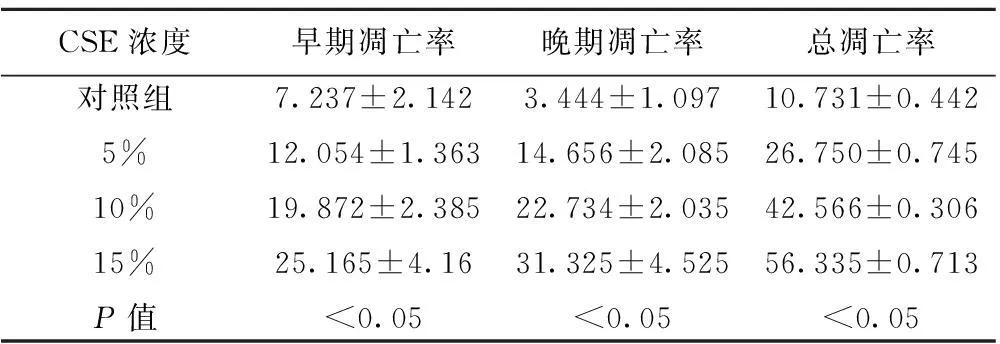
CSE浓度早期凋亡率晚期凋亡率总凋亡率对照组5%10%15%P值7.237±2.14212.054±1.36319.872±2.38525.165±4.16<0.053.444±1.09714.656±2.08522.734±2.03531.325±4.525<0.0510.731±0.44226.750±0.74542.566±0.30656.335±0.713<0.05
2.3CSE对细胞中肿瘤坏死因子(TNF-α)含量的影响ELISA结果显示,与对照组〔(10.227±1.903)pg/ml〕相比,CSE过夜处理细胞后,大鼠RVEC中的TNF-α含量明显增加5%、10%、15%,CSE组TNF-α含量分别为(16.743±2.835)、(24.663±2.382)、(38.435±3.935)pg/ml,说明CSE可以促进大鼠RVEC分泌TNF-α,并且这种促进作用具有剂量依赖性(P<0.05)。
2.4CSE对细胞中基质金属蛋白酶(MMP)含量的影响 ELISA结果显示,与对照组相比,CSE过夜处理细胞后,大鼠RVEC中的MMP含量明显增加,说明CSE可以促进大鼠VEC分泌MMP,并且这种促进作用具有剂量依赖性(P<0.05)。见表3。
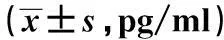
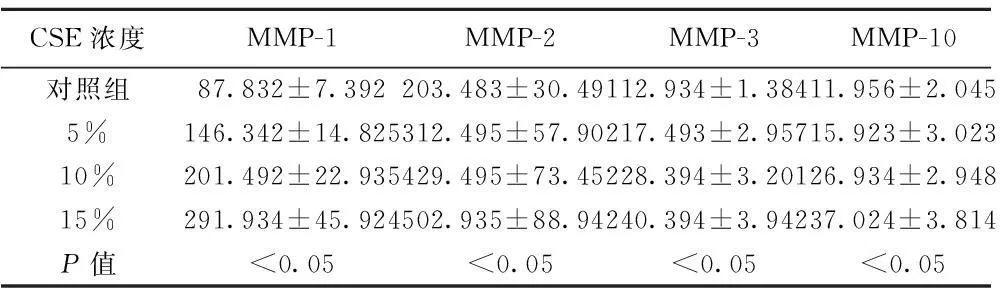
CSE浓度MMP-1MMP-2MMP-3MMP-10对照组87.832±7.392203.483±30.49112.934±1.38411.956±2.0455%146.342±14.825312.495±57.90217.493±2.95715.923±3.02310%201.492±22.935429.495±73.45228.394±3.20126.934±2.94815%291.934±45.924502.935±88.94240.394±3.94237.024±3.814P值<0.05<0.05<0.05<0.05
3讨论
香烟及其烟雾中含有的有毒物质对生物大分子如核酸、脂类和蛋白质的损伤都很严重。RVEC在维持血管功能方面发挥着重要作用,许多心脑血管常见疾病的发生,本质上都是血管内皮受损所致的内皮功能异常。其中,吸烟是重要的损伤因素之一。然而,对于吸烟造成血管内皮损伤的机制却并不清楚。有研究〔8〕表明,吸烟介导的过度氧化应激可能是重要诱因。烟雾中的氧自由基和其他氧化剂的浓度较高,直接灭活内皮源一氧化氮或者与一氧化氮结合形成具有强烈细胞毒性的过氧化氮,导致内皮细胞一氧化氮活性降低;引起脂蛋白氧化,氧化型低密度脂蛋白逐渐聚集,从而启动动脉粥样硬化;增加血管紧张素转换酶的活性,进一步增加炎症细胞因子的表达、黏附和活化,对血管内皮造成损害〔9〕。
本研究结果发现CSE可以抑制大鼠RVEC增殖,同时促进其凋亡。在细胞受到损害的过程中,TNF-α、MMP-1、MMP-2、MMP-3和MMP-10分泌增多,这些细胞因子分泌增多反过来又会进一步损伤RVEC,形成恶性循环,这些现象可能就是香烟烟雾中的氧自由基导致的一系列后果。本研究为保护内皮细胞的临床治疗和药物筛选提供了一定的理论依据。
4参考文献
1Ambrose JA,Barua RS. The pathophysiology of cigarette smoking and cardiovascular disease:an update〔J〕. J Am Coll Cardiol,2004;43(10):1731-7.
2Benowitz NL. Cigarette smoking and cardiovascular disease:pathophysiology and implications for treatment〔J〕. Prog Cardiovasc Dis,2003;46(1):91-111.
3Puranik R,Celermajer DS. Smoking and endothelial function〔J〕. Prog Cardiovasc Dis,2003;45(6):443-58.
4Deanfield JE,Halcox JP,Rabelink TJ. Endothelial function and dysfunction:testing and clinical relevance〔J〕. Circulation,2007;115(10):1285-95.
5朱宝和,何裕隆,詹文华,等. EGCG抑制IL-6诱导肿瘤血管生成的作用及机制〔J〕. 中国普通外科杂志,2011;20(7):725-30.
6张同方,万圣云,丁洋,等. Galectin-3对骨髓间充质干细胞来源的内皮细胞增殖的影响〔J〕. 中国普通外科杂志,2010;19(9):1005-9.
7Nakamura Y,Romberger DJ,Tate L,etal. Cigarette smoke inhibits lung fibroblast proliferation and chemotaxis〔J〕. Am J Respir Crit Care Med,1995;151(5):1497-503.
8Givi ME,Peck MJ,Boon L,etal. The role of dendritic cells in the pathogenesis of cigarette smoke-induced emphysema in mice〔J〕. Eur J Pharmacol,2013;721(3):259-66.
9Petrusca DN,Van Demark M,Gu Y,etal. Smoking exposure induces human lung endothelial cell adaptation to apoptotic stress〔J〕. Am J Respir Cell Mol Biol,2014;50(3):513-25.
〔2014-05-20修回〕
(编辑袁左鸣)
