DC-CIK治疗老年恶性肿瘤的临床疗效
2015-12-31韩立春,陈文庆,张雪莹等
DC-CIK治疗老年恶性肿瘤的临床疗效
韩立春陈文庆1张雪莹1孙宝盛1
(青岛大学医学院,山东青岛266021)
摘要〔〕目的探讨树突细胞(DC)联合细胞因子诱导的杀伤细胞(CIK)治疗对老年恶性肿瘤的免疫功能影响。方法选取2013年3月至2014年3月吉林省肿瘤医院收治的老年恶性肿瘤患者60例,DC-CIK治疗1个疗程,治疗前后行免疫功能指标及生活质量指标自身对照。结果与治疗前相比,治疗后外周血总T淋巴细胞、T辅助细胞、自然杀伤(NK)样T淋巴细胞、NK细胞均较前明显增高、抑制性T细胞明显下降(P<0.05) ,生活质量评分较前明显改善(P<0.05)。结论DC联合CIK细胞免疫治疗能显著提高老年恶性肿瘤患者的免疫功能。
关键词〔〕DC-CIK;恶性肿瘤;免疫功能
中图分类号〔〕R730.51〔文献标识码〕A〔
恶性肿瘤发生、发展及预后与机体细胞免疫状态有关。树突细胞(DC)是机体内重要的抗原提呈细胞,可激发T 淋巴细胞介导的免疫反应。细胞因子诱导杀伤细胞(CIK)是将人外周血单个核细胞在体外与多种细胞因子及抗体共同培养一段时间后获得的一群杀伤样T细胞,对肿瘤细胞具有高效的溶解毒性。DC能够识别出肿瘤细胞,并把肿瘤细胞的相关信号传递给 CIK 细胞,使之发挥杀伤肿瘤细胞的功能。因此,DC 能显著提高 CIK 细胞针对肿瘤细胞的杀伤活性。CIK细胞治疗作为目前肿瘤生物治疗的首选方案,已在恶性肿瘤治疗中取得较好的疗效〔1,2〕。老年恶性肿瘤患者年老体弱,自体培养出的DC-CIK细胞质量欠佳,本文尝试利用异体脐带血DC-CIK细胞对这类患者进行辅助治疗,并就其临床疗效进行观察。
1材料与方法
1.1研究对象本研究选取2013年3月至2014年3月吉林省肿瘤医院收治的老年恶性肿瘤患者60例,均经细胞或病理学确诊,甲状腺癌9例、肺癌15例、乳腺癌12例、胃癌11例、肝癌6例、结肠癌7例,男40例,女20例,年龄65~85岁,CIK治疗1个疗程以上,每天CIK输注1次, 10次为1个疗程。
1.2主要试验仪器及试剂双色荧光标记抗体CD 分子单克隆抗体 CD4-FITC /CD8-PE、CD3-FITC/CD16 +CD56-PE、CD25-FITC、CD127-PE、CD4-PC5 购自美国贝克曼公司,实验选用美国贝克曼公司 XLMCL 流式细胞仪。
1.3CIK制备与回输CIK由本院肿瘤研究所实验室规范制备:采异体脐带血50 ml,利用淋巴细胞分离液分离血液中的单核细胞,按照2×106ml浓度分装至培养瓶内,培养液含有人白细胞介素(rhIL)-2,CD3,γ-干扰素(IFN)-γ,在5% CO2、37℃培养箱内培养,观察细胞生长状态,24 h后进行细菌、内毒素检测无污染后进行下一步DC、CIK的诱导。将培养6 d的DC与CIK按1∶5的比例混合培养,在混合培养的第3天检测细胞活性,并做细菌和内毒素检测,无问题给患者使用。
1.4治疗方案采用CIK静脉输注,每次输注细胞数以1×108~2×108为1个单位进行静脉输注,根据情况进行,10次输注为1个疗程。治疗后1 w评价疗效。
1.5疗效评价
1.5.1细胞免疫功能评价分别于治疗前 1 d及治疗结束后1 w采集清晨空腹外周静脉血 5 ml,用淋巴瘤细胞分离液分离出单个核细胞后,每个试管分装105/100 μl细胞,分别有各自的抗体4 μl后4℃孵育30 min后,用磷酸盐缓冲液(PBS)洗2次后流式细胞仪测定,计数10 000个细胞,测定总T淋巴细胞、T辅助/诱导细胞、T抑制/细胞毒细胞、自然杀伤(NK)细胞、NK样T淋巴细胞、调节性T细胞阳性表达率及免疫状态。
1.5.2生存质量评价记录患者食欲、睡眠、精神、体力的变化,以数字0~5表示,0为无干扰,5为严重干扰;血常规、肝、肾功、离子、血糖变化;症状、体征的变化及不良反应。
1.6安全性评价记录患者症状体征的变化及不良反应。
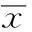
2结果
2.1治疗前后T细胞亚群比例比较患者行DC-CIK细胞治疗后,免疫功能检测的各项指标均增高,其中CD3+、CD3+CD4+、CD3+CD56+、CD3-CD56+、CD4+/CD8+值明显增高(P<0.05)。见表1。
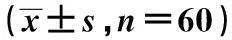
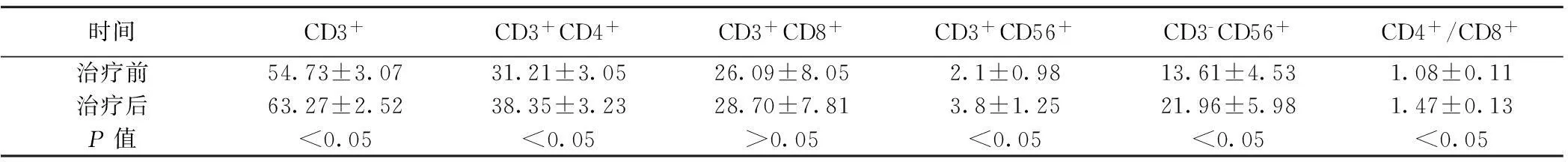
时间CD3+CD3+CD4+CD3+CD8+CD3+CD56+CD3-CD56+CD4+/CD8+治疗前54.73±3.0731.21±3.0526.09±8.052.1±0.9813.61±4.531.08±0.11治疗后63.27±2.5238.35±3.2328.70±7.813.8±1.2521.96±5.981.47±0.13P值<0.05<0.05>0.05<0.05<0.05<0.05
1吉林省肿瘤医院
第一作者:韩立春(1974-),女,硕士,副主任医师,主要从事肿瘤内科学研究。
2.2治疗前后生活质量评分比较60例患者经DC-CIK细胞治疗后,生活质量指标中食欲不振、失眠、精神萎靡、乏力症状均明显改善(均P<0.05)。见表2。
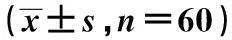

时间食欲不振失眠精神萎靡乏力治疗前3.78±1.013.31±1.133.59±1.093.72±0.87治疗后2.09±0.832.22±0.802.58±0.922.28±0.81P值<0.05<0.05<0.05<0.05
2.3安全性评价结果细胞回输后大多数无明显不良反应,只有5例患者发热,体温最高达38.5℃,为一过性,对症处理后可降至正常。血常规及肝、肾功、离子、血糖未见明显异常。
3讨论
CIK临床应用的研究建立在过继性细胞免疫疗法的机制基础上,旨在消除肿瘤免疫抑制影响,增加CIK数量和细胞毒效应,其发展经历了从NK疗法到CIK细胞以及 DC与CIK联合使用的过程〔3〕。常规的方法是从患者外周血提取单核淋巴细胞(PBMC),或因自体细胞采集困难可以从脐带血中获取,这些细胞在体外一方面接受肿瘤抗原的刺激分化为抗原提呈的DC细胞,另一方面经过IFN-γ、IL-2和抗CD3抗体等诱导刺激,成为具有免疫活性CIK细胞。自体回输后,这些活化的CIK细胞不产生明显的副作用,但可以直接杀伤、抑制肿瘤细胞,或通过刺激免疫系统,提升机体整体抗瘤免疫力。
CIK细胞兼具T淋巴细胞组织相容性复合体(MHC)限制性和NK细胞非MHC性的杀瘤活性,是广谱的效应细胞,对肺癌、结直肠癌、胃癌、肾癌、乳腺癌、宫颈癌等肿瘤细胞以及许多耐药肿瘤细胞均有显著杀伤活性。随着对CIK的深入研究,目前已有大量文献报道将其应用于恶性肿瘤治疗的临床研究〔4~7〕。CIK杀瘤机制是通过释放胞质颗粒酶B作用于肿瘤靶细胞;亦可通过FasL-Fas途径诱导Fas+肿瘤细胞凋亡;另外,CIK产生许多炎性细胞因子,如肿瘤坏死因子-α(TNF-α)、IL-2和IFN-α等,可以有效抑制周边肿瘤细胞生长〔8〕。研究〔9〕表明,CIK的应用还可以协同化放疗的抗瘤作用。最新文献〔10〕报道,体外活化时加入IL-12因子能明显增强CIK细胞的杀伤效应;而且, CIK富集培养时间也得到明显缩短。
肿瘤形成的一个重要因素就是失去机体正常的免疫监视功能,晚期恶性肿瘤病人表现为逐渐的免疫反应不全,肿瘤细胞产生生物活性物质引起T 细胞增殖抑制,免疫系统功能不全,活化和(或)增加免疫细胞的凋亡达到削弱机体免疫功能,逃避免疫监视〔11〕。研究显示,肿瘤患者体内CD4+CD25+调节T 细胞明显高于正常人,从而抑制了机体免疫功能。李敏等〔12〕显示治疗后的CD4+CD25+T 比例降低,故认为CIK 细胞能在一定程度上提高肿瘤机体的免疫功能,改善免疫抑制状态。
本研究表明患者治疗后免疫功能得到改善。由此可见, 经过CIK 细胞回输治疗后机体除直接杀伤肿瘤细胞的能力较治疗前获得提高外, CIK细胞还通过调节机体其他免疫细胞的功能, 包括增强抗肿瘤活性、刺激NK 细胞生长、改变T 细胞亚群比率、刺激机体T 细胞增殖等方式使患者增强免疫监视作用, 维持机体内环境的平衡, 增强机体免疫功能。治疗过程中,部分患者出现发热、畏寒等不适,可能是由于治疗后大量细胞因子释放作用于中枢神经系统产生的体温上调反应。
综上所述,CIK易于体外培养、增生速度快,可提高机体免疫力,安全性高,不良反应少,用于治疗老年恶性肿瘤可改善患者的生活质量和延长其生命。
4参考文献
1Li XD,Xu B,Wu J,etal.Review of Chinese clinical trials on CIK cell treatment for malignancies 〔J〕.Clin Transl Oncol,2012;14(2):102-8.
2Mesiano G,Todorovic M,Gammaitoni L,etal.Cytokine-induced killer(CIK) cells as feasible and effective adoptive immunotherapy for the treatment of solid tumors 〔J〕.Expert Opin Biol Ther,2012;12(6):673-84.
3Wang QJ Wang H,Pan K,etal. Comparative study on anti-tumor immune response of autologous cytokine-induced killer(CIK) cells,dendritic cells-CIK(DC-CIK),and semi-allogeneic DC-CIK〔J〕.Chin J Cancer,2010;29(7):641-8.
4Sangilolo D.Cytokine induced killer cells as promising immunotherapy for solid tumors 〔J〕.J Cancer,2011;2(4):363-8.
5Niam M,Linn YC,Fook-Chong S,etal.Clinical scale expansion of cytokine-induced killer cells is feasible from healthy donors and patients with acute and chronic myeloid leukemia at various stages of therapy 〔J〕.Exp Hematol,2011;39(9):897-903.
6Lu XC,Yang B,Yu RL,etal.Clinical study of autologous cytokine-induced killer cells for the treatment of elderly patients with diffuse larfe B-cell lymphoma 〔J〕.Cell Biochem Biophys,2012;62(1):257-65.
7Yu J,Ren X,Li H,etal.Synergistic effect of CH-296 and interferon gamma on cytokine-induced killer cells expansion for patients with advanced-stage malignant aolid tumors 〔J〕.Cancer Biother Radiopharm,2011;26(4):485-94.
8Vemeris MR,Komacker M,Mailander V,etal.Resistance of ex vivo expanded CD3+ CD56+ T cells to Fas-mediated apoptosis〔J〕.Cancer Immununol Immunother,2000;49(6):335-45.
9Marin V,Pizztola I,Agostoni V,etal.Cytokine-induced killer cells for cell therapy of acute myeloid leukemia:improvement of their immune activity by expression of CD33- specific receptors〔J〕.Haematologica,2010;95(12):2144-52.
10Helms MW,Prescher JA,Cao YA,etal.IL-12 enhances efficacy and shortens enrichment time in cytokine-induced killer cell immunotherapy〔J〕.Cancer Immunol Immunother,2010;59(9):1325-34.
11Hobeika AC,Morse MA,Osada T,etal. Depletion of human regulatory T Cells〔J〕. Methods Mol Biol,2011;707(2):219-31.
12李敏,邓海峰,陆明洋,等. CIK 治疗前后肿瘤患者外周血CD4+CD25+调节型T 细胞变化研究〔J〕. 中国实验诊断学,2011;15(6):1051-3.
〔2014-05-07修回〕
(编辑袁左鸣)
