对位取代金属卟啉的合成及其催化氧化对甲基异丙苯的初步研究
2015-12-31吴腊梅,唐艳柳,孙志成等
对位取代金属卟啉的合成及其催化氧化对甲基异丙苯的初步研究
吴腊梅1,唐艳柳1,孙志成2,佘远斌1,3
(1中南民族大学 化学与材料科学学院, 武汉 430074;2 北京印刷学院 印刷与包装工程学院, 北京102600;3浙江工业大学 化学工程学院, 杭州 310014)
摘要用混合溶剂方法,合成了5种对位取代的四苯基卟啉配体,收率范围为23%~52%,对卟啉配体进行轴向金属化反应得到含有中心金属离子(铁、钴、锰)及轴向氯配位的一系列金属卟啉化合物(金属化收率为90%~98%),并用红外光谱、紫外-可见光谱及核磁氢谱对所合成的卟啉化合物进行了结构表征.首次研究了金属卟啉催化分子氧在无溶剂绿色条件下氧化对甲基异丙苯.结果表明:对甲氧基四苯基卟啉和对氯四苯基卟啉的两价钴配合物的催化氧化活性较强.
关键词合成; 表征; 催化氧化; 对甲基异丙苯
收稿日期2014-07-31
作者简介吴腊梅(1969-),女,副教授,博士,研究方向:有机合成,E-mail:wlm52875@163.com
基金项目国家自然科学基金资助项目(21206171)
中图分类号O621.3文献标识码A
收稿日期2014-10-28
The Synthesis of Metal Complexes ofmeso-tetra [para-substituent
phenyl] Porphyrins and Catalytic Oxidation ofp-cymene
WuLamei1,TangYanliu1,SunZhicheng2,SheYuanbin1,3
(1 College of Chemistry and Materials Science, South-Central University for Nationalities, Wuhan 430074;
2 College of Printing and Packaging engineering, Beijing Institute of Graphic Comminication, Beijing 102600;
3 Institute of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310014)
AbstractFive meso-tetra [para-substituent phenyl] porphyrins(TPPs) were synthesized from para-substituent benzaldehyde and pyrrole in mixed solvent. The yields of the five TPPs ranged from 23% to 52%. These TPPs could react with metal ion (Co2+, Mn2+, Fe2+) and axial chloride ligand to produce a series of metalloporphyrins with high (90%~98%) yields. These TPPs and metalloporphyrins were characterized by1H NMR, UV-Vis and infrared spectra. A novel solvent-free green oxidation process of p-cymene catalyzed by metalloporphyrins in the presence of molecular oxygen was developed for the first time. The results show that the T(p-Cl)PPCoCl and T(p-OCH3)PPCoCl presented better activities for p-cymene oxidation reactions than the other metalloporphyrins.
Keywordssynthesis; characterization; catalytic oxidation; p-cymene
由于卟啉类化合物是由4个吡咯环链接而成的大环化合物,形成18个π电子云环状共轭体系,使体系内电子具有较好的流动性.环外修饰的金属卟啉具有较好的电子传递、氧转移、氧化还原等诸多特殊功能,可应用于材料化学[1-3]、药物化学[4,5]、分析化学、仿生催化[6-12]等,由于天然卟啉类化合物存在某些特殊的生理活性,采用人工方法合成此类卟啉化合物模拟天然卟啉,是学者研究的重要课题之一.
金属卟啉类化合物作为仿生催化剂,即温和条件下活化分子氧反应条件温和、能耗低、环境友好、降能减排,有望成为仿生催化剂的主角.影响金属卟啉催化氧化活性的因素有:自旋态、配体空间立体效应、轴向配体、卟啉环外取代基和中心金属离子等.通过在卟啉环上引入取代基会改变中心金属的氧化还原电位,进而影响催化剂的催化活性.由于引入吸电子基的吸电子作用可提高中心金属的氧化还原电势[13],使金属-氧键强度变弱,活性中间体的活性增强;卟啉环上的电子云密度降低,减少了金属离子受更高价铁物种亲电进攻的可能性.
芳酮和芳醛是重要的有机合成中间体,广泛用于香料、医药等行业,主要通过芳烃的Friedel-Crafts酰基化,以苯或乙腈作溶剂,双氧水为氧化剂等而获得[14-16],此类方法污染环境,严重腐蚀设备,而通过芳烃的侧链选择性氧化制备芳酮和芳醛这一路线更为符合绿色合成的要求.本文通过混合溶剂法两步合成一系列轴向为氯的对称型金属卟啉类催化剂,包括卟啉环的外环苯基上取代基为p-NO2、p-Cl、p-OCH3、p-OH、-H,中心金属离子为Mn2+,Fe2+,Co2+,并对其表征并探讨其催化活性,以对甲基异丙苯为氧化底物,在无溶剂条件下用以上金属卟啉进行催化氧气氧化,初步确定了有对甲基苯乙酮和对异丙基苯甲醛.
1实验部分
1.1试剂与仪器
对羟基苯甲醛、对硝基苯甲醛、对氯苯甲醛、对甲氧基苯甲醛、苯甲醛、吡咯、对N,N-二甲基亚硫酰胺、四水醋酸锰、四水醋酸钴、四水氯化亚铁、对异丙基甲苯、丙酸、冰醋酸、氯乙酸,以上试剂均为分析纯.
旋转蒸发仪(RE-52A,上海亚荣生化仪器厂),紫外可见光谱仪(UV-2450, 日本Shimadzu),傅里叶变换红外光谱仪(Nicolet iS10, 赛默飞世尔科技公司),气相色谱仪(Trace 1300, 赛默飞世尔科技公司),核磁共振仪(Mercury-400, 德国Bruker).
1.2卟啉配体的合成
合成反应式如图1所示.
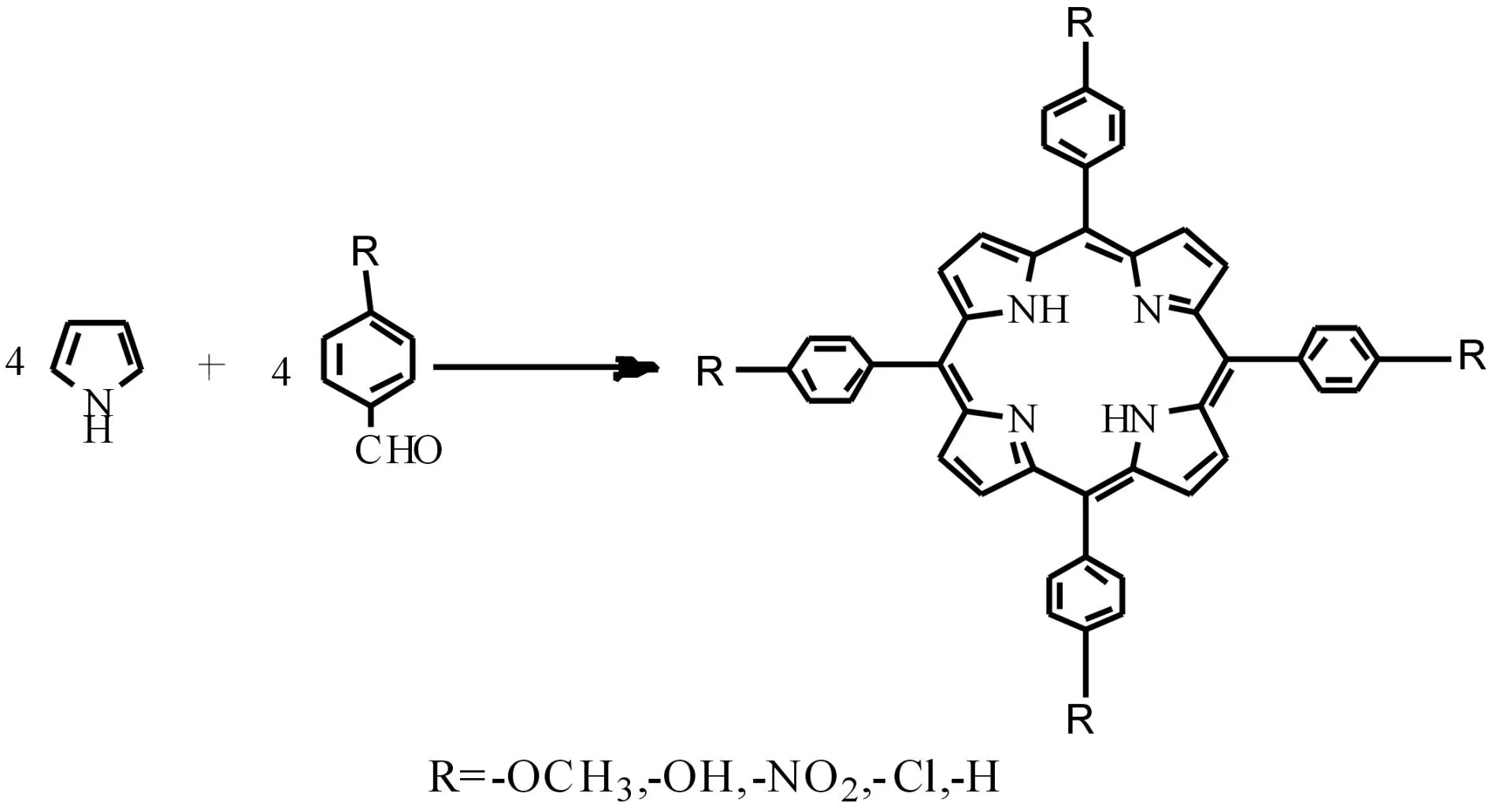
图1 卟啉配体合成 Fig.1 Synthesis of porphyrin ligands
1.2.1四-(对-氯苯基)卟啉的合成
参考文献[17],在装有搅拌器、回流冷凝管和滴液漏斗的250 mL三颈烧瓶中,分别加入10 mmol对氯苯甲醛(1.408 g)、60 mL丙酸、20 mL冰醋酸、20 mL硝基苯,加热回流30 min后,向烧瓶内滴加10 mmol新蒸吡咯(0.7 mL)的10 mL硝基苯溶液,15 min内加完,继续加热回流2 h后,停止加热,待烧瓶温度降至50~60 ℃,边搅拌边向烧瓶内加入30 mL CH3OH,冷却至室温.过夜后抽滤,用CH3OH洗涤滤饼,干燥得蓝紫色晶体目标产物,称重计算收率为41.6%.1H NMR (CDCl3, Me4Si )δ:H 2.62(2H, pyrrole-N-H),7.51~7.70(8H, Ph),7.95~8.07(8 H, Ph),8.66(8 H, β-pyrrole-H);IR(KBr) ν/cm-1 3315 (w, NH ), 1627 (w, C=C), 1349 (m, C=N), 965 (s, NH), 796 (s, C-H). 与文献[17]值基本一致.
1.2.2四苯基卟啉配体的合成
在装有搅拌器、回流冷凝管及滴液漏斗的250 mL三颈烧瓶中,分别加入10 mmol对苯甲醛(1.01 mL)、70 mL丙酸、10 mL冰醋酸、10 mL硝基苯,加热回流30 min后,向烧瓶内滴加10 mmol新蒸吡咯(0.7 mL)的10 mL硝基苯溶液,15min内加完,继续加热回流2 h后,停止加热,待烧瓶温度降至50~60 ℃,边搅拌边向烧瓶内加入30 mL CH3OH,冷却至室温.放置过夜后抽滤,滤饼用CH3OH洗涤,干燥即得蓝紫色晶体目标产物,称重计算收率为33.2%.1H NMR (CDCl3, Me4Si)δ:H 2.76 (2H, pyrrole -NH),7.74~7.78(12H, Ph), 8.21~8.23(8H, Ph), 8.85(8H,β-pyrrole-H);IR(KBr)ν/cm-13314(w, NH), 1595(w, C=C), 1349(m, C=N), 965(s, NH), 799(s, C-H).与文献[17]值基本一致.
四-(对-甲氧基苯基)卟啉(收率 56.8%)合成方法同上.
1.2.3 四-(对-硝基苯基)卟啉的合成
参考文献[18],在装有搅拌器、回流冷凝管及滴液漏斗的250 mL三颈烧瓶中,分别加入10 mmol对硝基甲醛(1.5 g)、75 mL冰醋酸、50 mL硝基苯,加热至120 ℃,搅拌 30 min后,向烧瓶内滴加10 mmol新蒸吡咯(0.7 mL),15min内加完,继续加热回流2 h后,停止加热,待烧瓶温度降至50~60 ℃,边搅拌边向烧瓶内加入30 mL CH3OH,冷却至室温.放置过夜后抽滤,用CH3OH洗涤滤饼,干燥得蓝紫色晶体目标产物,称重计算收率为23.6%.
四-(对-羟基苯基)卟啉(收率23.2%)的合成方法同上.
1.3金属卟啉的合成
合成反应式如图2所示.

图2 金属卟啉的合成 Fig.2 Synthesis of metalloporphyrins
在100 mL三口烧瓶中,将0.2 mmol对甲氧基卟啉配体、30 mL DMF和3 mL冰醋酸放入装有磁力搅拌和干燥管的回流装置中,加热回流30 min后,将0.3 g四水醋酸钴(1.2 mmol)在30 min 内分几批加入装置中,取样,用紫外-可见分光光度计进行分析,判断反应终点.反应结束后,停止加热,待温度降至室温,缓慢加入40 mL盐酸[V(水)︰V(盐酸)=1︰1],充分冷却、静置、抽滤,用稀盐酸[V(水)︰V(盐酸)=4︰1]充分洗涤产物,干燥、称重.
其他的金属卟啉合成方法同上.
1.4金属卟啉催化氧化对甲基异丙苯活性的研究
(1) 在100 mL的高压反应釜中,加入6.4×10-2mol (10 mL) 对甲基异丙苯,2.7×10-6mol(0.0020 g)的TPPCoCl,在2.0 MPa, 60~120℃ 不等温度下, 700 r/min下反应10 h后取样,稀释成10-6级别,经过滤膜后进入气相色谱,通过气相色谱分析原料转化率、各产物的选择性等.通过柱层析方法将各产物分离提纯,进行相关的化合物表征.
(2) 在100 mL的高压反应釜中,加入6.4×10-2mol (10 mL) 对甲基异丙苯,2.5×10-6mol(0.0021 g)的T(p-Cl)PPCoCl,在2.0 MPa, 60~120℃ 不等温度下, 700 r/min下反应10 h后取样,稀释成10-6级别,经过滤膜后进入气相色谱,通过气相色谱分析原料转化率、各产物的选择性等.通过柱层析方法将各产物分离提纯,进行相关的化合物表征.
2结果讨论
2.1金属卟啉催化剂的紫外可见光谱表征
当卟啉配体环内嵌入金属离子时,4个吡咯环上的N原子均与中心金属离子配位,使金属卟啉配合物结构的分子对称性提高,能级靠近,所形成的金属卟啉配合物属于D4h点群,故相对于卟啉配体来说紫外光谱特征表现为Q带吸收峰减弱,Soret带发生位移(见图3和表1、表2).
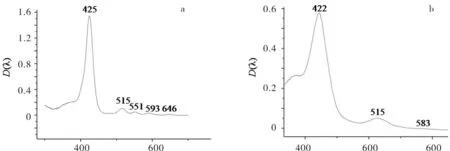
λ/nm λ/nm 图3 T(p-NO 2)PP(a)和T(p-NO 2)PPFeCl(b)上金属前后紫外谱图 Fig.3 Ultraviolet spectra of T(p-NO 2)PP(a) and T(p-NO 2)PPFeCl(b)
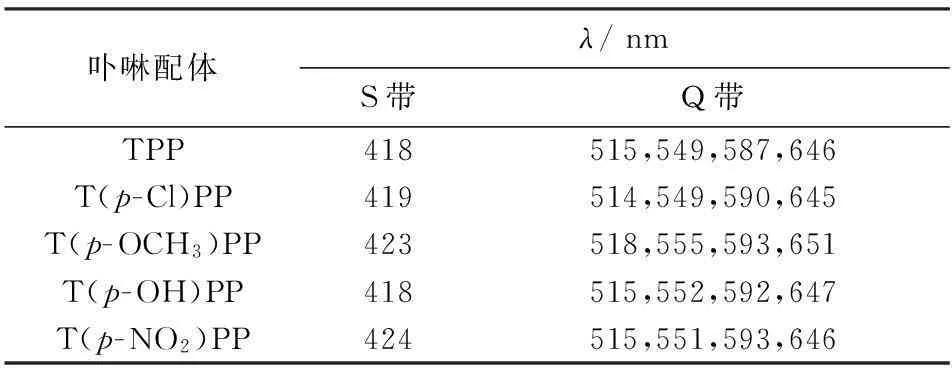
卟啉配体λ/nmS带Q带TPP418515,549,587,646T(p-Cl)PP419514,549,590,645T(p-OCH3)PP423518,555,593,651T(p-OH)PP418515,552,592,647T(p-NO2)PP424515,551,593,646

表2 金属卟啉紫外表征
2.2金属卟啉催化剂红外光谱表征
金属卟啉催化剂红外光谱表征结果见图4.由图4可知,卟啉配体3317 cm-1处的N-H伸缩振动吸收峰及966 cm-1处的弯曲振动吸收峰在金属卟啉中消失,约在1000 cm-1处有新峰出现,说明卟啉配体环内的2个吡咯脱质子与金属离子生成N-M配位键得到金属卟啉配合物,与文献值[17]一致.两处吸收峰的消失标志着金属配合物的生成.
同时图中2925~3117 cm-1为吡咯环和苯环上的C-H伸缩振动吸收峰,997~1010 cm-1区域的强吸收峰为金属卟啉配合物的特征吸收峰,1344~1348 cm-1和1520~1596 cm-1谱带为苯环和吡咯环上的C=C、C=N键的伸缩振动吸收峰,苯环对位取代时,其环上C-H的伸缩振动吸收峰约在800 cm-1.

σ/cm -1 a) 卟啉;b) 金属卟啉 图4 T(p-NO 2)PPFeCl上金属Fe前后红外谱图 Fig.4 IR spectrum of T(p-NO 2)PP and T(p-NO 2)PPFeCl
2.3金属卟啉催化氧化对甲基异丙苯活性研究
在无溶剂情况下,温度为60~120℃时,用系列对位取代的金属卟啉直接催化O2氧化对甲基异丙苯(见图5),通过气相色谱对氧化产物选择性、原料的转化率和产物的收率进行研究分析,并探索反应温度、反应时间、氧气压力等对反应各产物的选择性和转化率的影响情况.

图5 金属卟啉催化氧化对甲基异丙苯反应式 Fig.5 Catalytic oxidation of p-cymene by metalloporphyrins
研究发现对甲氧基四苯基卟啉和对氯四苯基卟啉的两价钴配合物的催化氧化活性较强,转化率分别为26%和25% (见表3).对甲基异丙苯在60℃下反应12 h后,T(p-OH)PPCoCl和T(p-OH)PPMnCl作为催化剂时氧化底物对甲基异丙苯并未发生反应,而T(p-OH)PPFeCl催化氧化时则有少量对异丙基苯甲醛生成,表明在氧化对甲基异丙苯时T(p-OH)PPFeCl作为催化剂时最先氧化的甲基上的C-H键,涉及一级碳和三级碳的竞争反应和选择氧化.
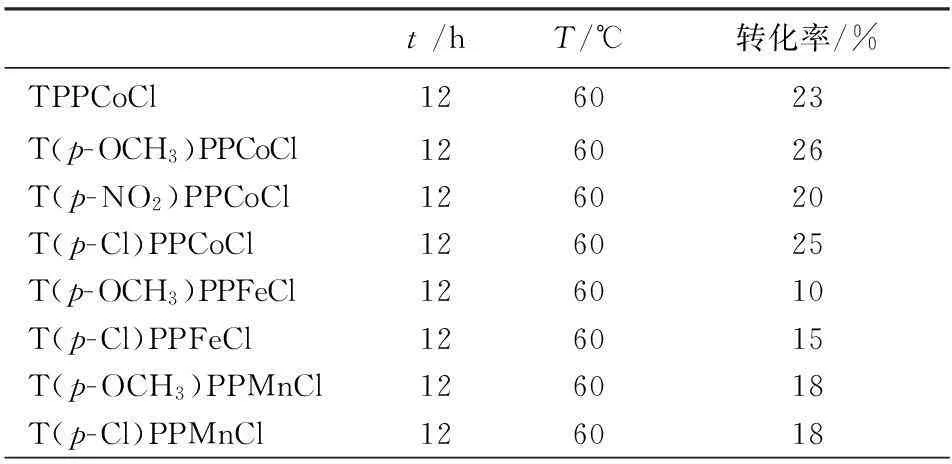
表3 对甲基异丙苯氧化初步研究
2.3.1TPPFeCl催化红外表征
当用TPPFeCl催化时,对比反应前后的混合液红外谱图(见图6)可知,反应后的混合液多出了1704.62 cm-1和3497.19 cm-1两个峰,可能为羰基峰或者羧基,说明底物已经部分被氧化了.

σ/cm -1 a) 反应前混合液;b) 反应后混合液 图6 TPPFeCl催化氧化对甲基异丙苯红外谱图 Fig.6 IR spectrum of catalytic oxidation of p-cymene by TPPFeCl
2.3.2TPPCoCl催化红外表征
TPPCoCl催化氧化时,对比反应前后混合液的红外谱图(见图7)可知,反应后的混合液谱图多出了1700.28 cm-1和3497.19 cm-12个峰,可能是羰基或羧基的峰,说明TPPCoCl催化氧化时底物已部分被氧化了.

σ/cm -1 a) 反应前混合液;b) 反应后混合液 图7 TPPCoCl催化氧化对甲基异丙苯红外谱图 Fig.7 IR spectrum of catalytic oxidation of p-cymene by TPPoCl
2.3.3TPPMnCl催化红外表征
TPPMnCl催化氧化时,对比反应前后混合液的红外谱图(见图8)可知,反应后的混合液谱图多出了1700.18 cm-1和3494.19 cm-12个峰,可能是羰基或羧基的峰,说明TPPMnCl催化氧化时部分底物已经被氧化了.
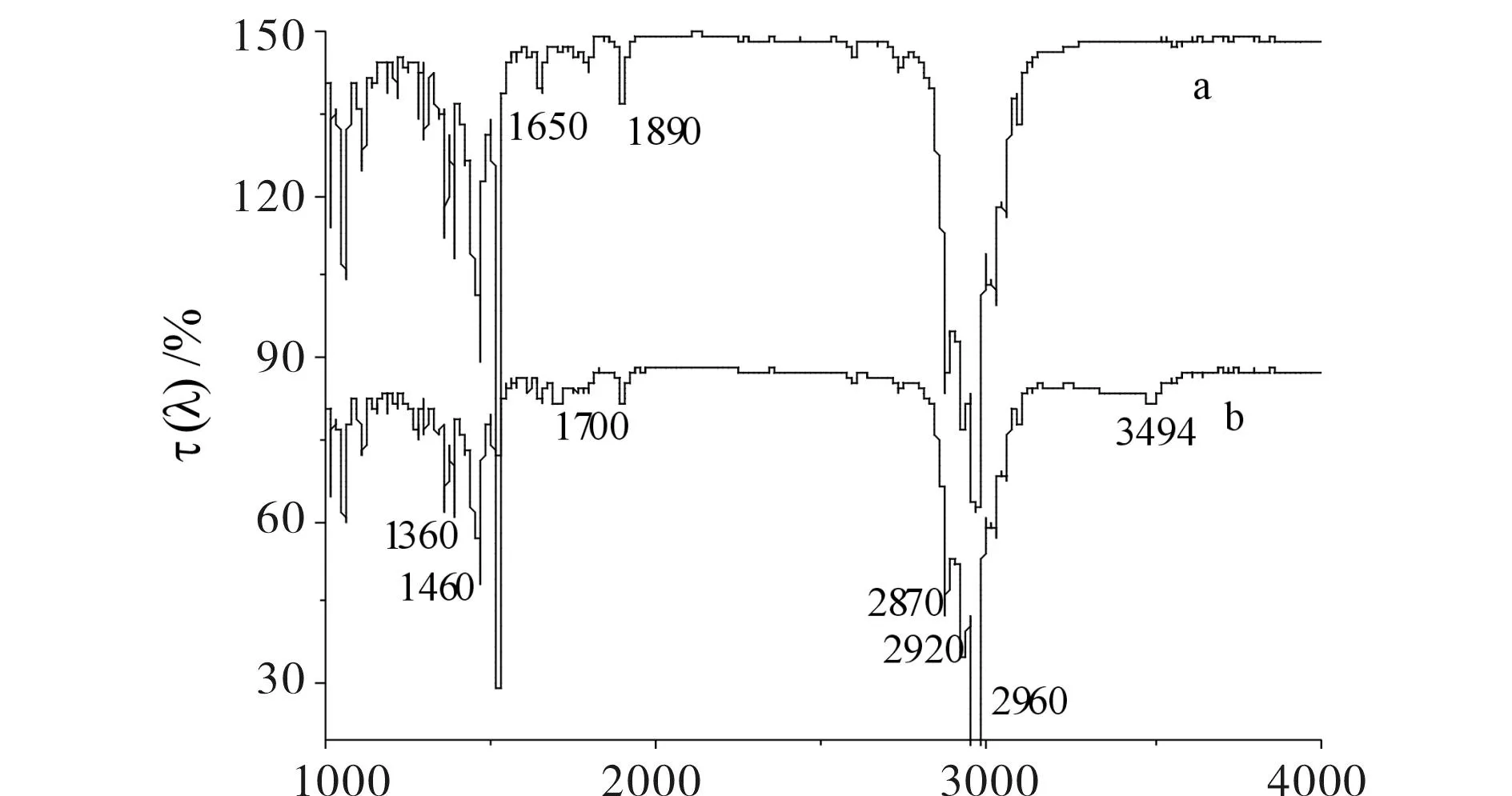
σ/cm -1 a) 反应前混合液;b) 反应后混合液 图8 TPPMnCl催化氧化对甲基异丙苯红外谱图 Fig.8 IR spectrum of catalytic oxidation of p-cymene by TPPMnCl
2.4气相色谱法表征
通过标样和GC分析确定了氧化产物中有4-甲基苯乙酮和对异丙基苯甲醛,见下图9和图10. 图9中标样酮的出峰时间为8.087 min,加入标样酮后,在7.99 min 处峰面积从0.1466增大到1.6312;图10中标样醛的GC出峰时间为8.78 min,加入标样醛后,在8.78 min 处峰面积从0.1383增大到1.5475.确认结果说明底物已有部分氧化出现羰基类化合物,通过用金属卟啉对对异丙基甲苯直接催化氧化合成醛或者酮是目前未见文献报道,此方法具有对环境友好、反应条件温和和低能耗等优点.
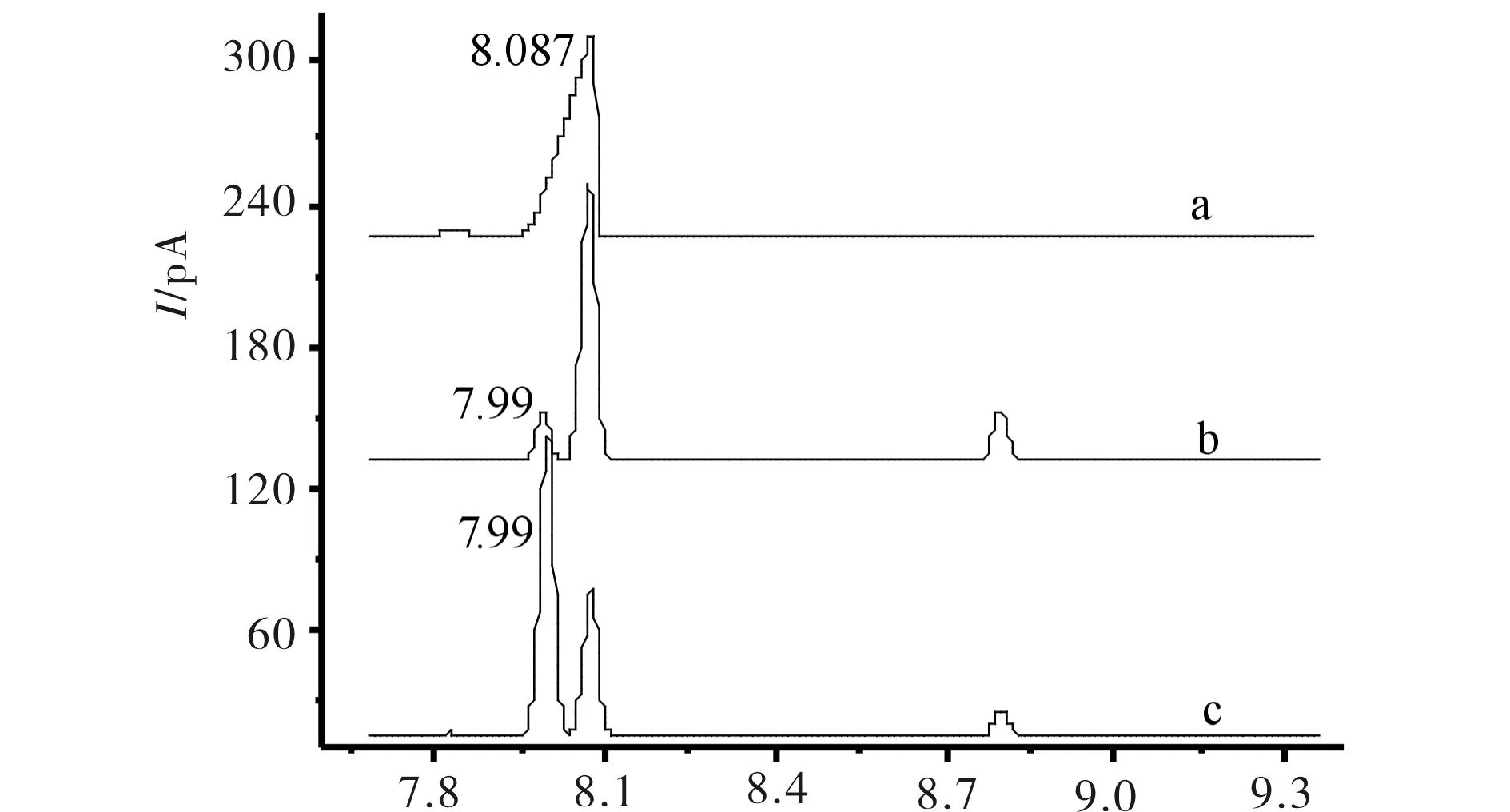
a) 标样4 -甲基苯乙酮;b) 未加标样;c) 加入标样酮后 图9 标样4 -甲基苯乙酮和TPPCoCl催化氧化后 甲基异丙苯时产物酮的GC图 Fig.9 Prototype of 4-methyl acetophenone and catalytic oxidation product ketone GC figure of p-cymene by TPPCoCl
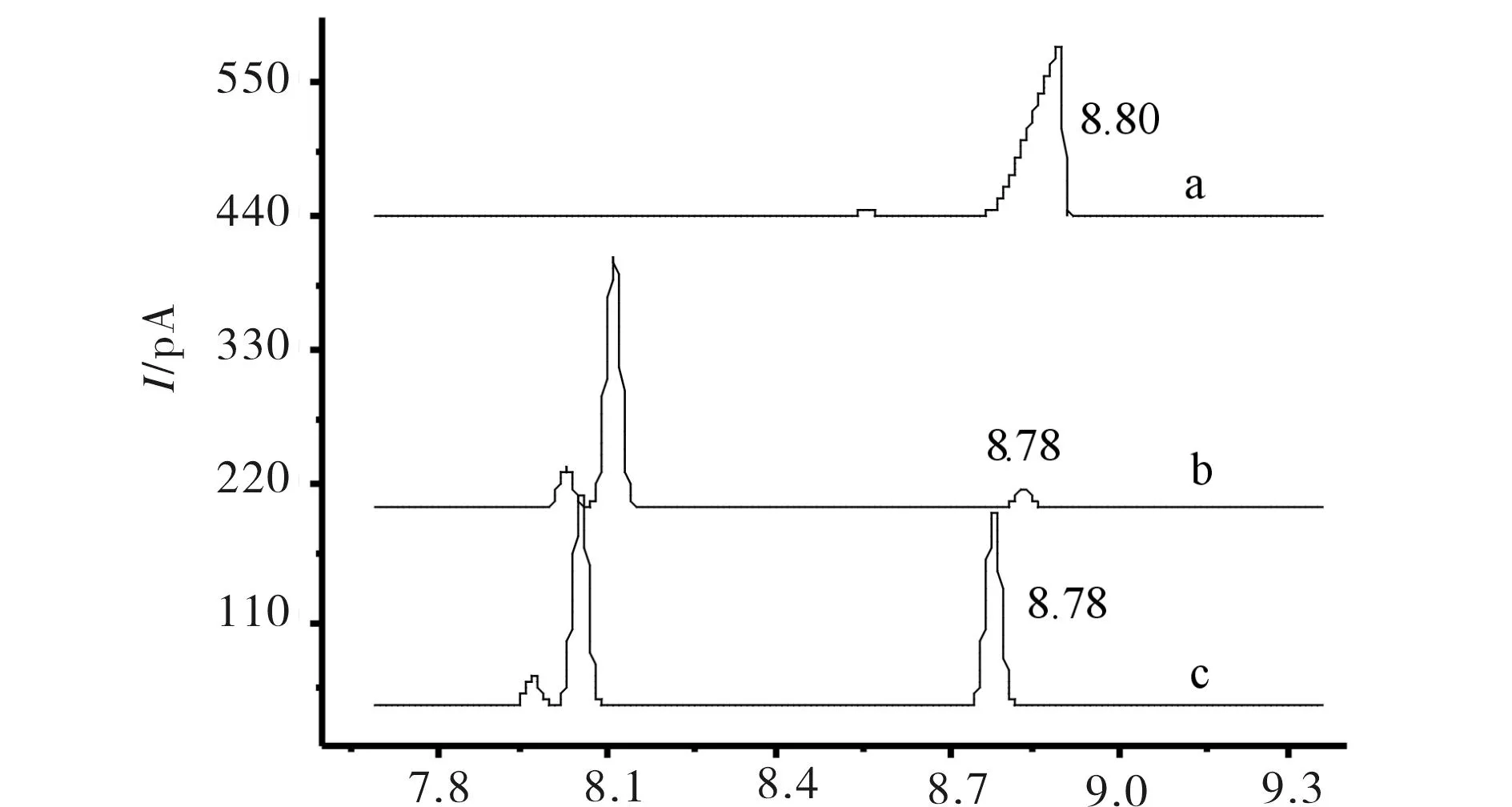
a) 标样对异丙基苯甲醛;b) 未加标样;c) 加入标样醛后 图10 标样对异丙基苯甲醛和T(p-Cl)PPCoCl催化氧化 对甲基异丙苯产物醛的GC图 Fig.10 Prototype of cumin aldehyde and catalytic oxidation product aldehyde GC figure of p-cymene by T(p-Cl)PPCoCl
3结语
本文利用混合溶剂法成功合成了一系列对位取代的四苯基卟啉及其金属配合物,对它们进行了结构表征,并应用这些金属卟啉配合物催化氧化对甲基异丙苯,初步确认了氧化产物有醛、酮,可能的产物有羧酸和其他物质,将进一步对各种产物进行定性定量研究优化氧化条件,分析产物种类,控制收率等.
参考文献
[1]Lee S J, Hupp J T, Nguyen SonBinh T. Growth of narrowly dispersed porphyrin nanowires and their hierarchical assembly into macroscopic columns[J]. J Am Chem Soc, 2008, 130(30): 9632-9633.
[2]Kelley R F, Lee S J, Wilson T M, et al. Intramolecular energy transfer within butadiyne-linked chlorophyll and porphyrin dimer-faced, self-assembled prisms[J]. J Am Chem Soc, 2008, 130 (13): 4277-4284.
[3]Yang J, Park M, Yoon Z S, et al. Excitation energy migration processes in cyclic porphyrin arrays probed by single molecule spectroscopy[J]. J Am Chem Soc, 2008, 130(6), 1879-1884.
[4] Ballut S, Naud-Martin D, Loock B, et al. A strategy for the targeting of photosensitizers. synthesis, characterization, and photobiological property of porphyrins bearing glycodendrimeric moieties[J]. JOC, 2011, 76 (7): 2010-2028.
[5] Hammerer F, Achelle S, Baldeck P, et al. Influence of carbohydrate biological vectors on the two-photon resonance of porphyrin oligomers[J]. J Phys Chem A, 2011, 115 (24): 6503-6508.
[6] 刘强, 郭灿城.金属卟啉仿生催化烃类C-H 键氧化活化的基础研究和应用进展[J].中国科学:化学,2012, 42 (10): 1399-1416.
[7] Poulos T L. Heme enzyme structure and function[J]. Chem Rev, 2014, 114(7): 3919-3962.
[8] Crabtree R H. Introduction to selective functionalization of C-H bonds[J]. Chem Rev, 2010, 110: 575.
[9] Sorokin A B. Phthalocyanine metal complexes in catalysis[J]. Chem Rev, 2013, 113(10):8152-8191.
[10]Anderson C E,Vagin S I,Xia Wei,et al. Cobaltoporphyrin-catalyzed CO2/epoxide copolymerization: selectivity control by molecular design[J]. Macromolecules,2012,45(17):6840-6849.
[11]佘远斌. 金属卟啉-金属盐复合催化剂催化氧化邻甲酚制备邻羟基苯甲醛的方法:中国, 201310084457.0[P].2013-07-03.
[12] Da Silva V S, Teixeira L I, do Nascimento E, et al. New manganese porphyrin as biomimetic catalyst of cyclohexane oxidation: Effect of water or imidazole as additives[J]. Appl Catal A: Gen , 2014, 469(17): 124-131.
[13] 佘远斌,王兰芝,宋旭锋,等. 金属卟啉类仿生催化剂的合成、构效关系及在催化氧化碳氢化合物中的应用[J]. 精细化工,2005, 22(6): 402-408.
[14] Nair K, Sawant D P, Shanbhag G V, et al. Aerial oxidation of substituted aromatic hydrocarbons catalyzed by Co/Mn/Br-in water-dioxane medium[J].Catal Commun, 2004, 5(1): 9-13.
[15] Baciocchi E, D′Acunzo F, Galli C, et al. Tertiary: secondary: primary C-H bond relative reactivity in the one-electron oxidation of alkylbenzenes. A tool to distinguish electron transfer from hydrogen atom transfer mechanisms[J]. J Chem Soc Perkin Trans 2, 1996, 5(2):133-140.
[16]Che C M, Lo V K, Zhou C Y, et al. Selective functionalisation of saturated C-H bonds with metalloporphyrin catalysts[J]. Chem Soc Rev, 2011, 40(4): 1950-1975.
[17]孙志成. 取代四苯基卟啉化合物的合成、表征及合成规律的研究[D]. 北京:北京工业大学, 2011.
[18] Johnstone R A W, Nunes M L P G, Pereira M M, et al. Improved syntheses of 5,10,15,20-tetrakisaryl- and tetrakisalkylporphyrins[J].ChemInform, 1996, 27(46):1423-1437.
