原生质体融合选育高产脂肽LI-F多粘类芽胞杆菌及融合菌株表达差异分析
2015-12-29闫冬韩金志别小妹陆兆新吕凤霞赵海珍张充
闫冬,韩金志,别小妹,陆兆新,吕凤霞,赵海珍,张充
原生质体融合选育高产脂肽LI-F多粘类芽胞杆菌及融合菌株表达差异分析
闫冬,韩金志,别小妹,陆兆新,吕凤霞,赵海珍,张充
南京农业大学食品科学与技术学院,南京 210095

闫冬, 韩金志, 别小妹, 等. 原生质体融合选育高产脂肽LI-F多粘类芽胞杆菌及融合菌株表达差异分析. 生物工程学报, 2015, 31(9): 1401–1407.Yan D, Han JZ, Bie XM, et al. Breeding of high-producing LI-F lipopeptide Paenibacillus polymyxa by protoplast fusion and differential expression analysis of fusion strains. Chin J Biotech, 2015, 31(9): 1401–1407.
本研究以多粘类芽胞杆菌JSa-9前期诱变获得的两株带有营养缺陷型标记的菌株N1-37(Phe–)和N2-27(His–)作为亲本菌株,采用聚乙二醇作为促融剂,进行原生质体融合,筛选出高产LI-F类抗菌脂肽的融合菌株。通过HPLC对融合菌株和原始菌株产LI-F类抗菌脂肽进行定量检测,并利用实时荧光定量PCR对菌株JSa-9和融合菌株中LI-F类抗菌脂肽合成酶的关键基因A1、A2、C1和C2的差异性表达进行分析。结果表明,经过原生质融合获得一株LI-F类抗菌脂肽高产菌株F5-15。菌株F5-15的LI-F类抗菌脂肽产量为原始菌株产量的3.1倍,LI-F类抗菌脂肽合成酶的4个关键基因在融合菌株F5-15中的表达量分别是其在原始菌株JSa-9中的10.48、2.48、2.1和11.8倍。
原生质体制备,原生质体融合,实时荧光定量PCR
LI-F类抗菌脂肽是一类由多粘类芽胞杆菌通过非核糖体途径合成的缩酚肽类环状多肽。它是由6个氨基酸残基和1个脂肪酸链 (2-胍基-3-羟基十五烷酸,简称GHPD) 组成的环状脂肽类抗生素,对革兰氏阳性细菌特别是金黄葡萄球菌具有显著的杀菌活性,且能有效地抑制串珠镰刀菌、黄曲霉菌等丝状真菌[1-2]。
原生质体融合技术是通过酶解除去微生物的细胞壁,形成由半透性质膜包裹着的原生质体,随后在高渗溶液环境下,借助促融剂或者诱导剂的作用,使2个或以上的种、属间异源的原生质体互相融合,并可以再生出细胞壁以及形成完整的细胞[3]。1974年,Ferenczy等[4]通过离心诱导使白地霉营养缺陷型菌株发生融合。微生物原生质体融合技术是目前细胞工程领域内研究的一大热点,已经广泛应用于育种工作中[5]。
在前期研究中,以多粘类芽胞杆菌JSa-9为亲本,通过亚硝基胍 (NTG) 诱变育种,获得了两株带有组氨酸营养缺陷型标记的突变菌株N1-37和N2-27,该两株突变菌株与原始菌株相比较具有高产LI-F类抗菌肽的优势。本研究拟将该两株突变株作为亲本菌株,采用聚乙二醇 (PEG) 作促融剂,以期筛选出高产LI-F类抗菌脂肽的融合菌株。并采用实时荧光定量PCR技术对融合菌株与原始菌株中LI-F类抗菌肽合成酶关键基因、在转录水平上的差异性表达进行分析。
1 材料与方法
1.1 材料
1.1.1 菌种
多粘类芽胞杆菌JSa-9、N1-37 (Phe–) 和N2-27 (His–),LB斜面培养基30 ℃条件下生长12 h;金黄色葡萄球菌CMCC(B)26003,LB斜面培养基37 ℃条件下生长12 h;串珠镰孢菌ACCC 30174、尖镰孢菌黄瓜专化型f. sp.J.H.Owen,均在PDA斜面培养基上28 ℃条件下生长36 h。
1.1.2 主要试剂
溶菌酶 (Lysozyme),Sigma公司;聚乙二醇 (PEG) 6 000、顺丁烯二酸及其他试剂,国药集团;RNA提取试剂盒、Trizol试剂,上海生物工程股份有限公司;反转录试剂盒PrimeScriptTM RT Reagent Kit (Perfect real time),TaKaRa公司。
1.1.3 培养基与缓冲液
营养琼脂培养基,Landy 培养基,LB培养基,基本培养基,完全培养基,原生质体高渗再生培养基,融合子筛选再生基本培养基,SMM高渗溶液[6],溶菌酶液;PEG6 000溶液:PEG6 000溶解于不同体积SMM高渗溶液配制成不同浓度的PEG6 000溶液,利用5 mol/L HCl 溶液将PEC6 000溶液调至工作pH。
1.2 原生质体融合方法
1.2.1 原生质体的制备
菌株N1-37和N2-27培养至对数后期,参考韩璞等[7]报道的菌体原生质体制备方法进行制备并计算原生质体形成率。
原生质体形成率 (%) = (−) /´100%。
其中,为总菌落数,即溶菌酶处理前NA固体平板上的菌落数;为未原生质体化的菌落数,即溶菌酶处理后NA固体平板上的菌落数。
1.2.2 原生质体的再生
将上述得到的原生质体分别用高渗SMM和无菌水梯度稀释,分别涂布于再生高渗平板和NA固体平板。30 ℃恒温培养1−2 d,进行菌落计数,计算原生质体再生率。
再生率 (%) = (−) / (−)×100。
其中,为酶解后的再生菌落数 (CFU/mL);为未形成原生质体菌落数,即未被酶裂解的剩余细胞数 (CFU/mL);为酶解前的总菌落数 (CFU/mL)。
1.2.3 PEG诱导原生质体融合
参考严蔚东[6]报道的芽胞杆菌融合方法进行PEG诱导原生质体融合,菌落计数后计算原生质体融合率[8]:
融合率 (%) =2/´100。
其中,为融合株数;为加入的原生质体数。
根据原生质体的融合率,研究PEG 6 000浓度、PEG6 000 pH、作用时间对原生质体融合的影响。
1.2.4 融合子发酵液的抑菌活性
再生基本培养基平板上挑取单菌落接种于营养琼脂培养基平板,30 ℃培养48 h后,5 mm打孔器灭菌后于菌落周围打孔,挑取琼脂块平贴在指示菌平板上。指示菌培养条件为:金黄色葡萄球菌接种于LB固体培养基,37 ℃培养12 h;串珠镰孢菌和尖镰孢菌接种于PDA固体培养基,28 ℃培养3 d,选择产生最大抑菌圈所对应的菌株作为初筛菌株。将初筛菌株接种至Landy培养基,30 ℃、180 r/min条件下培养72 h,4 ℃、12 000 r/min离心20 min。取上清液50 μL采用琼脂板打孔加样法,测定菌液上清的抑菌活性。
1.2.5 融合子产LI-F类抗菌脂肽产量测定
融合子Landy发酵液12 000 r/min离心20 min,取上清,按1∶1比例加入乙酸乙酯,振荡混匀,于分液漏斗中静置过夜。分取上层有机相,下层水相以相同的方法进行二次萃取。两次得到的有机相50−55 ℃旋蒸至干燥,以发酵液与甲醇50∶1 (/) 的比例加入甲醇复溶,离心取上清,0.45 µm滤膜过滤后,经高效液相色谱检测[9]。
1.2.6 遗传稳定性实验
将筛选的融合子连续传代10代并进行液体摇瓶发酵,提取LI-F类抗菌脂肽并进行HPLC测定 (方法同1.2.5),考察突变菌株的遗传稳定性。
1.3 融合菌株脂肽合成酶基因表达分析
参照GenBank多粘类芽胞杆菌E681[10]LI-F类抗菌脂肽合成酶基因基因序列,利用Primer premier 5软件设计引物序列(表1)。
通过Trizol法提取菌体RNA,将所得到的 RNA 溶液置于–70℃保存或用于后续试验。采用SYBRExScriptTMRT-PCRKit(Perfectrealtime)(TaKaRa)试剂盒进行荧光定量实验。RT-PCR程序为:95 ℃ 30 s,预变性;95 ℃5 s,变性;60 ℃30 s,复性;40个循环。
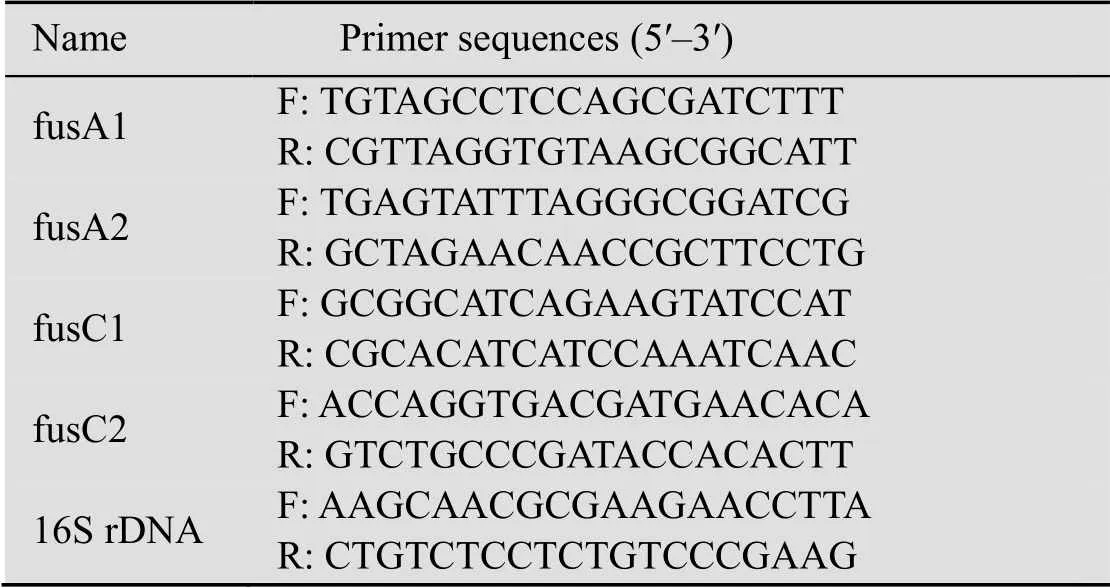
表1 LI-F类抗菌肽关键合成基因引物设计
2 结果与分析
2.1 菌株N1-37原生质体制备和再生条件的选择
如表2所示,溶菌酶浓度为0.1 mg/mL时再生率明显高于0.2 mg/mL试验组。溶菌酶作用7 min时,原生质体再生率最高。结果表明,采用0.1 mg/mL溶菌酶,37 ℃下处理7 min可获得100%的原生质体,再生率分别达到39.52%和31.92%。
2.2 最佳融合条件的选择
影响原生质体融合的因素很多,根据文献[11],初始实验条件定为pH 9.0,作用时间10 min。
根据文献报道[12],PEG的浓度在30%−50% (/) 更有利于融合。由表3可知,PEG6 000浓度为40%时,融合率达到最大值。当PEG6 000浓度为30%时,浓度较低,不利于双亲原生质体进行充分接触进而融合。PEG6 000浓度为50%时,溶液过于粘稠,同时可能对原生质体产生毒害作用,影响融合率[13]。PEG6 000溶液pH为9.0时,融合率高于pH 7.0和pH 8.0试验组,与相关文献报道一致[14]。融合时间从10 min到20 min,在15 min时,融合率达到最大,之后开始迅速下降。可能是作用时间延长,PEG对原生质体产生毒性,导致部分融合子死亡,融合率下降。因此,融合结束后应立即对溶液进行稀释并离心去除PEG。
综上所述,进行原生质体融合的最佳条件为:PEG6 000浓度为40%,最佳pH值为9.0,最佳融合时间为15 min。
2.3 融合子发酵液抑菌活性及LI-F类抗菌肽含量的测定
经过初筛和复筛,得到一株抗菌物质产量提高的融合子,命名为F5-15,其发酵液对3种指示菌的抑菌效果见图1和表4,经融合获得融合子F5-15发酵液对3种指示菌的抑制效果显著高于野生菌株JSa-9、亲本菌株N1-37和N2-27。
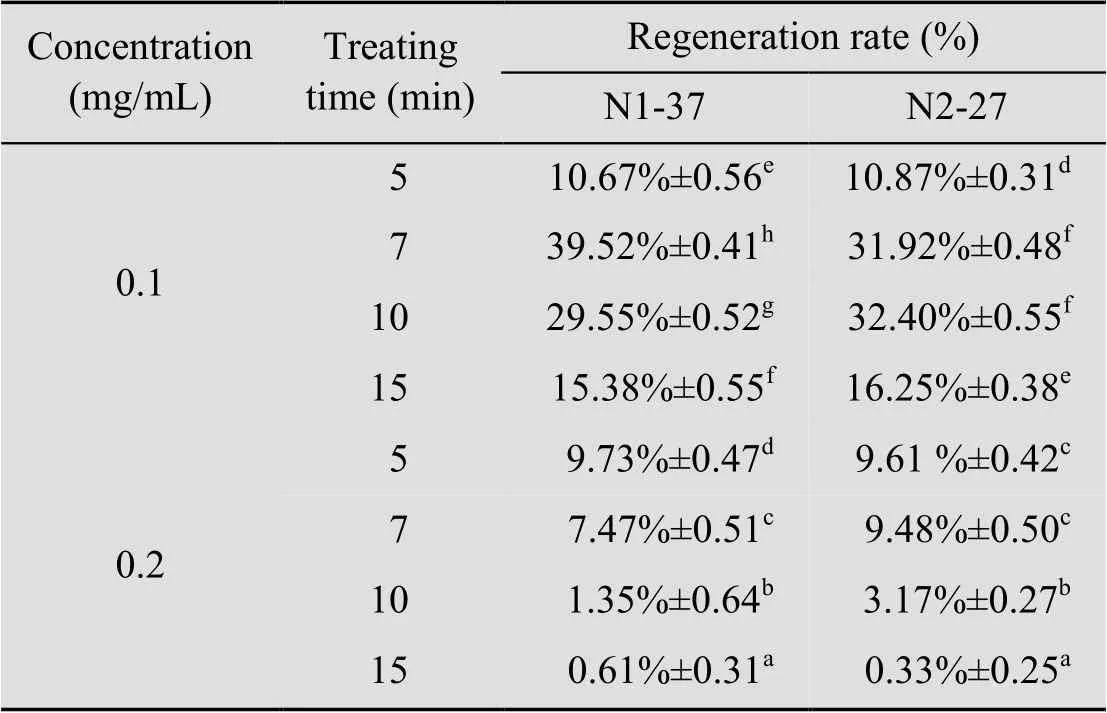
表2 不同酶浓度和酶解时间的组合对N1-37、N2-27原生质体再生率的影响
Note: marked with different letters indicate significant difference (<0.05).
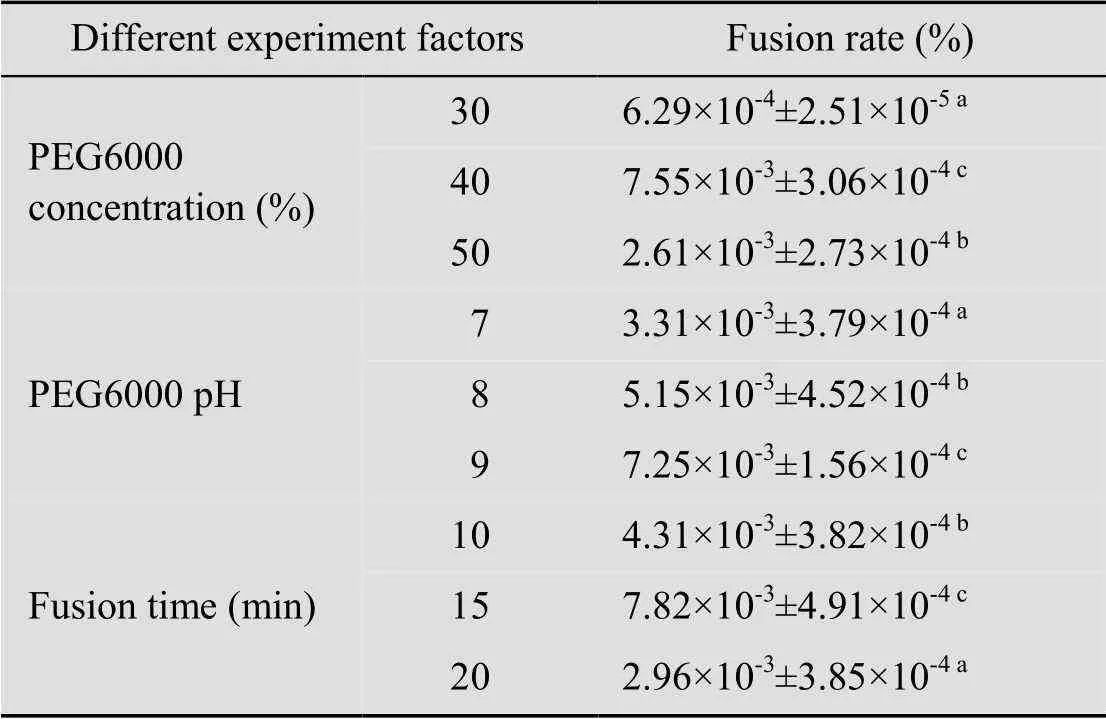
表3 不同试验因素对融合率的影响
Note: marked with different letters indicate significant difference (<0.05).
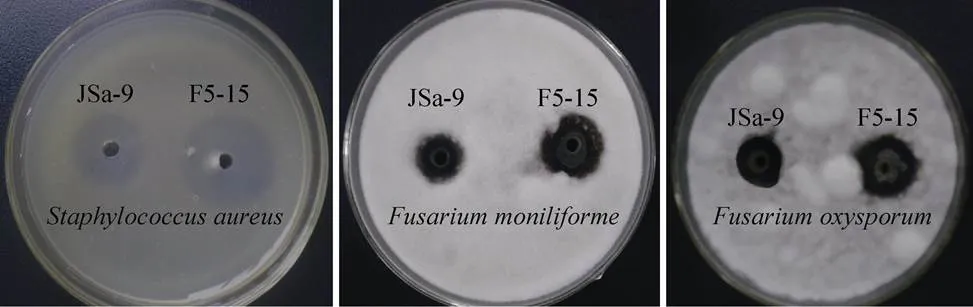
图1 融合子F5-15发酵液对指示菌的抑制效果
将融合子F5-15与亲本菌株以及野生型菌株经发酵后提取LI-F类抗菌肽。经检测,以上4株菌LI-F类抗菌肽产量分别为:88.251、50.37、123.83和273.68 mg/L。由此可见,F5-15发酵液产LI-F类抗菌脂肽的产量为野生菌JSa-9的3.1倍,为亲本菌株N1-37和N2-27的1.82倍和2.21倍,具有较高的应用价值。
2.4 融合子F5-15传代遗传稳定性实验结果
融合子F5-15传10代培养的结果如图2所示, LI-F类抗菌脂肽的产量波动较小,表明经筛选得到的融合菌株具有优良的遗传稳定性,可作为工业化生产菌株应用。
2.5 反转录合成cDNA作为模板扩增目的基因
细菌RNA中70%−80%为rRNA,提取得到的RNA琼脂糖凝胶电泳结果见图3A,5S rRNA、 16S rRNA及23S rRNA 三条带清晰明亮,可以确定RNA的完整性是好的。用260/280(Ratio,R)来确定所提取RNA的纯度,实验测定=1.93,说明所提取的RNA纯度较高,可以用于下一步反转录合成cDNA模板用。

表4 融合子F5-15发酵液对指示菌的抑制效果
Note: marked with different letters indicate significant difference (<0.05).
将所提取的RNA进行反转录合成cDNA,并将其作为模板对4个目的基因进行PCR扩增,电泳图谱如图3B所示,cDNA作为模板扩增出4个靶基因条带单一清晰,说明合成的cDNA可以作为模板进行实时荧光定量PCR检测。

图2 突变菌株传代稳定性
2.6 样本中靶基因的相对定量
对原始菌株JSa-9和融合菌株F5-15中的 16S rDNA和目的基因、、、进行实时定量PCR扩增,选取16S rDNA 作为内参基因用于校对目的进行ΔΔCT分析,结果见表5。结果显示、、、在融合菌株F5-15中的表达分别为其在原始菌株JSa-9中表达量的10.48、2.48、2.1和11.8倍。LI-F类脂肽合成酶基因转录水平的变化与脂肽产量的变化一致。说明原生质体融合导致LI-F类脂肽合成的关键酶基因、、、在转录水平表达量 提高。
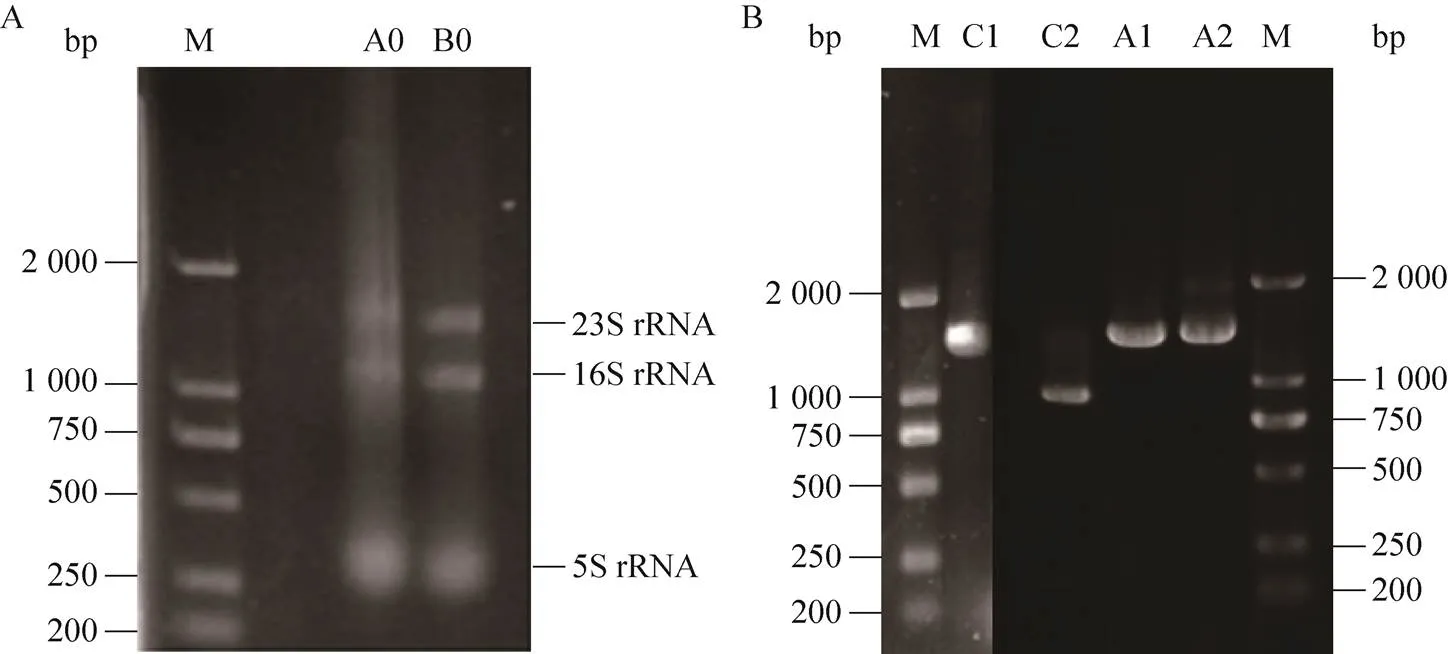
图3 多粘类芽胞杆菌RNA (A)和C2 cDNA作为模板扩增靶基因序列(B)电泳图谱
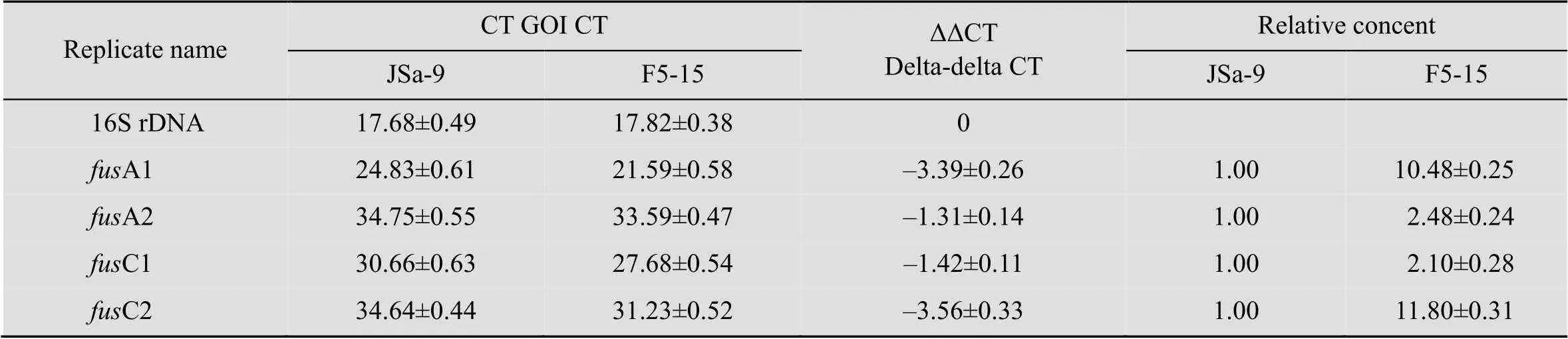
表4 多粘类芽胞杆菌融合菌株与原始菌株的ΔΔCT相对定量分析
3 讨论
原生质体融合技术在微生物育种中占有重要的地位,该技术发展于20世纪70年代,具有很多优点,如能够完整地传递遗传物质、有较高的重组频率等,因此发展迅速、应用广泛,尤其在提高代谢产物产量和改良菌种遗传性状方面,发挥着重要 作用[15]。
在原生质体制备、再生和融合过程中,有多重因素影响着每个环节。相关文献[16]报道,在实验过程中大多采用对数生长期或生长中后期的菌株,此时细胞壁中肽聚糖含量最低,细胞对溶菌酶作用最敏感,有利于原生质体的形成。制备原生质体的最大障碍是细胞壁的存在,通过适当的酶处理,除去细胞壁是关键步骤之一[17]。由于不同微生物细胞壁组成成分的差异,制备原生质体所用酶种类、浓度以及酶解时间大不相同。陈海昌等[18]认为在一定范围内,酶浓度和酶解时间都与原生质体的形成率成正相关,而当提高酶浓度以及酶作用时间时,原生质体再生率显著下降,与本研究结果相符合。在融合过程,受到很多种因素影响,如PEG的分子量、浓度、pH、融合时间等[19]。融合中PEG浓度需要控制在适宜范围之内,浓度过低会导致原生质体破裂,浓度过高则对原生质体毒害加大。PEG融合时间也不宜过长,否则会导致原生质体失活。
SYBR GreenⅠ方法是一种常用的荧光标记方法。由于SYBR GreenⅠ能与所有的双链 DNA相结合,所以通用性相当好,并且相对探针来说价格低廉,因此在科研中使用比较普遍。但是,也恰恰由于它没有特异性,只要是和双链结合就会发光,因此对PCR反应中的引物二聚体或者非特异性扩增也会产生荧光,结果可能会发生假阳性[20-21]。所以在引物设计时应特别注意,以避免非特异性扩增的发生。在本研究中采用SYBR Green I检测方法,30个循环内没有非特异性产物扩增,35个循环内无引物二聚体产生,从而可以确定荧光定量PCR反应的有效性。2-ΔΔCT法分析结果显示该LI-F脂肽合成酶基因转录水平的变化与脂肽产量的变化一致。
综上所述,本文对多粘类芽胞杆菌原生质体的制备、再生、融合及表达进行了研究。结果表明原生质体融合导致脂肽合成的关键酶基因在转录水平表达量提高,LI-F类抗菌肽产量增加。这一结果为研究多粘类芽胞杆菌产LI-F类脂肽的高产菌株的选育,以及为其他种类工业微生物菌种改良等方面提供了技术参考。
[1] Kurusu K, Ohba K. New peptide antibiotics LI-F03, F04, F05, F07 and F08, produced byI. Isolation and characterization. J Antibiot (Tokyo), 1987, 40(11): 1506−1514.
[2] Kuroda J, Fukai T, Konishi M, et al. LI-F antibiotics, a family of antifungal cyclic depsipeptides produced byL-1129. Heterocycles, 2000, 53(7): 1533−1549.
[3] Gu YZ, Gao RY. Progress on technique and application of protoplast culture. Henan Agri, 2008, 7(14): 51−52 (in Chinese).谷延泽, 高瑞彦. 原生质体培养技术的发展及应用. 河南农业, 2008, 7(14): 51−52.
[4] Ferenczy L, Kevei F, Zsolt J. Fusion of fungal protoplasts. 1974, 248: 793−794.
[5] Yu JX, Li JH, Pang Y. The study on the technique for protoplast fusion of bacillus. Biotechnology, 2000, 10(3): 45−47 (in Chinese).余建秀, 李建华, 庞义. 芽胞杆菌原生质体融合技术. 生物技术, 2000, 10(3): 45−47.
[6] Yan WD. Screening of higher lipopeptides producing strains by inactivated protoplast fusion[D]. Nanjing: Nanjing Agriculture University, 2009 (in Chinese).严蔚东. 应用灭火原生质体融合法选育抗菌脂肽高产菌株[D]. 南京: 南京农业大学, 2009.
[7] Han P, Tian HT, Yuan SQ. Studies on protoplasts preparation and regeneration condition of. J Chin Instit Food Sci Technol, 2010, 10(1): 10−18 (in Chinese).韩璞, 田洪涛, 苑社强, 等. 罗伊氏乳杆菌原生质体的制备与再生条件的研究. 中国食品学报, 2010, 10(1): 10−18.
[8] Chen H, Hu YH, Qin JZ, et al. Study on conditions of canoderma protoplasts fusion. Food Sci, 2007, 28(2): 173−176 (in Chinese).陈合, 胡云红, 秦俊哲, 等. 灵芝菌原生质体融合条件研究. 食品科学, 2007, 28(2): 173−176.
[9] Deng Y, Lu Z, Bi H, et al. Isolation and characterization of peptide antibiotics LI-F04 and polymyxin B produced bystrain JSa-9. Peptides, 2011, 32(9): 1917−1923.
[10] Kim JF, Jeong H, Park SY, et al. Genome sequence of the polymyxin-producing plant-probiotic rhizobacteriumE681. J Bacteriol, 2010, 192(22): 6103−6104.
[11] Zhou HX. Screening of α-ALDC-higher-producing strains by inactivated protoplast fusion[D]. Baoding: Hebei University, 2004 (in Chinese).周海霞. 灭活原生质体融合选育α-ALDC高产菌株[D]. 保定: 河北大学, 2004.
[12] Akamatsu T, Taguchi H. Incorporation of the whole chromosomal DNA in protoplast lysates into competent cells of. Biosci Biotechnol Biochem, 2001, 65(4): 823−829.
[13] Jin Z, Xu B, Lin S, et al. Enhanced production of spinosad inby genome shuffling. Appl Biochem Biotechnol, 2009, 159(3): 655−663.
[14] Zhou HX, Min ZR, Zhang SF. Protoplast fusion ofproduced α-ALDC. J Hebei Univ, 2004, 24(3): 288−292 (in Chinese).周海霞, 阚振荣, 张双凤. 产α-ALDC的枯草芽胞杆菌原生质体融合条件. 河北大学学报, 2004, 24(3): 288−292.
[15] Wang DY, Zang W, Sun JQ, et al. Application of bacteria protoplast fusion technique in genetic breeding. China Brewing, 2008, 7(4): 1−6 (in Chinese).王登宇, 臧威, 孙剑秋, 等. 细菌原生质体融合育种技术及其应用进展. 中国酿造, 2008, 7(4): 1−6.
[16] Mo JY, Chen XZ, Wang ZX, et al. Preparation, regeneration and genetic transformation ofprotoplasts. Biotechnology, 2009, 19(5): 75−77 (in Chinese).莫静燕, 陈献忠, 王正祥, 等. 地衣芽胞杆菌原生质体的制备、再生及转化研究. 生物技术, 2009, 19(5): 75−77.
[17] Gong J, Zheng H, Wu Z, et al. Genome shuffling: progress and applications for phenotype improvement. Biotechnol Adv, 2009, 27(6): 996−1005.
[18] Chen HC, Tang Y, Zhang LH, et al. The study on improvement of beer yeast flocculation by the technology of protoplast fusion. Microbiol China, 1994, 21(4): 213−217 (in Chinese).陈海昌, 唐屹, 张岭花, 等. 原生质体融合技术提高啤酒酵母凝絮性的研究. 微生物学通报, 1994, 21(4): 213−217.
[19] Hopwood DA, Wright HM. Bacterial protoplast fusion: recombination in fused protoplasts of. Mol General Genetics, 1978, 162(3): 307−317.
[20] Ponchel F, Toomes C, Bransfield K, et al. Real-time PCR based on SYBR-Green I fluorescence: an alternative to the TaqMan assay for a relative quantification of gene rearrangements, gene amplifications and micro gene deletions. BMC Biotechnol, 2003, 3(1): 18.
[21] Simpson DAC, Feeney S, Boyle C, et al. Technical brief: retinal VEGF mRNA measured by SYBR Green I fluorescence: a versatile approach to quantitative PCR. Mol Vis, 2000, 6: 178−183.
(本文责编 郝丽芳)
Breeding of high-producing LI-F lipopeptideby protoplast fusion and differential expression analysis of fusion strains
Dong Yan, Jinzhi Han, Xiaomei Bie, Zhaoxin Lu, Fengxia Lü, Haizhen Zhao, and Chong Zhang
College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, Jiangsu, China
Auxotrophic strains of N1-37 (Phe–) and N2-27 (His–), screened from mutations ofJSa-9 previously, were used as the parent strains to screen high-producing LI-F antibacterial lipopeptide fusion strain through protoplast fusion with polyethylene glycol as a promote agent. Fusion strain F5-15 was obtained. Then the product of LI-F antibacterial lipopeptide was quantified by HPLC, and the difference of expression of the key genes of lipopeptide synthase between wild strain JSa-9 and the fusion strain was analyzed by real-time PCR. LI-F antibacterial lipopeptide yield of the fusion strain F5-15 was 3.1-fold of the original strain JSa9’s, and the expression levels of the target genes were 10.48, 2.48, 2.1 and 11.8 fold of the initial strain JSa-9, respectively.
protoplast preparation, protoplast fusion, real-time PCR
10.13345/j.cjb.140564
November 19, 2014; Accepted: March 9, 2015
National Natural Science Foundation of China (No. 31271828), Key Technologies Research and Development Program of China (No. 2011BAD23B05).
Xiaomei Bie. Tel: +86-25-84396570; E-mail: bxm43@njau.edu.cn
国家自然科学基金 (No. 31271828), 国家科技支撑计划 (No. 2011BAD23B05) 资助。
