Bacillus amyloliquefaciens C-1 胞外抑菌脂肽的分离与鉴定
2015-01-11徐兴科胡森科张瑞娟
吕 佳,徐兴科,胡森科,张瑞娟,韩 蓓*
1 西安交通大学医学部公共卫生学院;2 陕西省营养与食品安全工程研究中心,西安 710061
食源性致病菌是导致微生物性食物中毒的一类病原菌,对食源性致病菌的控制是食品工业防腐方向的一个重点,针对食源性致病菌的高效生物防腐剂研究成为了当前的热点之一。芽孢杆菌可以产生许多种抗菌物质,包括肽类、细菌素、脂肽类等,其中肽类和脂肽类具有较高的生物工程利用价值[1-3]。Sutyak 等从酸奶厂的益生菌乳制品中分离出一株解淀粉芽孢杆菌,其培养物上清对李斯特菌、阴道加德纳菌和无乳链球菌有抑制效果,其有效抑菌物质为细菌素[4]。Romano 等从解淀粉芽孢杆菌BO5A 中分离出2 种环状脂肽,其对真菌Fusarium xoysporum、Aspergillus niger、Botrytis cinerea、Penicillium italicum、Trichoderma harzianum 等具有显著的抑制作用[5]。脂肽类物质是枯草芽孢杆菌产生的主要抗菌物质之一,但是研究解淀粉芽孢杆菌产生脂肽类抑菌物质的报道不多。
本实验室从即食水果果盘上分离出一株解淀粉芽孢杆菌,命名为C-1,其在发酵过程中能产生大量的胞外多糖(Exopolysaccharides,EPS),该菌现保存于中国典型培养物保藏中心(编号M2012177)。C-1 的胞外多糖具有高的抗氧化活性,同时具有抑制人肿瘤细胞生长并诱导其凋亡的活性[6]。同时B.amyloliquefaciens C-1 的发酵液上清具有显著的抑菌活性,但是该抑菌活性与胞外多糖无关[7]。
基于此,本实验初步推测其胞外抑菌物质可能为蛋白类或多肽类物质。为了进一步分析与鉴定B.amyloliquefaciens C-1 发酵上清液中的抑菌物质,本研究从C-1 上清中分离出了粗脂肽,并对其是否具有抑菌活性、对不同测试菌的抑菌活性、抑菌活性的稳定性分别进行了研究,结果显示B.amyloliquefaciens C-1 胞外抑菌活性物质为脂肽,且其抑菌活性非常稳定,具有潜在的开发应用价值。
1 材料与方法
1.1 菌株及培养基
本实验以Bacillus amyloliquefaciens C-1(本实验室自行分离保藏)为生产菌株。蜡样芽孢杆菌(Bacillus cereus MS10362R,产黑色素)为中国科学院武汉病毒研究所袁志明研究员惠赠;大肠杆菌O157∶H7 CDC157 来源于西安市疾控中心;蜡样芽孢杆菌(Bacillus cereus CMCC63301)购自于中国医学微生物菌种保藏管理中心,这3 株细菌为抑菌试验的测试菌株。
液体培养基采用LB 培养基,配方为:蛋白胨10 g/L、氯化钠10 g/L、酵母粉5 g/L;固体平板采用LB固体培养基,配方为:蛋白胨10 g/L、氯化钠10 g/L、酵母粉5 g/L,琼脂1.5%。B.amyloliquefaciens C-1发酵培养基,配方为:蛋白胨10 g/L、氯化钠10 g/L、酵母粉5 g/L、葡萄糖1%。
1.2 试剂
冰乙酸、考马斯亮蓝G250、Tris-HCl、TEMED、甲醇、乙腈、丙酮、10%胰蛋白酶(使用浓度为0.1%)、4%胃蛋白酶(使用浓度为0.1%)、2%蛋白酶K(使用浓度为0.1%)、0.5 mol/L NaOH、0.5 mol/L HCl、30 mg/mL 卡那霉素(使用浓度为30 μg/mL),14 mg/mL 四环素(使用浓度为14 μg/mL)。所用试剂均为分析纯。
1.3 B.amyloliquefaciens C-1 胞外脂肽类活性物质的提取与定性检测
接种环取C-1 单菌落至3 mL LB 液体培养基,30 ℃、200 rpm 恒温摇床中培养过夜;次日按1%量转接至50 mL LB 培养基中,30 ℃、200 rpm 恒温摇床中培养5 h,按1%量转接至多份150 mL LB 培养基中,30 ℃、200 rpm 恒温箱中培养96 h。4 ℃,10000 rpm 离心取上清液。上清液用6 M 盐酸调节pH 值至2.0,混匀后4 ℃静置24 h,4 ℃10000 rpm离心收集沉淀,冷冻干燥后为粗提活性物质[8]。
利用三重四极杆液质联用仪(ABI,API3200 LC-20A)对C-1 菌株发酵液上清粗提活性物质进行高效液相色谱-质谱联用的定性检测,初步确定提取物的主要成分。
1.4 B.amyloliquefaciens C-1 胞外脂肽的抑菌活性
1.4.1 平板法抑菌试验
以革兰氏阳性细菌蜡样芽孢杆菌B.cereus CMCC63301、产黑色素腊样芽孢杆菌 B.cereus MS10362R 和大肠杆菌E.coli O157∶H7 CDC157 作为测试菌,在直径约15 cm 平板倾倒固体培养基厚约6 mm,冷却后均匀打孔5 个,孔径6 mm,其中包含阳性对照孔一个(敏感抗生素,大肠杆菌使用30 μg/mL 卡那霉素,蜡状芽孢杆菌使用14 μg/mL 四环素),阴性对照孔一个(等体积的LB 液体培养基),实验组孔3 个,分别加入10 mg/mL C-1 脂肽溶液200 μL、分离脂肽前的发酵液上清200 μL、分离脂肽后的发酵液上清200 μL(表1 中为“去脂肽上清”,为酸沉淀脂肽后的上清,pH 与发酵液上清调节为一致),抑菌活性以抑菌圈直径表示。
1.4.2 生长曲线法抑菌试验
B.cereus CMCC63301、B.cereus MS10362R 和E.coli O157∶H7 CDC157 作为测试菌,过夜培养,培养液用LB 液体培养基稀释至1%,取2 mL 分别置入24 孔板中,每孔加入20 μL 10 mg/mL 脂肽溶液,混匀,加入20 μL 无菌水的孔作为阴性对照。酶标仪测定初始的OD600。将24 孔板分别置于30 ℃(蜡样芽孢杆菌)、37 ℃(大肠杆菌)培养6 h,每小时测定一次OD600,观察脂肽对病原菌生长的抑制作用,并绘制抑制曲线,计算加入脂肽后培养6 h 的抑制率。
抑制率=1-(B2-B0)/(A2-A0)×100%
式中,A 为阴性对照组OD600,A0 为0 h 数据,A2 为6 h 数据;B 为添加脂肽的处理组OD600,B0 为0 h 数据,B2 为6 h 数据。
1.5 B.amyloliquefaciens C-1 胞外脂肽的稳定性
10 mg/mL 脂肽溶液分别置于50、80、120 ℃下处理30 min,处理后放于室温,对处理后的脂肽溶液进行1.4.2 的抑菌活性测定实验,以B.cereus CMCC63301、B.cereus MS10362R 和E.coli O157∶H7 CDC157 作为测试菌,以未处理的脂肽为阳性对照。绘制抑制曲线,并计算培养6 h 后的抑制率。
10 mg/mL 脂肽溶液分别用0.1% 胰蛋白酶、0.1%胃蛋白酶、0.1%蛋白酶K 处理,37 ℃孵育1 h,对经过不同蛋白酶处理后的脂肽溶液进行1.4.2的抑菌活性测定实验,以B.cereus CMCC63301、B.cereus MS10362R 和E.coli O157∶H7 CDC157 作为测试菌,以未处理的脂肽为阳性对照。绘制抑制曲线,并计算培养6 h 后的抑制率。
分别用甲醇、乙腈、丙酮溶解脂肽,配成10 mg/mL 脂肽溶液,对处理后的脂肽溶液进行1.4.2 的抑菌活性测定实验,以B.cereus CMCC63301、B.cereus MS10362R 和E.coli O157∶H7 CDC157 作为测试菌,以未处理的脂肽为阳性对照,计算培养6 h 后的抑制率。
2 实验结果
2.1 B.amyloliquefaciens C-1 胞外脂肽类活性物质的提取与定性检测
C-1 菌株在LB+1%葡萄糖液体培养基中30℃震荡培养60 h,培养液离心取上清,用HCl、NaOH分别调节C-1 上清至pH=2、4、6、8、10。在调节pH时,当溶液的pH 达到3 左右,开始出现沉淀,溶液变得浑浊,继续调节pH 至2,沉淀完全,溶液变的较为澄清。放置于4 ℃冰箱中24 h。10000 rpm,4 ℃离心获得胞外活性物质沉淀和去沉淀的上清液,胞外活性物质沉淀经过冻干获得干粉,产量为1.2 g/L。
将菌株C-1 发酵液上清的粗提物进行高效液相色谱-质谱联用分析,经过质谱结果确定HPLC 分析得到的主要物质峰属于伊枯草菌素同系物,为分子量相差14 Da(CH2)的代谢同系物。胞外脂肽类粗提物的质谱图结果显示其实测值分别为1045.5、1065.3、1067.1、1080.6 Da,分别与脂肽类抗生素C14-C17 Iturin A 的分子量的理论预测值1042.54、1056.55、1070.57、1084.61Da 相吻合[10-14]。其中以分子量为1065.3 Da 的伊枯草菌素代谢同系物的含量最高。从质谱图上可以初步确定该提取物为脂肽类伊枯草菌素同系物。
2.2 解淀粉芽孢杆菌B.amyloliquefaciens C-1 脂肽的抑菌作用
2.2.1 C-1 脂肽的平板抑菌试验
根据1.4.1 的设计进行平板抑菌试验,用牛津杯法分别定性B.amyloliquefaciens C-1 发酵上清液、重溶的粗脂肽和分离脂肽后的发酵液上清液对蜡样芽孢杆菌MS10362R、蜡样芽孢杆菌CMCC63301 和大肠杆菌O157∶H7 的抑菌活性。得到如表1 的抑菌结果。阳性对照为敏感抗生素,阴性对照为空白培养基,脂肽浓度为10 mg/mL,加样量均为200 μL。

表1 C-1 上清液的平板抑菌试验结果(n=3)Table 1 Results of antibacterial activity of C-1 supernatant(n=3)
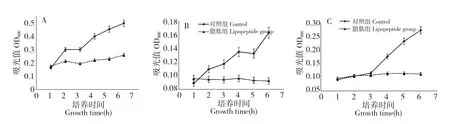
图1 在C-1 脂肽抑制作用下的B.cereus CMCC63301(A)、B.cereus MS10362R(B)、E.coliO157∶H7 CDC157(C)生长曲线图Fig.1 Growth curves of B.cereus CMCC63301(A),B.cereus MS10362R(B)and E.coli O157∶H7 CDC157(C)treated by C-1 lipopeptide
由该表数据得知,C-1 发酵上清液具有一定的抑菌活性,当将脂肽类物质分离后,余下的上清不具有抑菌效果,而抑菌效果集中体现在分离出的的活性脂肽类物质中。
2.2.2 测试菌在C-1 脂肽作用下的生长曲线
以B.cereus CMCC63301、产 黑 色 素B.cereus MS10362R、E.coli O157∶H7 CDC157 作为测试菌,进行生长曲线试验。在24 孔板中加入培养基2 mL 并接种,根据平板抑菌实验结果,加入10 mg/mL 脂肽溶液20 μL,使用酶标仪测定6 h 内脂肽作用下的细菌生长曲线,结果如图1。
图1 中对照组和脂肽处理组生长曲线有非常显著的差异,表明B.amyloliquefaciens C-1 脂肽溶液对于测试细菌的生长具有抑制作用。其中C-1 脂肽对B.cereus MS10362R 和E.coli O157∶H7 CDC157 的抑制作用特别明显,从开始接种到6 h 测定结束,这两株菌的生长抑制率分别稳定的保持在96%、93%,并且脂肽可以抑制B.cereus MS10362R 产黑色素。脂肽对B.cereus CMCC63301 的6h 生长抑制率为75%。

图2 C-1 脂肽在不同温度处理下对B.cereus CMCC63301(A)、B.cereus MS10362R(B)及E.coliO157∶H7 CDC157(C)的抑制活性Fig.2 Inhibition effect of C-1 lipopeptide with different treatment temperatures on the growth curve of B.cereus CMCC63301(A),B.cereus MS10362R(B)and E.coli O157∶H7 CDC157(C)
2.3 解淀粉芽孢杆菌B.amyloliquefaciens C-1 脂肽的稳定性
2.3.1 温度处理对C-1 脂肽抑菌活性的影响
为了验证C-1 抑菌脂肽对温度的敏感性,对其分别进行了50、80、120 ℃的处理,处理后的B.amyloliquefaciens C-1 脂肽溶液对受试菌进行抑菌活性试验,分析数据绘制折线图并计算其抑菌率,如图2、表2 所示。C-1 脂肽的抑菌活性并未受到高温的影响,其抑菌活性基本维持在处理前的94%~97%。
2.3.2 蛋白酶处理对C-1 脂肽抑菌活性的影响
用4%胃蛋白酶、10%胰蛋白酶和2%蛋白酶K(使用浓度为0.1%)于37 ℃处理C-1 脂肽溶液1 h后,进行抑菌活性试验,计算抑菌率。分析数据说明经蛋白酶处理过C-1 脂肽仍然具有抑菌活性,抑菌活性几乎不受影响,保持在原有活性的90%以上。结果见图3、表2。
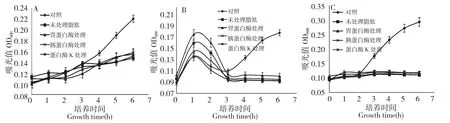
图3 C-1 脂肽在不同蛋白酶处理下对B.cereus CMCC63301(A)、B.cereus MS10362R(B)及E.coliO157∶H7 CDC157(C)的抑制活性Fig.3 Inhibition effect of C-1 lipopeptide with different protease treatment on the growth curve of B.cereus CMCC63301(A),B.cereus MS10362R(B)and E.coli O157∶H7 CDC157(C)
2.3.3 有机溶剂处理对C-1 脂肽抑菌活性的影响
分别用甲醇、乙腈、丙酮溶解脂肽,配成10 mg/mL 脂肽溶液,对处理后的脂肽溶液进行抑菌活性试验,分别计算C-1 脂肽对3 种测试菌株培养6 h 后的抑菌率。分析数据说明有机溶剂对C-1 脂肽的抑菌活性几乎没有影响,有机溶剂处理后的脂肽仍具有抑菌活性,并且可以保持原有活性的90%以上,结果见表2。
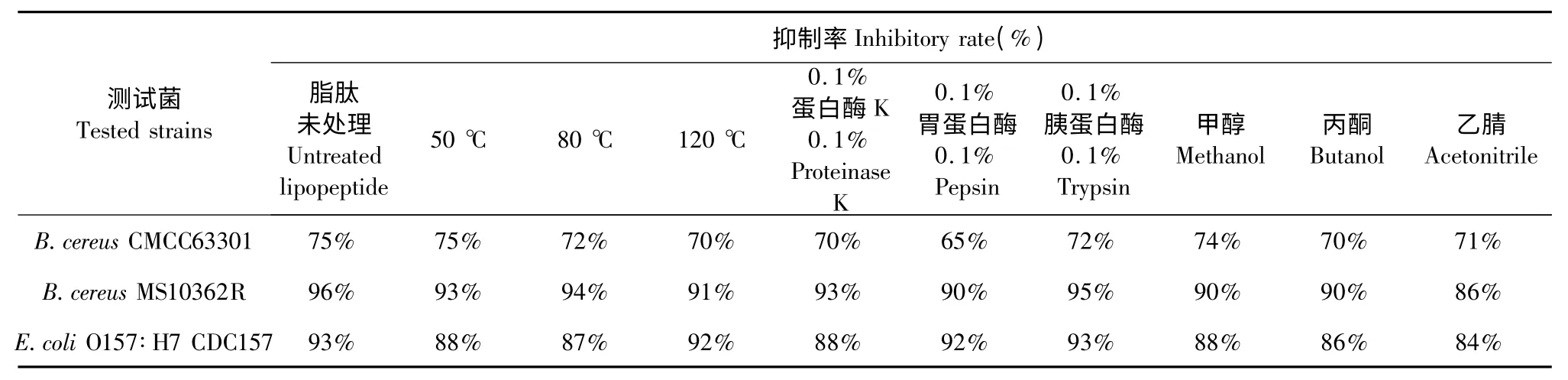
表2 不同处理的B.amyloliquefaciens C-1 脂肽对B.cereus CMCC63301、B.cereus MS10362R、E.coli O157∶H7 CDC157 生长的抑制率Table 2 Inhibition rate of C-1 lipopeptide with different treatments on the growth of B.cereus CMCC63301,B.cereus MS10362R and E.coli O157∶H7 CDC157
3 讨论与结论
解淀粉芽孢杆菌分布广泛,菌种资源丰富,代谢产物种类丰富,具有广泛的细菌真菌抑菌活性,但由于分离株众多,抑菌谱不一,发酵效率一般,某些代谢产物低毒性[9](尚无致病性报道)等原因,还没有得到广泛的应用,随着代谢工程的发展,解淀粉芽孢杆菌的发酵效率,毒性产物与抑菌活性等能得到很好的调和,其在生物防治方面的应用可行性将得到很好的提升。
本实验室自行分离的B.amyloliquefaciens C-1菌株发酵液上清具有一定的抑菌活性,并且从发酵液上清中分离除了具有抑菌活性的粗脂肽。该脂肽对食源性致病菌有较强抑菌活性,0.1 mg/mL 的脂肽对指示菌产黑色素B.cereus MS10362R、B.cereus CMCC63301 和E.coli O157∶H7 CDC157 的6h 生长抑制率分别96%、75%、93%;同时该脂肽性质稳定,在不同温度处理、蛋白酶处理和有机溶剂处理后均可保持较强的抑菌活性,均可保持原有活性的90%以上,抑菌活性非常稳定,具有很好的开发应用潜力。与已报道的脂肽相比,其不具有拮抗真菌的作用(结果未显示)[5,10]。这可能与其结构有关,目前已知的脂肽类物质有表面活性素(Surfactin)[11]、芬荠素(Fengycin)[12]、制磷脂菌素(Plipastatin)[13]、伊枯草菌素(Iturins)[14]等。目前已知表面活性素具有抑制细菌的功能,不具有抑真菌的活性。而C-1 粗提脂肽经过高效液相色谱-质谱联用检测,发现只有1 组较集中的物质峰,预测分子量与伊枯草菌素较为接近。但是该脂肽为混合物,需经过进一步纯化才可确定分子组成。因此C-1 的脂肽有可能是新的具有抑制细菌活性的伊枯草菌素,也可能是和伊枯草菌素分子量差异不大的新型脂肽类抗生素。
另外,实验所用的细菌为食源性致病菌[7],与之前报道的解淀粉芽孢杆菌脂肽类物质作为生物防治活性物质不同,这提示我们C-1 脂肽可作为潜在的生物型防腐剂应用于食品生产过程,延缓微生物生长,延长食品的货架期,具有较好的应用前景。
1 Caldeira AT,Santos Arteiro JM,Coelho AV,et al.Combined use of LC-ESI-MS and antifungal tests for rapid identification of bioactive lipopeptides produced by Bacillus amyloliquefaciens CCMI 1051.Proc Biochem,2011,46:1738-1746.
2 Yu GY,Sinclair JB,Hartman GL,et al.Production of iturin A by Bacillus amyloliquefaciens suppressing Rhizoctonia solani.Soil Biol Biochem,2002,34:955-963.
3 Chen XH,Koumoutsi A,Scholz R,et al.Genome analysis of Bacillus amyloliquefaciens FZB42 reveals its potential for biocontrol of plant pathogens.J Biotechnol,2009,140:27-37.
4 Sutyak KE,Wirawan RE,Aroutcheva AA,et al.Isolation of the Bacillus subtilis antimicrobial peptide subtilosin from the dairy product-derived Bacillus amyloliquefaciens.J Appl Microbiol,2008,104:1067-1074.
5 Romano A,Vitullo D,Senatore M,et al.Antifungal cyclic lipopeptides from Bacillus amyloliquefaciens Strain BO5A.J Nat Prod,2013,76:2019-2025.
6 Luo WJ,Wan Y,Zhang RJ,et al.Evaluation the antitumor effects of exopolysaccharide produced by newly isolated Bacillus amyloliquefaciens strain C-1.J Pure Appl Microbiol,2014,8:469-474.
7 Zhou WJ(周文杰),Yang J(杨建),Wan Y(万茵),et al.Antimicrobial activity on Food-Borne pathogens of extracellular fermented products from Bacillus amyloliquefaciens C-1.Nat Prod Res Dev(天然产物研究与开发),2014,26:123-127.
8 Benitez LB,Velho RV,Lisboa MP,et al.Isolation and characterization of antifungal peptides produced by Bacillus amyloliquefaciens LBM5006.J Microbiol,2010,48:791-797.
9 Huang HX(黄虎翔),Zhang WM(张万民).Prevalence and toxic effect of Bacillus amyloliquefaciens.Int J Lab Med(国际检验医学杂志),2010,31:243-244.
10 Wang JJ(汪静杰),Zhao DY(赵东洋),Liu YG(刘永贵),et al.Antogonism against Beauveria bassiana by li-popeptide metabolites produced by entophyte Bacillus amyloliquefaciens strain SWB16.Acta Microbiol Sin(微生物学报),2014,54:778-785.
11 Sen R.Surfactin:biosynthesis,genetics and potential applications.Adv Exp Med Biol,2010,672:316-323.
12 Falardeau J,Wise C,Novitsky L,et al.Ecological and mechanistic insights into the direct and indirect antimicrobial properties of Bacillus subtilis lipopeptides on plant pathogens.J Chem Ecol,2013,39:869-878.
13 Roongsawang N,Thaniyavarn J,Thaniyavarn S,et al.Isolation and characterization of a halotolerant Bacillus subtilis BBK-1 which produces three kinds of lipopeptides:bacillomycin L,plipastatin,and surfactin.Extremophiles,2002,6:499-506.
14 Gong GD(龚谷迪),Zhou GT(周广田),Guo Y(郭阳),et al.Study and prospects for properties and identification of lipopeptide surfactin,iturin and fengycin.China Food Addit(中国食品添加剂),2013,3:211-215.
