基于2,4-二硝基氟苯标记氨基酸的高效液相色谱法测定脂肽含量
2019-04-25邵穿石杨世忠郎剑桥杨佳颖牟伯中
邵穿石, 杨世忠, 郎剑桥, 杨佳颖, 牟伯中*
(生物反应器工程国家重点实验室及应用化学研究所,华东理工大学,上海 200237)
脂肽是一类重要的生物表面活性剂,如表面活性素、地衣素、伊枯草菌素、丰原素等,通常由微生物产生[1]。据报道,脂肽主要是环状脂肽,根据脂肪酸与肽间的关系可以分为3类[2],有约90种不同的脂肽[3]。某些脂肽具有抗癌、抑菌、抗凝血作用[4 - 6],促进烃降解[7]及可与金属离子螯合作用[8]。由于脂肽的两亲结构及其表现出的很强表面活性和生物活性,脂肽在许多方面有潜在的用途,如食品、化妆品、药物、环保及采油等领域。
脂肽和许多有活性物质一样,对产生菌及应用的研究和评价离不开定量测定,对脂肽的测定方法较方便的是直接高效液相色谱(HPLC)法[9],样品经简单处理,直接进样测定。根据大部分脂肽中氨基酸与茚三酮在特定条件下反应产生的可见吸收,其摩尔吸收系数相近的特性[10],用光度法也可以测定脂肽[11]。为了测定脂肽中的不同变体,可将脂肽水解后用气相色谱-质谱(GC)法测定[12]。该方法不仅能对脂肽进行定量,还可以定量脂肽中脂肪酸碳数不同的异构体,但反应需要无水状态。本文将提取的一种脂肽(表面活性素)先水解成其组成的氨基酸,然后以2,4-二硝基氟苯标记产生的氨基酸后,采用HPLC法测定标记的目标氨基酸。根据脂肽中氨基酸与标记产物色谱峰面积的线性关系,建立了一种测定脂肽含量的新方法。
1 实验部分
1.1 主要试剂及仪器
亮氨酸、缬氨酸、天门冬氨酸(分析纯,上海捷倍思基因技术有限公司),谷氨酸(生化试剂,上海化学试剂公司),2,4-二硝基氟苯(FDNB)(生化试剂,上海金山兴塔化工厂),NaOH、HCl、三乙胺、乙腈(分析纯,上海凌峰化学试剂有限公司),实验用水为纯水。
质谱仪(Micromass LCT,Manchester,UK);高效液相色谱仪(LC100 plus,上海伍丰科学仪器有限公司,上海)。
1.2 实验方法
1.2.1脂肽的提取取500 mL脂肽发酵液,调节pH>9, 5 000 r/min离心除菌,取上清液,滴加HCl酸化,使pH ≤ 2.0,室温下静置24 h, 5 000 r/min下离心30 min,收集沉淀,在4 ℃下冷冻干燥24 h,得到淡黄色块状固体,用40 mL乙酸乙酯浸提3次,用20 mL水洗涤3次,浓缩并用乙酸乙酯定容至20.0 mL。
1.2.2脂肽的定性取10 mL脂肽发酵液,2 000 r/min离心除菌,在上清液中滴加HCl酸化,使pH≤2.0,用2.0 mL、1.0 mL及1.0 mL乙醚萃取3次。合并乙醚后,用2.0 mL水洗涤3次,吹除乙醚。加入1.0 mL甲醇溶解残留物,用电喷雾质谱(ESI-MS)分析,测定分子量,确定脂肽类型。质谱采用正离子模式,喷射电压为4.8 kV;毛细管电压设置为15 V,以N2为鞘气,流速为50 μL/min;辅助器流速设置为20 μL/min;以He为碰撞气;测定质谱,分析常见脂肽m/z850~1 250 Da范围的质谱图。
1.2.3脂肽水解取一定量的脂肽有机溶液于2.00 mL刻度冻存管中,吹除有机溶剂后,加入1.00 mL 6.0 mol/L NaOH溶液,密封,90 ℃温度下水解24 h[13],或在除去有机溶剂后的脂肽样品中加入标准氨基酸溶液,干燥后,同样用NaOH水溶液水解。水解后的溶液,加入0.50 mL浓HCl,随后用1.0 mol/L稀HCl和稀NaOH溶液调节到中性(用点样毛细管取样检测),用水定容到2.00 mL备用,其中的NaCl浓度为3.0 mol/L。
1.2.4标记反应在试管中加入含3.00 mol/L NaCl的标准氨基酸(2.00 mmol/L Asp、Glu、Val及8.00 mmol/L,相当于2.00 mmol/L脂肽表面活性素中的氨基酸)溶液,补加3.00 mol/L NaCl溶液至0.800 mL,分别加入0.200 mL的三乙胺及1.000 mL 1.0% FDNB-乙腈溶液,充分混匀后,置于75 ℃水浴中加热,反应30 min,冷却,用0.22 μm有机微孔滤膜过滤,滤液用HPLC法测定。
1.2.5液相色谱测定用HPLC仪配备Arcus自动进样器测定,梯度洗脱:0~2 min,2%乙腈水溶液;22 min,25%乙腈水溶液。紫外360 nm波长检测,进样10.0 μL。
2 结果讨论
脂肽水解后疏水部分产生羟基脂肪酸或氨基脂肪酸,亲水部分产生氨基酸。氨基酸酸中通常有一分子谷氨酸/酰胺和天门冬氨酸/酰胺,有多个亮氨酸(Leu),如表面活性素,一分子脂肽中有谷氨酸(Glu)、天门冬氨酸(Asp)、缬氨酸(Val)各一分子,有四分子的Leu酸[10,14]。如果脂肽以Leu的形式测定,灵敏度较以其它氨基酸形式测定的灵敏度要高。拟以测定Leu的方式测定脂肽的含量。
氨基酸的测定在化学及生物化学的研究中有重要意义,具体有气相色谱法(GC)、高效液相色谱法(HPLC)、毛细管电泳法(CE)等。氨基酸本身不易检测,需要用荧光标记试剂或紫外标记试剂标记后检测。硝基氟苯标记氨基酸的产物性质稳定,本文选用硝基氟苯标记氨基酸[15],用HPLC法分离测定Leu的方法来定量脂肽。
2.1 脂肽的类型
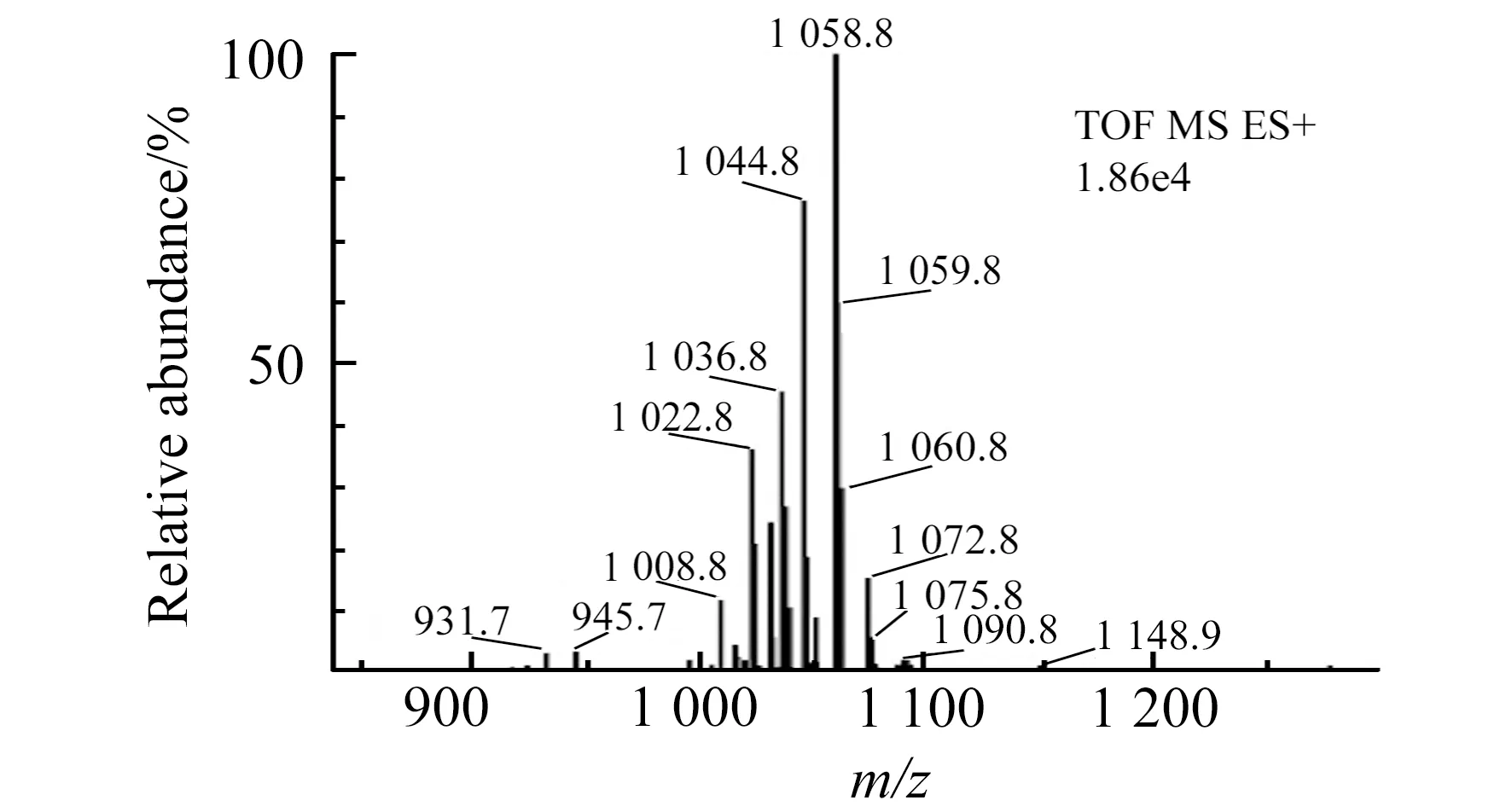
图1 脂肽样品的质谱图Fig.1 The mass spectrum of lipopeptide in sample
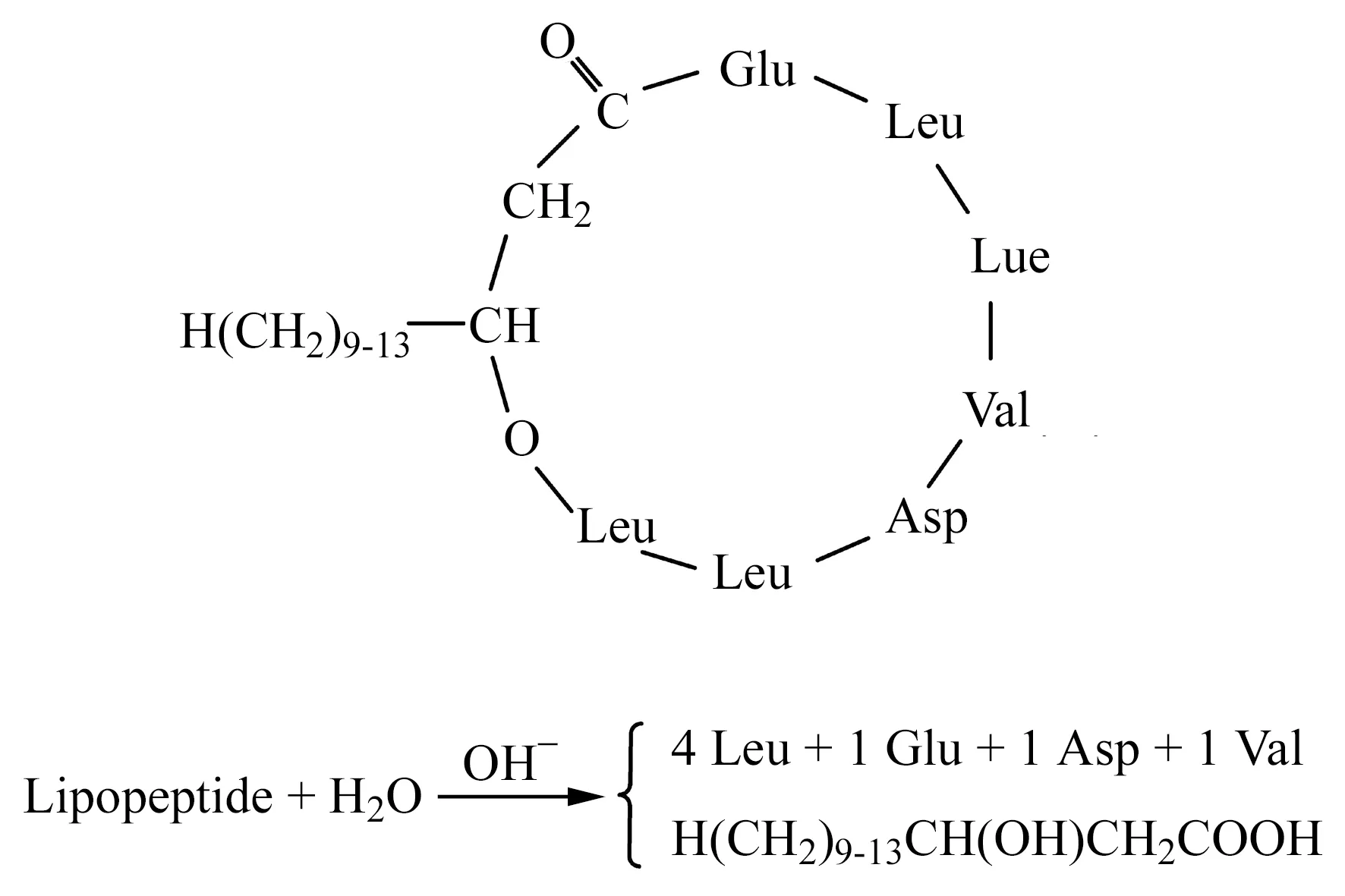
图2 脂肽surfactin的结构示意图Fig.2 The primary structure of lipopeptide surfactin
用电喷雾质谱测定了脂肽正离子化的质荷比,结果见图1。从正离子化质谱图中可见m/z1 008.8、1 022.8、1 036.8 及1 050.7(1 044.8与1 058.8之间)的离子,它们彼此相差14(CH2)的质量,可以认为是同系物。与此相似,m/z1 030.8(1022.8与1 036.8之间)、1 044.8、1 058.8 及1 072.8,也相差14,也为同系物。这两组同系物的质荷比之间相差22。因脂肽的肽部分是强极性的、有电负性大的基团,可以结合H+、Na+等离子后,形成带正电的[M+1]、[M+23]分子离子,它们的质荷比相差22。显然,上述两组质荷比为一同系物的H+离子化和Na+离子化产生的。故其分子量为m/z-1或m/z-23,从而得到分析的脂肽的分子量分别为1 007.8、1 021.8、1 035.8和1 049.8。根据脂肽的结构[2]指纹图谱[3],这些分子与一种重要的脂肽表面活性素的分子量一致,确定该脂肽为表面活性素系列化合物[16]。它们的Leu相同,含有1个Asp、Glu和Val残基及4个Leu残基,水解后产生相应的氨基酸,其结构示意图如图2。脂肽中的羟基脂肪可有C12、C13、C14、C15和C16,其中以C13、C14和C15为主。根据其脂肪酸的比例代表脂肽的比例[12]和相应的分子量,可以计算出脂肽的平均分子量约为1 028 Da。
2.2 色谱上氨基酸的识别

图3 样品标记产物的色谱图Fig.3 Chromatogram of labeled derivetives
含氨基酸Val和Leu的样品、脂肽水解后的样品及脂肽中加入氨基酸Val和Leu水解后的样品,经标记反应,冷却、过滤,HPLC法测定的结果如图3所示。用单一氨基酸标记测定,确定保留时间17.82~18.07 min是标记的Val,保留时间21.10~21.27 min是标记的Leu,Glu及Asp两种氨基酸标记产物在采用的色谱条件下与标记试剂不能分离。氨基酸样品除标记试剂的色谱峰(5~13 min,未画出)外,在保留时间17.82~18.07 min和21.10~21.27 min有两个色谱峰,且面积之比约为1∶4,与配制的比例一致;脂肽经水解释放出其中的氨基酸,标记后的产物在相应保留时间处也出现色谱峰,峰面积的比例也约为1∶4;脂肽加入氨基酸后水解、标记,测定结果也显示,保留时间不变,与脂肽相比峰面积增加,面积比仍然为1∶4。
2.3 氨基酸量与标记产物峰面积的定量关系
按脂肽中氨基酸的组成,配制含3.00 mol/L NaCl的14.0 mmol/L混合氨基酸溶液,其中L-Leu∶L-Val∶L-Asp∶L-Glu的摩尔比为4∶1∶1∶1[17 - 19],这些氨基酸及其比例与广泛存在的重要的脂肽表面活性素相同。取氨基酸溶液0~0.400 mL补加3.00 mol/L NaCl水溶液至0.800 mL,加入0.200 mL三乙胺及1.00 mL标记试剂,混合后于75 ℃水浴中反应30 min。冷却,过滤后用HPLC法记录色谱图,积分Leu标记物的峰面积,其量与积分面积关系见图4A。考虑到碱性水解脂肽,在中和、定容后的盐浓度(3.0 mol/L)及最大取样量(0.800 mL),控制反应体系中NaCl为2.40 mmol。反应后分层,下层为含盐水相,上层为有机相,标记产物主要在有机相。
如要进行均相标记反应,NaCl不能超过0.40 mmol。在含0.40 mmol NaCl介质中反应后,HPLC法测定结果见图4B。
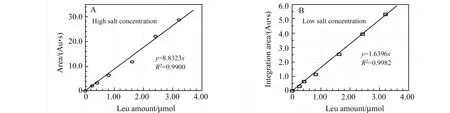
图4 亮氨酸的量与标记产物积分面积的关系 Fig.4 The Relationship between Leu amount and integration area of labeled derivatives A:with 2.40 mmol NaCl;B:with 0.40 mmol NaCl.
从回归方程的线性相关系数看出,氨基酸的量与标记产物的积分面积有很好的线性关系,可以用于Leu的分析测定。因表面活性素中以Leu的比例最高,故以Leu来测定脂肽时灵敏度最高。高盐浓度体系的回归方程斜率大,灵敏度更高,而低盐浓度的线性相关系数大,线性关系更好。为了测定低浓度的样品,采用高盐浓度的反应体系。
2.4 氨基酸的检出限
测定6次无氨基酸的空白样品,在Leu标记物平均保留时间21.18 min前后0.50 min内获得积分面积作为测定的空白值(0.005、0.090、0.061、0.007、0.002、0.000),分别计算平均值0.0275和标准偏差0.038,以3倍标准差作为检出限,将积分面积0.143代入回归方程计算得到检出限是0.0162 μmol亮氨酸(2.12 μg),相当于脂肽0.00405 μmol脂肽(4.16 μg)。标记反应时最多取0.800 mL水解后的中性溶液,故最低检测浓度是5.2 mg/L的脂肽溶液。
2.5 样品的脂肽含量
吸取0.500 mL脂肽提取液干燥、水解,同时吸取0.500 mL脂肽提取液加入0.500 mL标准氨基酸溶液(8.0 mmol/L Leu,相当于2.00 mmol/L脂肽)干燥、水解。经中和,定容至2.00 mL,取0.400 mL,加入3.00 mol/L NaCl溶液至0.800 mL,经过标记反应、冷却、过滤、HPLC法测定。5次测定结果如表1所示。测定结果的重复性较好,相对标准偏差(RSD)<8%,回收率达92.6%。
根据每分子脂肽中含有7分子的氨基酸,其中4分子的亮氨酸,以及脂肽的平均分子量是1 028 Da,利用氨基酸的线性回归方程,可以计算出脂肽提取液的脂肽量(0.253/4=0.0632 μmol)及浓度(0.0632/(0.500×0.400/2)=0.632 mmol/L=0.650 g/L)。

表1 脂肽样品测定结果(n=5)
脂肽是一大类生物表面活性剂,结构上自然具有其多样性,本方法是基于脂肽水解后产生亮氨酸,凡是水解后能产生亮氨酸的脂肽均可用此方法测定。因异亮氨酸与亮氨酸性质非常相近, HPLC法也难将其分开。故含有异亮氨酸的脂肽也能用该方法测定。为了消除其它含有氨基酸的肽类及蛋白质的干扰,可以通过洗涤的办法加以除去[11]。但也有个别脂肽不含亮氨酸及异亮氨酸,这类脂肽不能用该方法进行测定。
不含亮氨酸及异亮氨酸的脂肽是:β-羟基脂肪酸成环环状脂肽稳杆菌肽(Empedopeptin)(8肽)、β-氨基脂肪酸成环环状脂肽伊枯草菌素(Irurins)类,α-氨基脂肪酸成环环状脂肽Trapoxins;脂肪酸接环的环状脂肽括棘白菌素类(Echinocandins)(6肽环),环状芽抱菌素(Circulocinα,β);脂肪酸离环的环状脂肽库尔斯塔克素(Kurstakins)(4环肽/7肽),A21978(10环肽/13肽)/达托霉素(Daptomycin);线性脂肽螺旋形素(Spiroidesin)及线形脂肽TAN1511 A,B。
其它含有亮氨酸及异亮氨酸的脂肽占了大部分,它们是:β-羟基脂肪酸成环环状脂肽,球园菌素(Globomycin)(5肽),短小酸素(Pumilacidins)(7肽),表面活性素(Surfactins)(7肽),地衣素(Lichenysins)(7肽),抗吸附素(Antiadhensin)(7肽),环状缩酚肽(Cyclodepsipeptide A)(7肽),盐杆菌素/异盐杆菌素(Halobacillin/Isohalobacillin)(7肽),节活性素(Arthrofactin)(10肽);脂肪酸接环环状脂肽的环状芽抱菌素(Circulocinγ,δ);脂肪酸离环环状脂肽的丰原素(Fengycin)/制磷脂菌素(Plipastatins)(8环肽/10肽),恶臭溶菌素(Putisolvins)(4环肽/12肽),A54145(10环肽/13肽)的部分,雷莫拉宁(Ramoplanin)(16环肽/17肽),多粘菌素 B(Polymixin)(7环肽/9肽);线形脂肽TAN1511 C[2]。这类脂肽可以用本方法测定。
3 结论
脂肽中的氨基酸经2,4-二硝基氟苯标记,采用HPLC法分离,含量最多的亮氨酸标记物与其它氨基酸的标记物能够很好分离,且氨基酸的量与对应目标物的积分面积有很好的线性关系,据此可以对氨基酸进行定量测定。大部分脂肽水解后能够释放出相应的氨基酸,故该方法也可以用于这类脂肽的定量测定。
