山羊生殖细胞特异报告载体pVASA-EGFP的构建及表达
2015-12-29颜光耀李佩真任才芳王锋张艳丽
颜光耀,李佩真,任才芳,王锋,张艳丽
山羊生殖细胞特异报告载体pVASA-EGFP的构建及表达
颜光耀*,李佩真*,任才芳,王锋,张艳丽
南京农业大学动物科技学院 江苏省家畜胚胎工程实验室,江苏 南京 210095

颜光耀, 李佩真, 任才芳, 等. 山羊生殖细胞特异报告载体pVASA-EGFP的构建及表达. 生物工程学报, 2015, 31(9): 1313–1324.Yan GY, Li PZ, Ren CF, et al. Construction of goat germ cell specific reporting system pVASA-EGFP. Chin J Biotech, 2015, 31(9): 1313–1324.
为监测成体干细胞向生殖细胞分化的过程,分析生殖细胞特异性DEAD-box家族ATP依赖RNA解旋酶在不同日龄山羊睾丸组织中的表达情况并构建山羊生殖细胞特异性报告载体pVASA-EGFP。通过免疫荧光及RT-PCR法监测的表达情况,利用分子技术构建报告载体pVASA-EGFP,脂质体法转染山羊骨髓间充质干细胞 (Bone mesenchymal stem cells,BMSCs),经过视黄酸 (Retinoic acid,RA) 诱导后,观察绿色荧光蛋白表达情况以鉴定该报告载体的有效性。免疫荧光结果显示,Vasa在性成熟不同阶段的山羊睾丸组织中均有表达,RT-PCR结果表明基因在3月龄、10月龄山羊睾丸组织中显著高于10日龄组。测序及酶切鉴定结果表明,扩增的基因启动子片段成功连至N1载体,转染BMSCs后经4 d的RA诱导,发现有绿色荧光蛋白表达,表明成功构建了山羊基因启动子调控的报告载体pVASA-EGFP。以上结果表明,基因在不同日龄山羊睾丸组织中均有表达,所构建的山羊生殖细胞特异性报告载体pVASA-EGFP具有示踪山羊成体干细胞向生殖细胞分化过程的能力,为下一步监测山羊BMSCs向生殖细胞分化的过程提供了鉴定和筛选方法。
DEAD-box家族ATP依赖RNA解旋酶,启动子,生殖细胞,视黄酸,骨髓间充质干细胞,山羊
基因是DEAD-box基因家族的重要成员之一[1],DEAD-box基因家族存在于从细菌到哺乳动物的许多物种中,因其具有高度保守DEAD (Asp-Glu-Ala-Asp) 序列而得名。该蛋白在细胞、RNA代谢中具有重要作用,参与RNA代谢几乎所有的过程,包括转录调控、mRNA前体的剪接、核糖体组装、核内mRNA运输、翻译起始调控等。在绝大多数物种中,基因仅限在生殖细胞系中特异性表达,Vasa蛋白对于生殖细胞的形成和卵子极性的建立以及某些发育基因的mRNA转录调控都具有重要作用,因此作为一种分子标记物广泛用于研究配子发生和原始生殖细胞 (Primordialgerm cells,PGCs) 起源、迁移、分化等方面[2-4]。
随着干细胞的研究手段日益成熟,科学家逐渐利用胚胎干细胞和成体干细胞作为体外的模型,通过各种诱导方式,从体外获得了生殖细胞,从而间接研究生殖细胞的发生、迁移和成熟等各个过程[5-9]。但是通过干细胞体外诱导得到的生殖细胞,较难分离纯化。2009年,Kee等[10]首次构建基因启动子驱动绿色荧光蛋白 (GFP) 表达的载体 (pVASA-GFP),将其转染人胚胎干细胞 (Human embryonic stem cells,hESC) 后通过诱导,分选出绿色荧光阳性细胞——PGCs,此方法为研究其他物种生殖细胞的发生过程提供了思路。
骨髓间充质干细胞 (Bone mesenchymal stem cells,BMSCs) 是一种最为广泛运用的成体干细胞,具有易分离纯化、易鉴定、体外培养方便等特点,并且避免了胚胎干细胞 (Embryonic stem cells,ESCs) 所涉及的伦理道德等问题[11]。因此BMSCs是体外研究生殖细胞的理想模型之一。
本试验首先验证了基因在不同日龄山羊睾丸组织中的表达,然后进一步构建了基因启动子驱动EGFP表达的载体pVASA-EGFP,将其转染经视黄酸 (Retinoic acid,RA) 诱导处理的山羊BMSCs,观察绿色荧光蛋白的表达,从而验证载体的有效性。本试验初步建立了体外成体干细胞向生殖细胞分化的模型,并且通过构建生殖细胞特异的报告载体,为后期分离和纯化转分化得到的生殖细胞提供很好的途径。
1 材料与方法
1.1 材料
山羊睾丸组织由江苏金盛山羊繁育技术发展有限公司提供。载体pEGFP-N1、大肠杆菌DH5α均为南京农业大学动物胚胎工程技术中心保存。LA酶、pMD19-T载体、T4 DNA连接酶、DNA标准品和各种限制性内切酶均购自TaKaRa公司。DNA凝胶回收试剂盒和小量质粒提取试剂盒购自Axygen公司。无内毒素质粒提取试剂盒购自Omega公司。细胞RNA提取试剂盒购自天根公司。细胞基本培养基 (L-DMEM)、胎牛血清、胰蛋白酶、L-谷氨酰胺、丙酮酸钠、青霉素、链霉素均购自Gibco公司。Trizol试剂、反转录试剂和Lipofectamine 2000转染试剂购自Invitrogen公司。引物合成和基因测序由上海英骏生物技术有限公司完成。
1.2 方法
1.2.1 免疫荧光定位不同日龄山羊睾丸组织中Vasa表达
取10日龄、3月龄和10月龄的山羊睾丸组织,经4%多聚甲醛固定后进行石蜡包埋:70%、85%、95%乙醇系列脱水,各1 h,然后100%无水乙醇脱水3次,每次2 h;经50%乙醇和50%二甲苯混合液处理30 min后,二甲苯透明2次,每次30 min;经50%二甲苯和50%石蜡混合液处理30 min后,放入石蜡中过夜处理;包埋后,对修好的蜡块进行切片,厚度为5mm。山羊睾丸组织石蜡切片经常规的二甲苯脱蜡及乙醇系列水化后,用3%甲醇-H2O2处理1 h以消除内源性过氧化物酶,再经柠檬酸三钠 (pH 6.0) 100 ℃抗原热修复处理1 h后,PBS冲洗3次,10%BSA室温封闭1 h;特异性抗体Vasa (ab13840,工作浓度1∶300) 4 ℃孵育过夜,PBS洗涤3次后,二抗为FITC标记的羊抗兔多克隆抗体,在37 ℃下孵育1 h,用PBS洗净后,经DAPI核染,封片观察。
1.2.2 荧光定量PCR检测在不同日龄山羊睾丸组织中的表达特异性
用Trizol试剂提取10日龄、3月龄和10月龄山羊睾丸总RNA,再反转录成cDNA,以此为模板,山羊引物作为内参,进行荧光定量PCR (Quantitative real-time PCR) 检测的表达,引物见表1。按照试剂盒 (TaKaRa公司) 的要求在冰上进行如下体系混合 (20 μL体系):H2O 6.8 µL,引物 (10 µmol/L) 各0.4 µL,模板2 µL,ROX Reference Dye 0.4 µL,SYBR Premix Ex10 µL,混匀离心后在荧光定量PCR仪 (Stepone plus,美国ABI公司) 上反应检测,反应程序如下:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火31 s,72 ℃延伸1 min,共40个循环,反应结束绘制熔解曲线。利用2–△△Ct法对基因在不同日龄山羊睾丸组织中的mRNA表达进行相对定量分析。

表1 荧光定量PCR引物序列
1.2.3基因的扩增与克隆
根据已发表的牛非编码区序列 (GenBank Accession No. NR_103807.1),设计合成引物,上下游引物 (-F/R):5ʹ-GGCAGGAAAGGCGAAGGAG-3ʹ/5ʹ-GCATAACCATCAGGTGGAGAA-3ʹ (下划线分别为Ⅰ和Ⅰ酶切位点)。利用TIANGEN试剂盒方法提取10月龄山羊睾丸基因组DNA,以-F和-R为引物在普通PCR仪上进行反应 (VERITI PCR,美国ABI公司)。反应条件:94 ℃预变性5 min;94 ℃变性45 s,53 ℃退火30 s,72 ℃延伸60 s,共30个循环;72 ℃延伸10 min。预期PCR产物长度应为1 044 bp。
1.2.4 pMD-VASA载体构建与测序
PCR产物经快速回收和pMD19-T载体在T4 DNA连接酶作用下于16 ℃连接。将连接产物转化感受态大肠杆菌DH5α,菌液与IPTG和X-gal按比例混匀后涂布于含100 μg/mL氨苄青霉素的LB平皿上,37 ℃培养过夜。挑取大小均匀的白斑菌落,按照质粒抽提试剂盒说明书小量提取质粒,经Ⅰ与Ⅰ双酶切鉴定,将获得的阳性克隆质粒 (命名为pMD-VASA) 送上海英骏生物技术有限公司测序。
1.2.5 pVASA-EGFP报告载体的构建
将载体质粒pEGFP-N1和测序正确的质粒pMD-VASA分别用内切酶Ⅰ与Ⅰ进行双酶切,琼脂糖凝胶电泳,回收质粒载体和基因片段,T4 DNA连接酶连接过夜,连接产物转化感受态大肠杆菌DH5α,经含氨苄青霉素的LB平皿培养筛选克隆、提取质粒后,用Ⅰ与Ⅰ双酶切鉴定,再送公司测序。测序正确的菌株于37 ℃扩培,利用无内毒素质粒抽提试剂盒提取重组质粒,命名为pVASA-EGFP,测定其核酸浓度备用。
1.2.6 山羊BMSCs的分离培养与体外RA诱导
将1月龄海门山羊快速放血致死,无菌条件下取股骨和胫骨,剔除附着的肌肉组织,置体积分数为75%乙醇中浸泡10 min。用灭菌钢钳剪除两侧骨骺端,再用L-DMEM培养基反复冲洗骨髓腔,收集骨髓液于无菌离心管中,1 000 r/min离心20 min,取沉淀,用含有20%胎牛血清的L-DMEM培养液重悬,轻轻吹打成单细胞悬液。将5 mL细胞悬液接种于25 cm2底面积的培养瓶中,置于37 ℃、5% (体积分数) CO2培养箱内培养,3 d后更换培养液,倒置显微镜下观察细胞形态。待原代细胞接近90%融合时,用胰酶消化,按1∶3传代,一部分继续培养,另一部分置于液氮中保存备用。取第3代BMSCs,按2×104个/mL的细胞密度分别接种于24孔培养板中,对其用浓度为10μmol/L的RA进行体外诱导。
1.2.7 RA诱导后BMSCs中基因表达水平的检测
对RA诱导4 d后的BMSCs进行RT-PCR、免疫荧光检测。用Trizol试剂提取RA处理4 d后的山羊BMSCs总RNA,再反转录成cDNA第一链,加入引物,以山羊引物作为内参,进行PCR扩增,引物见表1。反应条件:94 ℃预变性5 min;94 ℃变性30 s,63 ℃退火30 s,72 ℃延伸30 s,共30个循环;72 ℃延伸10 min。扩增产物经2%琼脂糖凝胶电泳,用凝胶成像系统观察结果。
对RA诱导4 d后的BMSCs进行免疫荧光检测。第3代经RA处理4 d的山羊BMSCs以1×104个/mL接种24孔板,待细胞95%融合后,以4%多聚甲醛固定30 min,0.1 mol/L PBS洗3遍,用含0.25% Triton-X-100的PBS孵育细胞30 min,PBS洗涤3遍后,经5% BSA封闭1 h,以兔源Vasa多克隆抗体 (ab13840,Abcam) 常温孵育1 h,用PBS洗涤5次,每次5 min。二抗为FITC标记的羊抗兔的多克隆抗体,常温下孵育1 h,PBS洗涤5次,每次5 min。Olympus FluoViewTM 500激光共聚焦显微镜观察、拍照并计数。
1.2.8 RA诱导后BMSCs细胞周期测定
取RA诱导4 d的第3代BMSCs,调整细胞含量为5.0×106/mL,1 500 r/min离心5 min,弃上清液,用PBS洗1遍,离心得到细胞团,加入1 mL DNA染色液,涡旋混合5–10 s,室温避光孵育30 min,流式细胞仪检测细胞周期。
1.2.9 重组质粒pVASA-EGFP导入山羊BMSCs中并进行RA诱导
转染前2 d,将BMSCs接种至6孔板中,培养液为含15%胎牛血清,不含青霉素、链霉素的L-DMEM。当细胞汇合80%–90%时,按照Lipofectamine 2000转染试剂说明书的方法将重组质粒pVASA-EGFP转染山羊BMSCs。转染6 h后将培养液换为含15%胎牛血清和青霉素、链霉素各100 U/mL的L-DMEM。转染24 h后进行RA (浓度为10–6mol/L) 诱导。
2 结果与分析
2.1 不同山羊睾丸组织中Vasa蛋白定位及vasa基因mRNA水平表达
本试验对于不同日龄山羊睾丸组织进行了组织的免疫荧光。发现Vasa在不同日龄睾丸组织中均有表达,在10日龄和3月龄的山羊睾丸组织中,Vasa主要在支持细胞和初级精母细胞中表达 (图1A和1B)。在10月龄的山羊睾丸组织中,Vasa在初级精母细胞、次级精母细胞、精子细胞和支持细胞中均有明显表达 (图1C)。
本试验进一步对基因在不同日龄山羊睾丸组织进行mRNA水平的荧光定量RT-PCR检测。发现性成熟的山羊睾丸 (3月龄、10月龄) 中的mRNA水平表达量相对10日龄显著升高 (>0.05,图2),表明在不同性成熟阶段山羊睾丸组织中表达的特异性。
2.2 山羊vasa基因启动子片段的扩增及序列分析
以山羊基因组DNA为模板,PCR扩增后,产物经1.0%琼脂糖凝胶电泳分析,显示为单一条带,大小约为1.0 kb,与预期大小 (1 044 bp) 基本一致 (图3A),切胶回收并送公司测序。克隆片段测序结果和NCBI上牛的序列比对,同源性为99%。将PCR产物连接到pMD19-T载体上,获得重组质粒pMD-VASA,用Ⅰ与Ⅰ对其进行双酶切鉴定,双酶切后片段大小分别为2 692 bp和1 044 bp,与预期结果相符 (图3B)。
2.3 pVASA-EGFP重组质粒的构建与鉴定
将扩增的基因序列 (图3A) 和切掉CMV启动子的pEGFP-N1部分载体4.1 kb (图3B,泳道3、4) 连接。重组质粒pVASA-EGFP (图3C) 分别经与Ⅰ双酶切。结果表明,所插入的基因大小和方向均正确,双酶切后得到4.1 kb和1 044 bp的条带,说明pVASA-EGFP重组质粒构建成功 (图4A)。
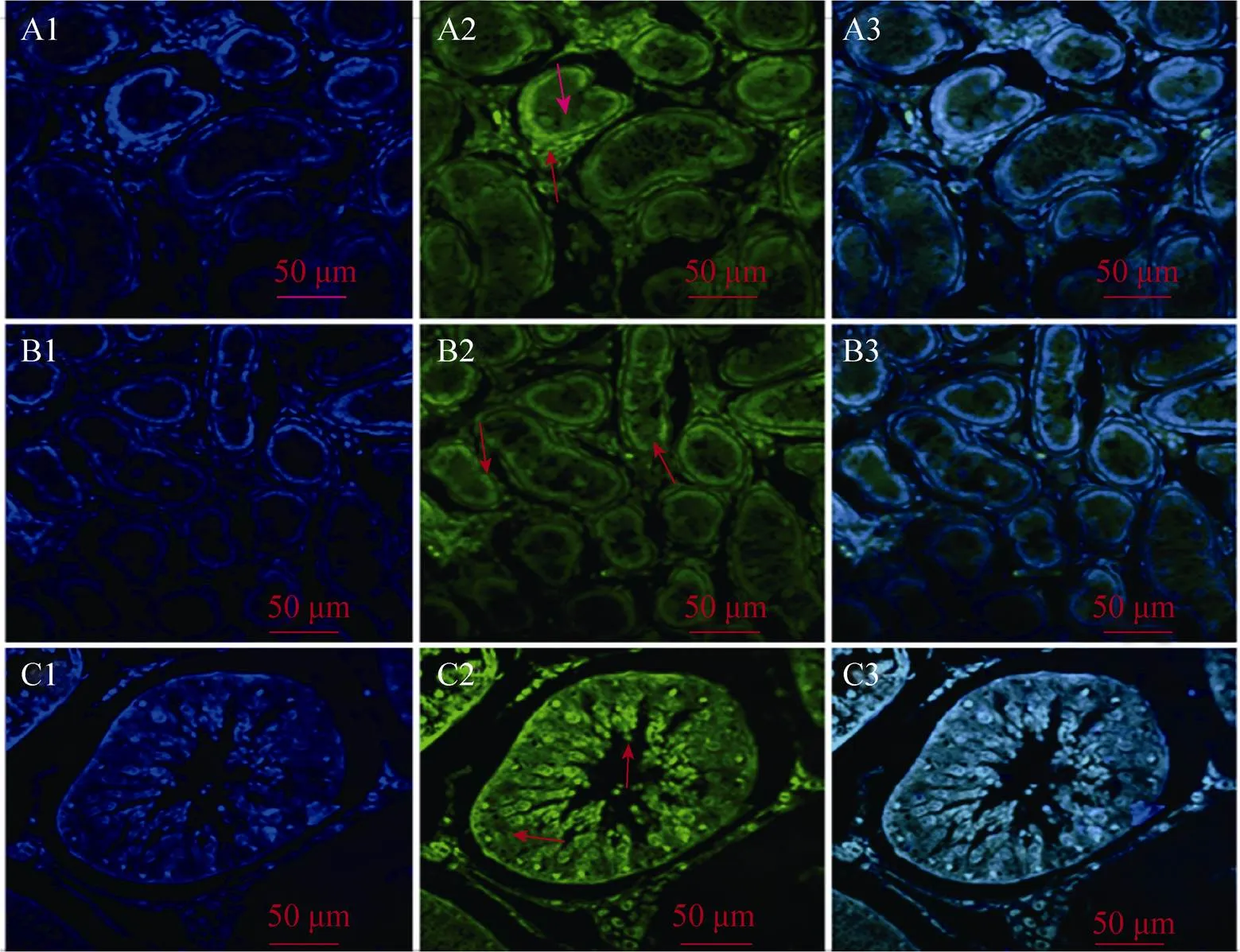
图1 免疫荧光检测Vasa在不同日龄山羊睾丸组织中的表达
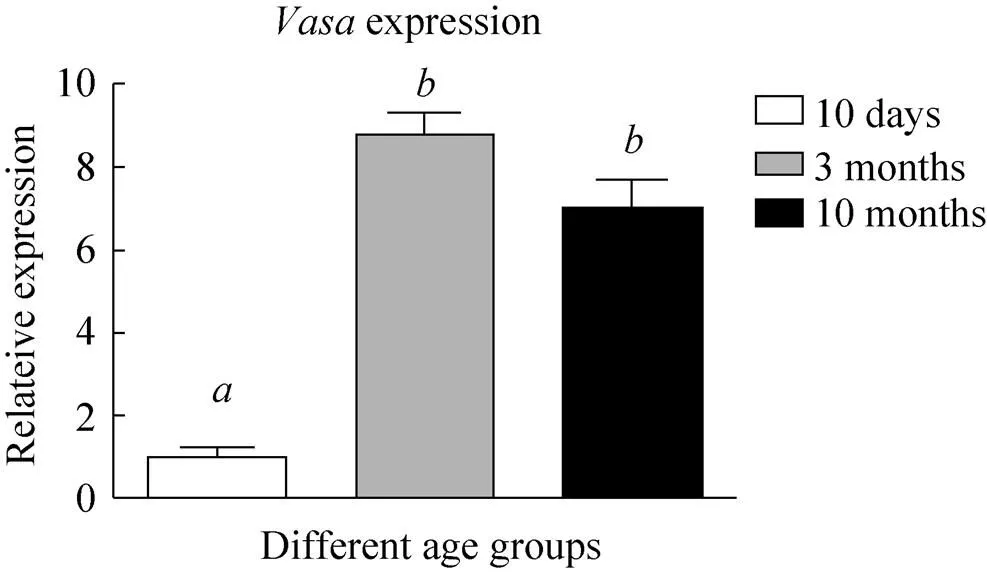
图2 Vasa在不同日龄山羊睾丸组织中的mRNA表达水平
2.4 山羊BMSCs的诱导和诱导后细胞的鉴定
对第3代山羊BMSCs添加RA (10–6mol/L) 进行体外诱导,诱导4 d后的细胞进行形态学观察、RT-PCR、免疫荧光分析。结果表明,细胞变圆变大,核质比升高 (图5),和基因表达升高 (图4B),Vasa蛋白的表达水平升高 (图6)。这些结果表明BMSCs已经开始表达生殖细胞特异的基因,间接说明体外转分化的开始。另外,本试验还对RA诱导前后的细胞进行细胞周期分析,发现诱导前的山羊BMSCs G1期的含量在85% (图7A),而G2期的细胞含量减少至79% (图7B)。
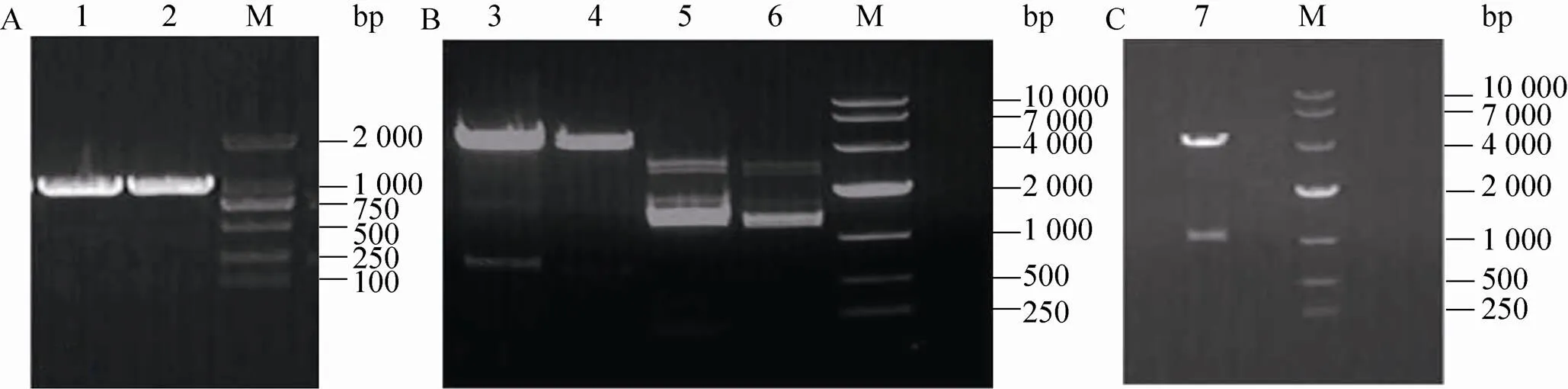
图3 载体构建电泳图

图4 载体图谱和RA诱导的PCR鉴定

图5 RA处理前后细胞的形态图
2.5 pVASA-EGFP重组质粒的转染及诱导后观察
将验证正确的重组质粒pVASA-EGFP转染山羊BMSCs,转染后24 h,进行RA的体外诱导。诱导3 d后,在荧光显微镜下可观察到山羊BMSCs表达绿色荧光蛋白 (图8),进一步验证了所构建报告载体的正确性。试验将山羊成纤维细胞作为阴性对照,RA诱导后,没有观察到绿色荧光蛋白的表达。

图6 免疫荧光检测Vasa在经RA处理前后的BMSCs中的表达
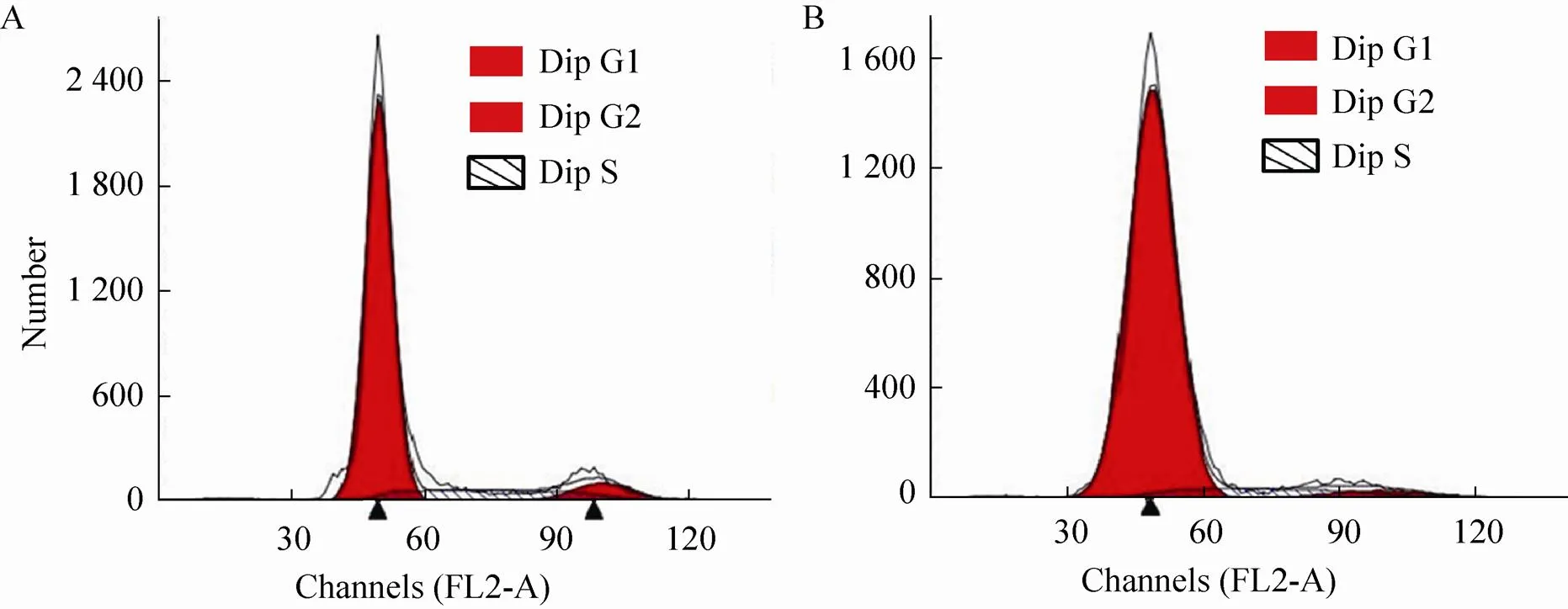
图7 RA处理前后BMSCs细胞周期变化
3 讨论
BMSCs是一群存在于骨髓中具有不断增殖和自我更新能力的成体干细胞,在多个物种中的研究都已经证明了该类干细胞具有体外分化为3个胚层诸多细胞类型的能力,可见BMSCs在分化潜能上几乎可以与ESCs相媲美。而且与ES细胞相比,BMSCs具有取材方便、体外易培养、增殖快和免疫原性低等优点。BMSCs这些独特的生物学特性使其可作为生殖细胞发育分化、基因表达调控的理想研究模型和种子细胞。因此,本试验在山羊BMSCs的基础上,构建早期生殖细胞报告系统,对后续转分化试验提供平台。

图8 山羊BMSCs转染pVASA-EGFP报告载体并经RA诱导3 d后绿色荧光蛋白表达情况
在绝大多数物种中,基因是生殖细胞系的标记分子,这一特点引起了人们对其功能探索的兴趣。早在上世纪80年代,通过对果蝇基因的研究发现:Vasa蛋白是生殖细胞的重要组成部分,基因在所有发育时期的生殖细胞中表达,其在生殖细胞分化过程中发挥重要的作用;雌性基因的突变体可以导致卵子发生缺陷,产生的卵子虽然能够受精,但由该受精卵发育的胚胎缺少生殖细胞。因此,基因不仅在果蝇成体配子发生过程中是必需的,在胚胎发生过程中对生殖细胞的分化也是至关重要的[12]。在小鼠的研究中发现:雄性个体基因突变将致使生殖细胞因不能完成减数分裂而凋亡,最后导致精子无法生成,而且性腺中PGCs的增殖活性显著下降。在本试验中通过对性成熟前后不同阶段的山羊睾丸组织进行mRNA和蛋白水平的检测,亦可发现在性成熟后的表达水平显著上升,可见基因对生殖细胞的增殖和分化都具有重要作用[13-14]。
基因在多数物种间具有高度保守的特性,且其表达在生殖细胞中具有特异性,因此,国内外已有实验室利用基因进行报告载体的构建,并用其进行生殖细胞的示踪和研究。2006年,Okutsu 等[15]通过克隆虹鳟鱼的基因启动子区域,将其和基因片段相连。通过转基因的方法,该试验团队分离出了大量的虹鳟鱼的原始生殖细胞。Tsunekawa等[16]克隆了鸡的同源基因 (Chicken VASA homolog,CVH),构建的特异启动子,成功对鸡的原始生殖细胞进行了定位,为研究鸡PGCs的发生机理和迁移过程提供方法和途径。利用类似的方法,2008年,Fan等[17]通过将斑马鱼的基因启动子和(红色荧光蛋白) 基因相连,利用转基因的方法筛选得到原始生殖细胞。此前基因的研究和应用大多集中于两栖动物中,2009年,Kee等[10]首次构建了携带绿色荧光蛋白报告基因和生殖细胞特异性基因(VASA-GFP) 的重组质粒,经慢病毒载体转染hESC,通过诱导,分选表达基因的早期生殖细胞。
RA是维生素A (VA) 的生物活性代谢物,很多研究表明RA是在哺乳动物减数分裂的起始阶段发挥重要作用[18]。近年来,许多学者将RA作为小鼠性腺减数分裂诱导因子,在雌性小鼠上,RA启动受精12.5 d的PGCs发生减数分裂进行生殖细胞的发育分化;在雄性小鼠中,由支持细胞前体产生的CYP26b1阻止了胎儿期雄性性腺的减数分裂。RA对雄性生育是必需的,在VA缺乏症的小鼠睾丸曲细精管内仅能观察到未分化的精原细胞 (As、Apr、Aal型精原细胞),注射RA或视黄醇24–48 h后,可以观察到停滞的Aa1型精原细胞重新进入细胞周期分化为A1型精原细胞。大量试验证明,长期用RA或视黄醇代替VA来饲养VA缺乏的小鼠或大鼠,会促使一些精子细胞的发生。鉴于RA对生殖细胞不可或缺的作用和生殖细胞体内难以获取的特性,有实验室已经通过RA在体外对ES细胞进行诱导,体外诱导获取生殖细胞,从而研究生殖细胞的发生过程。Kerkis等[19]用RA诱导雄鼠的ESC,经类胚体 (Embryonic body,EB) 分化为精子和卵子,细胞表达生殖细胞特异性标记,将诱导的精卵共培养能形成受精卵并最终发育为桑葚胚、胚泡样结构。虽然ES细胞已逐渐成为体外研究生殖细胞的很好的模型,但ES细胞由于伦理道德等问题的限制,研究者已经尝试在成体干细胞上进行深一步的探索。2006年,Nayernia等[20]通过RA在体外对小鼠的骨髓间充质干细胞进行诱导,和本文异曲同工之处在于报告载体的运用。该小组通过驱动的报告载体筛选表达绿色荧光蛋白的细胞,即体外获得的生殖样细胞。通过分选,将体外诱导后的生殖样细胞进行纯化并鉴定。通过PCR和免疫荧光发现RA诱导后的细胞表达原始生殖细胞和精原干细胞的表面标记、、、、、、、、、、、、和,但是并没有通过RA诱导在体外得到减数分裂后期的生殖细胞。2009年,Hua等[5]报道人类的BMSCs在体外通过RA和睾酮的诱导,也可以使诱导后的细胞表达减数分裂前期和后期的几乎所有分子标记。除了骨髓间充质干细胞,科学家发现人脐带中也可以分离得到成体干细胞。Huang等[21]证实,人脐带间质干细胞 (Human umbilical cord mesenchymal stem cells,HUMSCs) 在全反式维甲酸、睾酮及睾丸细胞条件培养基下诱导分化为生殖细胞,HUMSCs形成的“蝌蚪样”细胞显示生殖细胞特异标记物Oct4 (pouf5)、C-kit、CD49 (falpha-6)、Stella (DDPA3) 和Vasa等蛋白表达。
本试验首先检测了基因在山羊体内的表达情况。结果表明基因在不同日龄的山羊睾丸组织中均有表达,且主要分布在精原细胞、精母细胞以及减数分裂后的精子细胞中。荧光定量PCR说明,在性成熟睾丸组织中的表达较高。这些结果和之前报道相一致[2]。且有报道也表明,敲除会影响生殖细胞的发育[8]。这些结果提示:基因在生殖细胞体内生长发育过程中可能起着重要的作用。另外,本试验还初步建立了山羊BMSCs向早期生殖细胞分化的体外模型。通过RA的体外诱导,细胞形态产生了变化,且表达了、和等生殖细胞特异的分子标记。这些结果间接说明:RA能够在体外诱导山羊BMSCs向早期生殖细胞分化。
我们将构建的pVASA-GFP生殖细胞报告载体转染经RA诱导处理的山羊BMSCs后,可以观察到荧光的表达,但是荧光强度和阳性率不高,这可能是因为荧光表达验证是在RA体外诱导4 d后观察的,且载体是瞬时转染。因此如果进一步优化RA体外诱导时间或进行载体稳定转染,可能可以提高绿色荧光的表达。另外,由于没有完整地克隆出山羊基因启动子全部序列,有可能在未克隆的5'非编码区域存在其他重要的启动子元件,这些元件可能为成功启动后续基因表达有着重要作用。但本试验中绿色荧光的顺利表达说明报告载体的正确性。
从体外分化得到生殖细胞样细胞已成为研究生殖细胞发育机制的新方法,目前已有文献报道从胚胎干细胞和诱导多能干细胞分化得到减数分裂后期的生殖细胞,但是目前还没有报道成体干细胞直接体外分化得到单倍体生殖细胞。本试验成功构建的山羊生殖细胞特异报告载体pVASA-EGFP,为下一步体外诱导山羊BMSCs分化为生殖细胞提供了很好的鉴定和纯化的平台。
[1] Cordin O, Banroques J, Tanner NK, et al. The DEAD-box protein family of RNA helicases. Gene, 2006, 367(2006): 17–37.
[2] Rocak S, Linder P. DEAD-box proteins: the driving forces behind RNA metabolism. Nat Rev Mol Cell Biol, 2004, 5(3): 232–241.
[3] Fabioux C, Pouvreau S, Roux FL, et al. The oyster-like gene: a specific marker of the germline in. Biochem Biophys Res Commun, 2004, 315(4): 897–904.
[4] Xu H, Gui J, Hong Y. Differential expression of vasa RNA and protein during spermatogenesis and oogenesis in the gibel carp (Carassius auratus gibelio), a bisexually and gynogenetically reproducing vertebrate. Dev Dyn, 2005, 233(3): 872–882.
[5] Hua J, Pan S, Yang C, et al. Derivation of male germ cell-like lineage from human fetal bone marrow stem cells. Reprod Biomed Online, 2009, 19(1): 99–105.
[6] Hayashi K, Ohta H, Kurimoto K, et al. Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells. Cell, 2011, 146(4): 519–532.
[7] Yu Z, Ji P, Cao J, et al. Dazl promotes germ cell differentiation from embryonic stem cells. J Mol Cell Biol, 2009, 1(2): 93–103.
[8] Medrano J V, Ramathal C, Nguyen H N, et al. Divergent RNA-binding proteins, DAZL and, induce meiotic progression in human germ cells derived. Stem Cells, 2012, 30(3):441–451.
[9] Hu X, Lu H, Cao S, et al. Stem cells derived from human first-trimester umbilical cord have the potential to differentiate into oocyte-like cells. Int J Mol Med, 2015, 35 (5): 1219–1229.
[10] Kee K, Angeles VT, Flores M, et al. Human DAZL, DAZ and BOULE genes modulate primordial germ-cell and haploid gamete formation. Nature, 2009, 462(7270): 222–225.
[11] Grove JE, Bruscia E, Krause DS. Plasticity of bone marrow-derived stem cells. Stem Cells, 2004, 22(4): 487–500.
[12] Liu N, Han H, Lasko P. Vasa promotes Drosophila germline stem cell differentiation by activating mei-P26 translation by directly interacting with a (U)-rich motif in its 3ʹ UTR. Genes Dev, 2009, 23(23): 2742–27523.
[13] Onohara Y, Fujiwara T, Yasukochi T, et al. Localization of mouse vasa homolog protein in chromatoid body and related nuage structures of mammalian spermatogenic cells during spermatogenesis. Histochem Cell Biol, 2010, 133(6): 627–639.
[14] Tanaka SS, Toyooka Y, Akasu R, et al. The mouse homolog of Drosophilais required for the development of male germ cells. Genes Dev, 2000, 14(7): 841–853.
[15] Okutsu T, Suzuki K, Takeuchi Y, et al. Testicular germ cells can colonize sexually undifferentiated embryonic gonad and produce functional eggs in fish. Proc Natl Acad Sci USA, 2006, 103(8): 2725–2729.
[16] Tsunekawa N, Naito M, Sakai Y, et al. Isolation of chickenhomolog gene and tracing the origin of primordial germ cells. Development, 2000, 127(12): 2741–2750.
[17] Fan L, Moon J, Wong TT, et al. Zebrafish primordial germ cell cultures derived from vasa::RFP transgenic embryos. Stem Cells Dev, 2008, 17(3): 585–597.
[18] Koubova J, Menke DB, Zhou Q, et al. Retinoic acid regulates sex-specific timing of meiotic initiation in mice. Proc Natl Acad Sci USA, 2006, 103(8): 2474–2479.
[19] Kerkis A, Fonseca SAS, Serafim RC, et al.differentiation of male mouse embryonic stem cells into both presumptive sperm cells and oocytes. Cloning Stem Cells,2007, 9(4): 535–548.
[20] Nayernia K, Lee JH, Drusenheimer N, et al. Derivation of male germ cells from bone marrow stem cells. Lab Invest, 2006, 86(7): 654–663.
[21] Huang P, Lin LM, Wu XY, et al. Differentiation of human umbilical cord Whartonʹs jelly-derived mesenchymal stem cells into germ-like cells. J Cell Biochem, 2010, 109(4): 747–754.
(本文责编 陈宏宇)
Construction of goat germ cell specific reporting system pVASA-EGFP
Guangyao Yan*, Peizhen Li*, Caifang Ren, Feng Wang, and Yanli Zhang
Jiangsu Livestock Embryo Engineering Laboratory, College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, Jiangsu, China
To monitor the trans-differentiation from adult stem cells to germ cells, we analyzed theexpression of goat testicular tissues in different ages and constructed the germ cell specific reporting vector pVASA-EGFP. The expression ofwas verified by RT-PCR and immunofluorescence. The vector pVASA-EGFP was constructed by molecular technology, then transfected into goat bone mesenchymal stem cells (BMSCs) by Lipofectamine 2000. Moreover, we observed the expression of the vector through green fluorescent protein (GFP). Immunofluorescence results show that Vasa was expressed in all groups of goat testicular tissues, RT-PCR results show that the levels ofmRNA in 3-month group and 10-month group were significantly higher than that in 10-day group. Sequencing and restriction enzyme results show that the vector was successfully constructed. After transfection and RA treatment, GFP expression was observed, which proved the validity of our reporting system. All the results proved thatwas expressed in different ages in goat testicular tissues, and the vector pVASA-EGFP is efficient in monitoring the trans-differentiation, which paves the way for further characterization and screening of the trans-differentiation of goat BMSCs.
DEAD-box protein family of RNA helicases, promoter, germ cell, retinoic acid, bone marrow mesenchymal stem cells (BMSCs), goat
10.13345/j.cjb.140623
December 15, 2014; Accepted:April 15, 2015
National Natural Science Foundation of China (No. 31201802), the Fundamental Research Funds for the Central Universities (No. KYZ201211), PhD Program Foundation of the Ministry of Education of China (No. 20120097120038).
Feng Wang. Tel:+86-25-84395381; E-mail: caeet@njau.edu.cn Yanli Zhang. Tel:+86-25-84395381; E-mail:zhangyanli@njau.edu.cn
*These authors contributed equally to this study.
国家自然科学基金 (No. 31201802),中央高校基本科研基金 (No.KYZ201211),国家教育部博士点基金 (No.20120097120038) 资助。
2015-05-25
http://www.cnki.net/kcms/detail/11.1998.Q.20150525.1038.001.html
